INTRODUCCIÓN
La brucelosis es una zoonosis cosmopolita, que ocasiona más de medio millón de casos anuales en humanos, especialmente en países en desarrollo (Olivares et al., 2017). En Latinoamérica, la mayor incidencia se presenta en Argentina, Perú y México (Méndez et al., 2013). La infección por Brucella spp en los humanos es frecuentemente sub-reportada (Sánchez-Jiménez et al., 2013).
El patógeno pertenece a una bacteria de la familia Brucellaceae, cocobacilo pequeño gram negativo, intracelular facultativo, aerobio y de lento crecimiento (Álvarez-Hernández et al., 2015). El género consta de 12 especies de Brucella (Hensel et al., 2018), siendo consideradas como zoonóticas B. abortus, B. melitensis, B. suis, B. canis y B. inopinata, transmitidas directa o indirectamente por el bovino, cabra, cerdo y perro, respectivamente (Gyles et al., 2010); sin embargo, se desconoce la especie que transmite B. inopinata (Álvarez-Hernández et al., 2015).
Las bacterias pueden mantenerse viables por varios meses en el agua, fetos abortados, heces, equipo y ropa bajo alta humedad alta, baja temperatura y poca luz solar (Martínez, 2013). También se puede encontrar en el semen, orina, heces, saliva y secreciones oculares y nasales (Corbel, 2006; Álvarez-Hernández et al., 2015). La vía directa de infección para los humanos es a través del manejo de animales infectados (o sus secreciones) por medio de abrasiones de la piel, mucosas e inhalación de aerosoles, mientras que la vía indirecta es a través de la ingesta de productos cárnicos crudos y derivados lácteos crudos o no pasteurizados (Álvarez-Hernández et al., 2015).
La Organización Internacional del Trabajo (ILO) clasifica la brucelosis dentro de la categoría de enfermedades infecciosas de origen bacteriano relacionadas con salud ocupacional (ILO, 2005) y el Ministerio de Salud de Chile (MINSAL) la declara enfermedad de notificación inmediata (ILO, 2005; MINSAL, 2011). Las personas con mayor riesgo de contraer la patología son trabajadores de laboratorios, mataderos, clínicas veterinarias y ganaderos (Tuemmers et al., 2013; Álvarez-Hernández et al., 2015).
Los signos clínicos y síntomas asociados en el humano son fluctuantes e inespecíficos, lo que dificulta el diagnóstico. La forma aguda septicémica, corresponde a la mitad de los casos reportados (Vega López et al., 2008), presentando fiebre ondulante (39-40 °C), escalofríos, astenia, dolores articulares y musculares entre otros (Maguiña et al., 2004; Medicins Sans Frontieres, 2016; Olivares et al., 2017). En la forma crónica, se presenta astenia física y psíquica, sudores, polialgias (Medicins Sans Frontieres, 2016), pudiendo desarrollarse por semanas a meses (Vega López et al., 2008).
Entre las pruebas serológicas para el diagnóstico de brucelosis se encuentra la técnica de Aglutinación en Tubo de Wright-Huddleson que mide anticuerpos IgM-IgG (MINSAL, 2011); sin embargo, en Chile se requiere pruebas capaces de detectar positivos con títulos >1:80 (Olivares et al., 2017). El ELISA (IgG, IgM) presenta una sensibilidad del 95.3% y una especificidad del 95.1% (Rivera et al., 2003), siendo de utilidad en las fases agudas y crónicas de la enfermedad (Ministerio de Salud, 2011). En cuanto a pruebas moleculares, el PCR en Tiempo Real permite diferenciar casos agudos y crónicos (MINSAL, 2011) con una sensibilidad del 94.9% y una especificidad del 96.5% (Morata et al., 2003). El hemocultivo y aislamiento de Brucella spp continúa representando la técnica de referencia para brucelosis (Ministerio de Salud, 2011; Martínez, 2013), aunque por la naturaleza intracelular facultativa y la bacteremia intermitente no siempre es factible obtener una muestra adecuada (Versalovic et al., 2011).
La brucelosis humana, en Chile es una enfermedad clínica de baja ocurrencia y se le considera como de incidencia desconocida (Martínez, 2013). Se reporta una incidencia de 0.55 casos por 100 mil habitantes, sin embargo, se informa que su incidencia debiese ser entre 10 a 25 veces mayor a la reportada nacionalmente (Olivares et al., 2017). En un análisis de datos secundarios (2001-2010) del Sistema enfermedad de notificación obligatoria (ENO) del MINSAL y del Instituto de Salud Pública (ISP) con 90 casos notificados se reportó 77% por brucelosis no especificada, 16% por B. abortus, 4% por B. melitensis (importada), 2% para otras brucelosis, 1% por B. suis y ningún caso para B. canis (Martínez, 2013). Sin embargo, el Instituto de Salud Pública aisló 11 cepas de B. abortus,3 de B. canis y 1 de B. melitensis (caso importado) desde pacientes enfermos y hospitalizados en Chile entre 2009 y 2014 (ISP, 2014). La vigilancia para brucelosis en Chile, según el D.S. N.° 158/04 del MINSAL, es universal e inmediata, debiendo notificarse los casos a las Secretarías Regionales Ministeriales de Salud (SEREMI) correspondiente (Ministerio de Salud, 2011).
En el caso de los animales en Chile, el ServicioAgrícola y Ganadero (SAG) inició el control de la brucelosis bovina en 1975, disminuyendo la prevalencia de 7% en 1975 a 2.9% en 1982 (Martínez, 2013). En 1991 se inició el programa de erradicación de la brucelosis bovina en el país, siendo actualmente la prevalencia de brucelosis bovina en el país de 0.4%, habiéndose erradicado Brucella melitensis del ganado caprino en 1987 (Ministerio de Salud de la Nación, 2013). En el caso de caninos domésticos urbanos se indica una prevalencia entre el 7 y 30% (Tuemmers et al., 2013; Weinborn et al., 2014). El último estudio publicado sobre brucelosis canina en Santiago de Chile arrojó un 8.7% de seropositividad a ELISA indirecto (Sánchez, 2017); sin embargo, para la población humana con riesgo se tiene el dato de 2005 en donde B. canis tuvo una prevalencia del 4% determinada por inmunofluorescencia indirecta (Valenzuela et al., 2005).Ante esto, el objetivo de esta investigación fue conocer la actual seroprevalencia de la brucelosis en una población con riesgo ocupacional.
MATERIALES Y MÉTODOS
El estudio se efectuó en las ciudades de Talca (Región del Maule) y en Puerto Montt (Región de los Lagos) del centro sur de Chile. Se invitó a participar a alumnos vigentes de la carrera de Medicina Veterinaria de una universidad privada y a médicos veterinarios, personal técnico y/o administrativo de clínicas veterinarias de pequeños animales de ambas ciudades. Como criterios de inclusión se consideraron todos aquellos individuos mayores a 18 años que trabajasen o desarrollasen sus actividades prácticas académicas en los hospitales clínicos de la universidad y en clínicas veterinarias de pequeños animales de las dos ciudades, independiente de edad, sexo o función.
El cálculo de tamaño muestral se obtuvo mediante la fórmula de poblaciones infinitas, ya que se desconocía la cantidad de personas con riesgo ocupacional, con un nivel de confianza del 95% y una precisión del 4% (Valenzuela et al., 2005), obteniendo como resultado un n de 92 muestras. No obstante, se trabajó con 98 muestras que cumplieron con los criterios de inclusión. La población se estratificó con base a su «función» como médicos veterinarios (profesionales que trabajasen en las clínicas), alumnos (estudiantes de pregrado de la carrera de medicina veterinaria) y otro personal (todo individuo que trabajase en clínica veterinaria que no fuera médico veterinario o alumno). Para la categoría «ciudades» se consideraron Puerto Montt y Talca.
Todos los participantes firmaron un documento de consentimiento informado (Resolución N.° 09/2013 del Comité de Ética de la Universidad Santo Tomás). Posteriormente, se realizó la toma de muestra de sangre en tubos sin EDTA. Las muestras fueron centrifugadas a 1512 g durante 5 min para la obtención de los sueros (mínimo 500 µl), los que fueron almacenados a -20 ºC hasta su procesamiento. Los sueros fueron enviados al servicio del Laboratorio Clínico del Centro Médico San Joaquín de la Pontificia Universidad Católica de Chile, ubicado en la ciudad de Santiago.
Se realizó la prueba de aglutinación en tubo de Wright Huddleson, siendo considerado como positivo un título de anticuerpos >1/80. Esta prueba utiliza la reacción de aglutinación entre parte de la Brucella (B. abortus y B. melitensis) y anticuerpos (Cenogenics® Labs). En esta prueba, primero se lleva a cabo la reacción de Huddleson, la que consiste en una reacción de aglutinación rápida en placa donde se enfrentan cantidades decrecientes del suero a investigar con cantidades constantes de antígeno y se observa la presencia o no de aglutinación. Es una prueba tamiz para el diagnóstico de Brucella spp en humanos (Lucero et al., 2008). El grado de aglutinación en cada una de las diluciones puede clasificarse como positiva en caso de aparecer algún grado de aglutinación (Burgos y Escobar, 2006), como incompleta si la aglutinación es parcial, y negativa en caso de ausencia total de aglutinación. En los casos positivos, se realiza una prueba de aglutinación lenta en tubo o de Wright (SAT) y 48 horas después se leen las reacciones de aglutinación (Herrera y Cárdenas, 2003). Esta prueba, basada también en la aglutinación de una suspensión de Brucella inactivadas, enfrenta por un lado, una cantidad constante de antígeno, y por otro, diluciones crecientes de suero a investigar, detectando IgM e IgG (Paredes, 2012). Para la técnica de Huddleson, los valores de confiabilidad diagnóstica descritos son 54.9, 100, 100 y 8.5%, para los parámetros de sensibilidad, especificidad, valores predictivos positivo y negativo, respectivamente (Barrera y Castellanos, 2010).
El estudio fue de tipo descriptivo y transversal. Los resultados fueron expresados en frecuencias relativas, frecuencias absolutas, utilizando los programas Microsoft Excel 2007® y Graphpad Prism v. 7.0®, empleando el test exacto de Fischer o el Chi cuadrado para asociar los grupos. Se consideró un valor de p<0.05 como significativo.
RESULTADOS
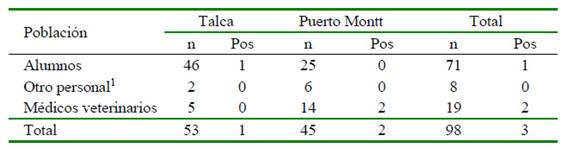
Se muestrearon a 71 alumnos, 19 médicos veterinarios y 8 como parte de «otro personal» (Cuadro 1). Se obtuvo una seropositividad de 3% (3/98), siendo 1.8% (1/53) para Talca y 4.4% (2/45) para Puerto Montt, sin diferencias significativas entre grupos.
DISCUSIÓN
El único individuo positivo en Talca fue un estudiante, mientras que los dos casos positivos en Puerto Montt correspondieron a médicos veterinarios. Dado el pequeño número que resultó positivo a la Reacción Wright-Huddleson no se pudo establecer diferencias estadísticas según las funciones laborales que desempeñan dentro de las clínicas; sin embargo, el estrecho contacto con animales, trabajo con animales e incluso trabajo en laboratorios con este tipo de bacterias es un factor que pone en riesgo al humano para adquirir esta zoonosis (Hensel et al., 2018).
Valenzuela et al. (2005) evaluó el riesgo ocupacional para B. canis en Chile, con una muestra de 100 veterinarios y peluqueros caninos mediante la técnica de inmunofluorescencia indirecta (IFI) y contrainmunoelectroforesis (CIEF), obteniendo 4% de seropositividad; resultado similar al del presente estudio, aunque ciertamente con técnicas serológicas diferentes. Anivel internacional, se ha reportado 3.6% de seropositividad por B. canis (Krueger et al., 2014), datos que coinciden con los resultados del actual estudio, aunque en la presente investigación no se pudo establecer la especie, ya que las técnicas serológicas utilizadas describen algunas reacciones cruzadas con bacterias gram negativas, como por ejemplo Pseudomonas spp o Bordetella bronchiseptica, entre otras (Pardo et al., 2009; Hensel et al., 2018), de allí que se deberían aplicar pruebas adicionales, tanto serológicas pareadas como hemocultivos para su posterior identificación genómica. Los resultados obtenidos como seropositivos deben ser interpretados en conjunto con la signología clínica, ya que esto permitiría inferir que el paciente ha sido expuesto a la enfermedad (Ministerio de Salud, 2011). En el presente estudio, el estudiante de Talca describió haber presentado signología clínica compatible, como lindoadenopatía, fiebre, mialgia y escalofríos unos meses previos al análisis de la muestra.
Respecto a las técnicas serológicas utilizadas en la presente investigación, se describe 54.9% de sensibilidad, 100% de especificidad, 100% de valor predictivo positivo (VPP) y 8.5% de valor predictivo negativo (VPN), lo que indica una ausencia de falsos negativos de 54.9%, valor bastante bajo, pero 100% de ausencia de falsos positivos, con 100% de probabilidad de obtener un diagnóstico verdadero positivo y 8.5% de probabilidad de obtener un diagnóstico verdadero negativo (Barrera y Castellanos, 2010), datos que permiten inferir que los individuos seropositivo, en la presente investigación tienen una alta probabilidad de ser positivos. No obstante, no fue posible identificar la especie de Brucella que estaría dando positivo.
Es vital tener presente que los estudios de seroaglutinación lenta en tubo presentan dos inconvenientes: su falta de sensibilidad que no permite una detección precoz y la dificultad en interpretar los resultados y en particular los títulos bajos. Esto determina la necesidad de realizar pruebas diagnósticas complementarias, ya que puede ser negativa en las primeras etapas de la infección y en infecciones crónicas (Cabrera et al., 2005). Sin embargo, en el presente estudio los individuos seropositivos fueron consistentes en ambas técnicas.
La seroprevalencia encontrada demuestra la necesidad de una mayor vigilancia epidemiológica de esta zoonosis, sobre todo en personas. En particular, en Talca se tiene una población 7% de seropositividad a brucelosis en perros vagabundos (Weinborn et al., 2014). El problema radica en que aunque existe una obligatoriedad para médicos cirujanos de denunciar la brucelosis (Ministerio de Salud, 2004), independiente del origen animal, para los médicos veterinarios, a excepción de quienes trabajan en planteles con certificación del SAG para especies de abasto, no rige dicha obligación, por lo que muchas veces por desconocimiento y por no existir políticas de salud pública que consideren de manera integrada a los diferentes profesionales y todas las especies animales hace que los casos detectados no sean denunciados. En el caso de los médicos veterinarios, es necesario capacitar para que puedan diagnosticar y reconocer esta patología como de denuncia obligatoria, independiente de la especie, y así educar a la población general para evitar riesgos de zoonosis por estrecho contacto con animales.












 uBio
uBio