INTRODUCCIÓN
Los peces denominados tilapia (géneros Oreochromis, Tilapia y Sarotherodon) presentan una serie de características biológicas intrínsecas como rápido crecimiento, resistencia a las enfermedades y a las condiciones adversas, eficiente conversión alimenticia, alta fecundidad, maduración gonadal temprana, aceptación de alimentos artificiales, y carne de excelente sabor y textura (Popma y Lovshin, 1996; Popma y Maser, 1999).
Los hábitos reproductivos y la organización social de las tilapias tienen grandes implicaciones en su crianza, pues estos factores guardan estrecha relación con su madurez sexual (Coward y Bromage, 2000). Las tilapias del género Oreochromis presentan cuidado parental, o sea, incubación y protección en la boca de la madre de los huevos y larvas durante los primeros días de vida. El género Tilapia presenta cuidado biparental y desove en substrato (Peters, 1983), mientras que en el género Sarotherodon el cuidado parental también es en el interior de la boca, tanto de las madres como de los padres (Zimmermann, 2005).
En el género tilapia, se ha observado que el tamaño de las hembras adultas no es homogéneo, pudiendo encontrarse en los estanques tanto individuos grandes como pequeños (Tahoun et al., 2008; Perea-Ganchou et al., 2017). Según Little (1989), las hembras de menor tamaño producen más huevos por unidad de peso vivo, mientras que las más grandes producen mayor cantidad de huevos por desove. En la especie O. niloticus se ha determinado que a medida que la talla se incrementa la fecundidad es mayor (Santos et al., 2007; Moura et al., 2011; Mohamed et al., 2013), aunque Desprez et al. (2008) no encontraron relación entre la variación del peso corporal y la fecundidad.
La proporción hembra macho (H:M) afecta la eficiencia reproductiva, aunque los resultados han sido muy variados. Así, por ejemplo, la relación 1:1 en la variedad Chitralada (O. niloticus) es más eficiente en la producción de huevos (Logato et al., 2004). En tilapia híbrida (O. niloticus x O. aureus), las relaciones 2:1 y 3:1 fueron superiores en la producción de semillas/hembra/día y semillas/kg/hembra/día, que las proporciones 4:1 y 5:1 (Siddiqui yAl-Harbi, 1997). En la variedad común de O. niloticus, Salama (1996) reportó una notable disminución en la producción de larvas, según la proporción H:M desciende de 5:1 a 2:1. En la tilapia azul (O. aureus), Khalfalla et al. (2008) encontraron que la relación 2:1 produjo mayor número de semillas/hembra (911±11) que las relaciones 1:1 y 3:1 (855±17 y 767±11, respectivamente). Otros estudios no han encontrado diferencias estadísticas entre las proporciones sexuales evaluadas, ni en los sistemas de producción utilizados (Delgado, 1985; Bautista et al., 1988; Ridha y Cruz, 1998; Muntaziana et al., 2011; Perea-Ganchou et al., 2017).
El efecto de la variedad también ha sido objeto de evaluación, con resultados variables en los parámetros reproductivos evaluados. Nandlal et al. (2001) encontraron que la variedad Chitralada de O. niloticus tuvo mejor comportamiento productivo que las variedades O. mossambicus, Israel y Roja (Oreochromis spp). Ridha (2010), de otra parte, no encontró diferencias significativas en la producción total de semillas (huevos y larvas) y en la fecundidad entre la tilapia Nilótica (O. niloticus) y una variedad genéticamente mejorada de la misma (GIFT, Genetic Improvement of Farmed Tilapia. Asimismo, Almeida et al. (2013) evaluando las variedades Supreme (SUP), PremiumAquabel (PA) y Chitralada (CHI), reportaron que PA fue significativamente superior en peso de los huevos/hembras, volumen de los huevos y número de huevos/kg de hembra.
El objetivo del presente estudio fue evaluar el efecto de la variedad, el tamaño de las hembras y la relación hembra macho sobre la producción de huevos de tilapias del género Oreochromis mantenidas en tanques de concreto, en una unidad de producción piscícola localizada en el PiedemonteAndino del estado Trujillo, Venezuela.
MATERIALES Y MÉTODOS
Ubicación del Estudio
El estudio se realizó entre marzo y mayo de 2013 en una unidad de producción piscícola comercial ubicada en el municipio Andrés Bello, estado Trujillo, Venezuela, que corresponde a zona de vida de Bosque Seco Tropical. Se encuentra a una altura de 45 msnm y presenta temperatura media anual de 29 ºC, humedad relativa de 71% y precipitación promedio de 1508 mm/año.
Manejo de los Peces
El trabajo se realizó con dos poblaciones de reproductores (machos y hembras) de tilapia, Taiwanesa roja (Oreochromis mossambicus x O. niloticus) y Nilótica variedad Chitralada (Oreochromis niloticus). Este plantel de reproductores fue fundado a partir de un lote de larvas traídas de Taiwán y Tailandia, respectivamente, en enero de 2005. El lote fundador original de reproductores ha sido sustituido continuamente por grupos seleccionados de descendientes, luego de alcanzar la madurez reproductiva.
Todas las hembras de cada variedad fueron pesadas, medidas y clasificadas de acuerdo con el peso como grandes y pequeñas. En la variedad Chitralada (CH), el peso y longitud promedio correspondiente a ejemplares pequeños (CP; n=35) y grande (CG; n=35) fue de 183.0 ± 39.0 g y 19.1 ± 2.8 cm; y 441.0 ± 95.9 g y 24.8 ± 2.2 cm, respectivamente. En la variedad Taiwanesa roja (TR) fue de 210.8 ± 44.9 g y 19.5 ± 1.5 cm en pequeñas (RP; n=35), y 375.4 ± 77.7 g y 22.1 ± 5.2 cm en las grandes (RG; n=35). En los machos CH (n=40) el peso y la longitud fueron 352 ± 611 g y 24.1 ± 2.3 cm, mientras que en TR (n=40) fue de 372.2 ± 35.0 g y 22.6 ± 2.9 cm, respectivamente.
Los ejemplares (machos y hembras) se mantuvieron en reposo reproductivo por al menos 30 días previos al inicio del estudio. Una semana antes de iniciar la recolección de los huevos, hembras y machos se colocaron aleatoriamente en seis tanques rectangulares de concreto (un estanque por cada relación; Figura 1) de 12.5x3x1.3 m de largo, ancho y alto, respectivamente, a fin de que se adapten a las condiciones experimentales.

Figura 1 Grupos experimentales de tilapias (Oreochromis spp) criadas en tanques de concreto, según la variedad, talla y relación hembra macho
Los ejemplares se alimentaron tres ve-ces/día (4% de biomasa) con un alimento balanceado comercial (28% de proteína cruda). El nivel de agua fue mantenido en 1.2 m durante todo el experimento, excepto durante recolección de huevos, tiempo en el cual el nivel de agua se redujo hasta 30-40 cm para facilitar la captura de los reproductores. Se aplicó aireación constante (Blower de 1.5 HP) y un flujo de agua (50 L/min: 0.83L/s) diario para renovar el25% del volumen de agua. Diariamente se determinaron los parámetros fisicoquímicos del agua: oxígeno (4.9 ± 0.45 gmL-1), temperatura (28.2 ± 0.36 ºC), pH (7.5 ± 0.09), transparencia (39.2 ± 0.96 cm), amonio (NH4+; 0.2 ± 0.04 mgL-1), dureza (40.2 -46.4 mg/L-1) y alcalinidad (39.0 -40.3 mg/L-1).
Recolección de Huevos
Cada siete días, y por ocho semanas consecutivas, las hembras de ambas variedades fueron capturadas en los tanques con un salabardo de nylon Stell con luz de malla de 2.5 mm, y revisadas individualmente para determinar su estado reproductivo (vacías o en fase de incubación bucal de huevos o lar-vas). Las hembras grávidas (con huevos o larvas en la boca) se colocaron en recipientes plásticos de 20 L para ser sometidas a un proceso de desove manual, de acuerdo con protocolos previamente descritos (Little, 1989; Little et al., 1993; Little y Hulata, 2000; Bhujel, 2000).
Luego de cada desove manual, los huevos fueron transferidos a viales plásticos (20 ml) con tapas de diferentes colores según la clasificación corporal de las hembras evaluadas. Todos los huevos recuperados de cada hembra fueron pesados por separado con una balanza digital (US-absolute, precisión 0.01 g) y se determinó el volumen de huevos por desove utilizando tubos graduados cónicos de 15 ml (Naglene®).
De cada desove se tomó una alícuota de 1 ml de huevos para determinar el número de huevos por mililitro. De acuerdo con el grado de desarrollo, los huevos se clasificaron en tres fases (Ridha y Cruz, 2003; Ridha, 2010; Muntaziana et al., 2011): embrionados o en fase 1 (F1) cuando el embrión está dentro del huevo no eclosionado; en proceso de eclosión o en fase 2 (F2) cuando la larva está parcialmente fuera del huevo o en proceso de eclosión y con presencia visible del saco vitelino; larvas o en fase 3 (F3) cuando se ha completado la eclosión, absorción del saco vitelino y natación libre (Perdomo-Carrillo et al., 2017). Las larvas se consideraron solo como un evento reproductivo, y para fines de este estudio no se cuantificó ni el número ni el volumen de estas, dado que en las condiciones experimentales del estudio no se pudo garantizar la captura total de larvas eclosionadas.
Variables Evaluadas
Se consideraron los efectos de la variedad de tilapia (Taiwanesa roja y Chitralada), tamaño (grande y pequeña) y relación Hembra:Macho (1H:1M; 2H:1M; 3H:1M) cuya combinación determinó los 12 grupos experimentales indicados en la Figura 1. El desempeño reproductivo de las hembras fue evaluado por medio de las siguientes variables: volumen de los huevos (ml), peso de los huevos (g), número de huevos/ml, peso/huevo (mg), volumen/huevo (mm3) y número de huevos por cada 100 hembras.
Se determinó, además, la frecuencia de desove (número de desoves durante el periodo de estudio), la fecundidad absoluta (número de huevos totales desovados por hembras) y la fecundidad relativa (número de huevos por unidad de peso de las hembras) (Godinho, 2007; Mair et al., 2004; Tsadik y Bart, 2007). Se calculó el número de huevos por desove multiplicando el volumen (expresado en mililitros) de huevos desovados por el número de huevos por mililitro. Se estimó el peso de cada huevo (peso/huevo) dividiendo el peso de los huevos desovados, expresado en gramos, entre el número de huevos por desove, y se multiplicó por 1000 para expresarlo en miligramos. Se calculó el volumen de cada huevo (volumen/huevo) dividiendo el volumen de los huevos desovados, expresado en mililitros, entre el número de huevos por desove, y se multiplicó por 1000 para expresarlo en milímetros cúbicos.
Diseño Experimental y Análisis Estadístico
El diseño siguió un arreglo factorial 2x2x3 (dos variedades x dos tamaños x tres proporciones sexuales) (Figura 1). El efecto de las variables independientes (tamaño, variedad y relación hembra macho) sobre las variables dependientes (volumen de los huevos, peso de los huevos, número de huevos/ml, peso/huevo y volumen/huevo, número de huevos por cada cien hembras, fecundidad absoluta y fecundidad relativa) fue evaluado mediante el análisis de varianza aplicando el modelo lineal general (GLM) del SAS v.9.3, previa transformación al logaritmo 10 de la variables dependientes, dado que no cumplieron los supuestos de normalidad al aplicarse la prueba de Shapiro-Wilk. Las diferencias entre medias se compararon mediante el procedimiento LSmeans del SAS. La frecuencia de desove se analizó mediante la prueba Chi-cuadrado del SAS. Valores de probabilidad de 0.05 o menos se consideraron significantes, mientras que los comprendidos entre 0.051 y 0.10 como tendencia.
RESULTADOS Y DISCUSIÓN
Ni el peso (CH: 6.9 ± 0.3 mg; TR: 6.5 ± mg) ni el volumen (CH: 7.4 ± 0.3 mm3; TR: 7.3 ± 0.4 mm3) de cada huevo difirió entre variedades. El Cuadro 1 muestra las características de los huevos de las dos variedades de tilapia. El peso y volumen de los huevos desovados fue significativamente mayor en la variedad Chitralada en comparación con la variedad Taiwanesa roja; sin embargo, el número de huevos por unidad de volumen fue similar entre las dos variedades. Las hembras CH desovaron un volumen de huevos 1.7 veces mayor (p<0.01) con un peso 1.8 veces mayor (p<0.01) que las hembras TR. Además, la fecundidad absoluta y relativa, así como la producción de huevos por cada 100 hembras fue significativamente mayor en las tilapias CH que en las TR (p<0.01).
Cuadro 1 Características de los huevos y fecundidad de dos variedades de tilapias criadas en tanques de concreto
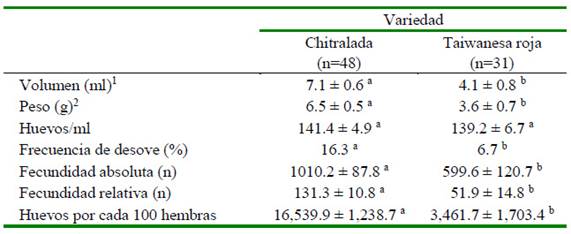
1Volumen y 2peso de huevos por desove
a,b Letras diferentes dentro de filas indica diferencia significativa (p<0.01)
Según el tamaño de las tilapias (Cuadro 2), el volumen y el peso de los huevos desovados fue ligeramente mayor, pero no Figura 2. Frecuencia de desoves en tilapias grandes y pequeñas de acuerdo a la variedad (a,b p>0.05; c,d p<0.01; a,c p<0.0001; b,d p<0.05). significativo, en hembras grandes que en las pequeñas. El desove fue más frecuente en las tilapias pequeñas que en las grandes (p<0.05), lo cual determinó que las tilapias pequeñas produjeran 1255 más huevos por cada 100 hembras que las tilapias grandes (p>0.05). El peso (grandes: 6.7 ± 0.4 mg; pequeñas: 6.3 ± 0.3 mg) y el volumen (grandes: 7.6 ± 0.3 mm3; pequeñas: 7.1 ± 0.3 mm3) de cada huevo no difirió entre el tamaño de las hembras. Además, el número de huevos por unidad de volumen fue estadísticamente similar entre ambos grupos de tilapias.
Cuadro 2 Características de los huevos y fecundidad de tilapias según su tamaño, criadas en tanques de concreto

1Volumen y 2peso de huevos por desove
Letras diferentes dentro de filas indica diferencia significativa (a,b p<0.05)
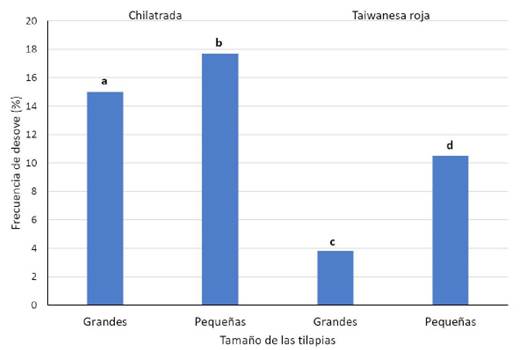
Figura 2 Frecuencia de desoves en tilapias grandes y pequeñas de acuerdo a la variedad (a,b p>0.05; c,d p<0.01; a,c p<0.0001; b,d p<0.05).
Con excepción de la fecundidad relativa que fue mayor en los reproductores que estaban en proporciones de sexo (macho: hembra) 1:1 (p<0.05) y 1:2 (p<0.10) que 1:3, las variables reproductivas restantes no variaron por el efecto de la proporción de sexos (Cuadro 3).
Cuadro 3 Características de los huevos y fecundidad de tilapias, según la relación hembra macho, criadas en tanques de concreto
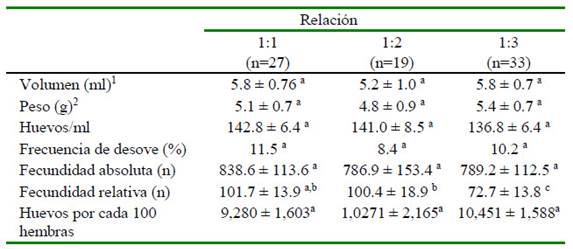
1Volumen y 2peso de huevos por desove
Letras diferentes dentro de filas indica diferencia significativa (a,c p<0.05) (b,c p<0.10)
El Cuadro 4 muestra el efecto de la interacción entre la variedad y el tamaño de las tilapias sobre las características reproductivas. Se encontraron mayores volúmenes (p<0.05) y pesos (p<0.10) del huevo en las hembras grandes que en las pequeñas en la tilapia CH; sin embargo, no hubo diferencias significativas en fecundidad absoluta y relativa ni en la producción de huevos cada por 100 hembras entre tamaños de los peces. En el caso de la variedad TR, excepto el N° de huevos/100 hembras, ninguna variable reproductiva difirió entre tamaños de tilapia. Cuando se compararon hembras del mismo tamaño entre ambas variedades, todas las variables en estudio fueron superiores (p<0.01) en las tilapias CH grandes que en las TR grandes. Asimismo, el peso de los huevos, la producción de huevos por cada 100 hembras y la fertilidad relativa fueron superiores para ambos tamaños entre las dos variedades de tilapia (p<0.01).
Cuadro 4 Efecto de la interacción entre la variedad y el tamaño de tilapias criadas en tanques de concreto sobre las características de los huevos, la fecundidad y la producción de huevos

1Volumen y 2peso de huevos por desove
Letras diferentes en la misma columna para cada variedad difieren: a,b p<0.01; b,c p<0.10
Números diferentes en la misma columna entre variedades difieren: 1,2 p<0.01; 2,3 p<0.05
Las hembras CH grandes y pequeñas tuvieron una frecuencia de desove similar, mientras que las tilapias pequeñas de la variedad TR desovaron 2.7 veces más frecuentemente que las grandes (p<0.01). Además, tanto las tilapias grandes (p<0.001) como las pequeñas (p<0.05) de la variedad CH desovaron con mayor frecuencia que el tamaño correspondiente de las hembras TR(p<0.05) (Figura2).
El Cuadro 5 muestra el efecto de la interacción entre la variedad y la relación hembra macho durante el periodo de estudio. En general, en la variedad CH la relación H:M 3:1 tuvo mejor desempeño reproductivo que los grupos 1:1 y 2:1. Por el contrario, en la variedad TR, la proporción 1:1 tuvo considerablemente mejor comportamiento reproductivo que las proporciones 2:1 y 3:1. Al compararse la misma proporción de sexos entre ambas variedades, se constató que independientemente del nivel de significancia, las hembras CH fueron reproductivamente superiores a las tilapias TR en las tres proporciones de sexos.
Cuadro 5 Efecto de la interacción entre la variedad y la relación hembra macho de tilapias criadas en tanques de concreto sobre las características de los huevos, la fecundidad y la producción de huevos
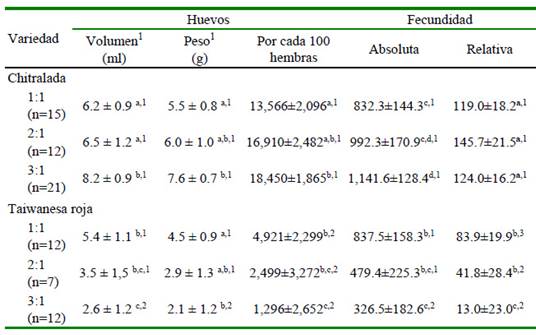
1Volumen y 2peso de huevos por desove
Letras minúsculas distintas en la misma columna para cada variedad difieren: a,b p<0.10; b,c p<0.01; c,d p<0.05
Números diferentes en la misma columna entre cada relación H:M difieren: 1,2 p<0.01; 1,3 p<0.10
La variación de la fecundidad y el desempeño reproductivo entre variedades de Oreochromis ha sido reiteradamente documentada (Nandlal et al., 2001; Logato et al., 2004; Mair et al., 2004; Moura et al., 2011; Almeida et al., 2013). En este estudio, la tilapia CH mostró características reproductivas considerablemente superiores a las de TR. Estudios recientes en Venezuela han indicado que el porcentaje de hembras grávidas (Perea-Ganchou et al., 2017) y la frecuencia de desoves (Perdomo-Carrillo et al., 2016) fueron significativamente superiores en la variedad CH.
La tasa reproductiva de la variedad TR pudo estar influenciada por la interacción social, que influye en la frecuencia de desoves, tal como se ha indicado en las variedades híbridas (Bhujel, 2000). Por ejemplo, Eguia (1996) encontró que la producción de huevos y de larvas fue considerablemente baja en cuatro variedades rojas, cuyos rendimientos estuvieron influenciados por la variedad, el sistema de reproducción (hapa y tanques) y la interacción entre ambos factores. A pesar de que TR fue reproductivamente menos eficiente, los valores de fecundidad y fecundidad relativa pueden ser considerados satisfactorios para las condiciones venezolanas (Perdomo-Carrillo et al., 2017; Perea-Ganchou et al., 2017).
Mair et al. (2004) reportaron que la frecuencia de desoves y la producción de huevos son variables que dependen de la fecundidad individual de las hembras en relación con el número de hembras sobrevivientes durante el periodo de evaluación. En este estudio, ambos planteles de reproductores lograron sobrevivir en su totalidad.
La cantidad de huevos colectados, aparte de la variedad de tilapia, pudo estar influenciada por el desove manual que se practicó semanalmente, puesto que en condiciones naturales estas hembras pueden estar entre una y dos semanas realizando la incubación bucal de huevos y el cuidado parental de las larvas (Little 1989; Zimmermann, 2005), lo que puede conducir a una baja producción de huevos y larvas. Por otro lado, los desoves manuales regulares pudieron estimular el desarrollo gonadal anticipado y continuo, favoreciendo una mayor producción, sobrevivencia y crecimiento de semillas (Bhujel, 2000; Coward y Bromage, 2000; Tsadik y Bart, 2007; Perdomo-Carrillo et al., 2017). En este sentido, Watanabe et al. (1992) obtuvieron 3.3 semillas/m2/día de la tilapia roja Florida (O. urolepis hornorum x O. mossambicus) en incubación natural mientras que colectaron 91.7 semillas/m2/día mediante la extracción manual.
En tal sentido, Perdomo-Carrillo et al. (2017) demostraron el efecto positivo de la extracción manual de los huevos, al permitir una producción constante de alevines sin tener que incrementar el número de reproductores. Asimismo, el uso de tanques facilitó la evaluación de los reproductores y favoreció la colecta de huevos y larvas, tal como ha sido demostrado por Eguia (1996) y Perdomo-Carrillo et al. (2017).
En este estudio las condiciones del agua en los estanques estuvieron dentro de rangos aceptados como normales. No obstante, Perea-Ganchou et al. (2017), indicaron que las tilapias CH tuvieron mejor desempeño reproductivo que la variedad roja, aun teniendo una concentración de oxígeno disuelto (OD) inferior (3.7 ± 0.05 mg/l) a las de los estanques ocupados por las hembras de la variedad roja (5.5 ± 0.03 mg/l); sin embargo, los resultados sobre los efectos de la baja concentración de OD sobre la actividad reproductiva, gametogénesis y desove han sido inciertos en algunos casos (Bhujel, 2000).
Santos et al. (2007) trabajando con tilapias CH de edad similar reportaron una mayor fecundidad en hembras grandes que en las pequeñas. Asimismo, Mohammed et al. (2013) reportaron un mejor desempeño reproductivo en hembras de mayor peso, mientras que Little (1989) observó que las hembras de mayor tamaño producen más huevos por desove, mientras que las pequeñas producen más huevos por kilogramo. En este estudio, las hembras CH grandes produjeron mayor volumen y masa de huevos, pero tuvieron desoves menos frecuentes y produjeron menor cantidad de huevos por cada 100 hembras que los ejemplares más pequeños, en tanto que las variables reproductivas en TR, con excepción de la producción de huevos por cada 100 hembras, no se afectaron por el tamaño del pez, lo cual denota diferencias importantes en el desempeño reproductivo por efecto del genotipo (Eguia, 1996; Tsadik y Bart, 2007; Marengoni yWild, 2014).
Por otra parte, y en contraposición a los hallazgos de esta investigación, otros autores han indicado que las hembras pequeñas tuvieron incrementos en la frecuencia de desoves, que fueron más sincronizados (Bhujel, 2000; de Graaf et al., 1999; Tharwat, 2007; Moura et al., 2011), lo que representa ventajas en el manejo de las variedades comerciales, puesto que se podría tener mayor número de hembras pequeñas en el mismo recinto piscícola, sin afectar los desoves ni la producción de huevos y larvas (Tahoun et al., 2008).
Existe la opinión de que en los centros de producción de tilapias se debe contar con hembras con pesos entre 150 y 250 g (Bhujel, 2000), para maximizar la producción de semilla y permitir una mejor utilización de los espacios acuáticos (Little, 1989; Tahoun et al., 2008) al permitir que los machos puedan fecundar a numerosas hembras en cortos periodos de tiempo (Zimmermann, 2005). En este estudio solo las hembras pequeñas, de ambas variedades, se ajustaron al rango de pesos recomendado; no obstante, las variables productivas fueron mejores en las hembras grandes de la variedad CH, y similar en los dos tamaños de la variedad TR. Por otra parte, el tamaño de las hembras puede influir en desoves desincronizados (Tahoun et al., 2008), causando variaciones en el tamaño de las larvas y canibalismo.
Los resultados encontrados por efecto de la proporción de sexos indican que pudiera ser potencialmente favorable utilizar la relación 1:1, al haberse obtenido una mayor producción de huevos y en algunos casos una mayor fecundidad que en las otras proporciones. Sin embargo, esto implica un mayor número de machos. Con respecto a este aspecto, la literatura muestra gran variabilidad del efecto de las proporciones sexuales sobre el desempeño reproductivo de las hembras de tilapia. Por ejemplo, Akar (2012) encontró que las proporciones 2,5:1 y 3:1 en tilapias O. niloticus produjeron mayor número de huevos totales y por hembra, y una fecundidad relativa mayor que proporciones menores, mientras que Khalfalla et al. (2008) observaron que la relación 2:1 incrementó la producción total de huevos por hembra con relación a las proporciones 1:1 y 3:1.
El desempeño reproductivo de las tilapias por efecto de la proporción hembra macho en diferentes variedades ha mostrado resultados divergentes. Así, por ejemplo, Logato et al. (2004) reportaron que la relación 1:1 fue más eficiente en la producción de huevos, mientras que en tilapias hibridas (O. niloticus x O. aureus), Siddiqui y Al-Harbi (1997) señalaron que las relaciones 2:1 y 3:1 fueron mejores en la producción de semillas/hembra/día y semillas/kg de hembra/ día que las proporciones 4:1 y 5:1. Dada la gran variabilidad de este aspecto del manejo de las tilapias reportada en la literatura, y corroborada en este estudio, es fundamental encontrar la mejor proporción de sexos para cada variedad bajo las condiciones ambientales y sistema de producción en las que desarrolle la explotación piscícola, de manera que las hembras que estén fisiológicamente aptas puedan desovar fácil y frecuentemente en presencia del macho, sin que ocurran restricciones ni efectos de dominancia social.
CONCLUSIONES
Las tilapias hembra Chitralada (Oreochromis niloticus) produjeron mayor volumen y cantidad de huevos, desovaron 2.4 veces más y fueron considerablemente más fecundas que las tilapias Taiwanesa roja (O. mossambicus x O. niloticus).
Las tilapias pequeñas tuvieron desoves 1.6 veces más frecuente y produjeron una cantidad mayor de huevos por cada 100 hembras que los ejemplares más grandes.
Las proporciones de hembra macho empleadas en el estudio no afectaron el comportamiento reproductivo de las poblaciones de tilapias.
Las tilapias de la variedad Chitralada que estaban en una proporción hembra macho de 3:1 produjeron más huevos y fueron más fecundas que las demás proporciones, mientras que la relación 1:1 en la variedad Taiwanesa roja tuvo mejor desempeño reproductivo.
En ambas variedades, las tilapias pequeñas experimentaron más desoves que las grandes, siendo la magnitud de esta diferencia considerablemente mayor en las TR que en las CH. Asimismo, las tilapias grandes de la variedad CH desovaron 3.9 veces más que las TR del mismo tamaño; esta diferencia fue solo 1.7 veces mayor en las CH pequeñas que en las TR de la misma talla.












 uBio
uBio 

