INTRODUCCIÓN
El «Perro sin Pelo del Perú» fue reconocido por la Federación Cinológica Internacional (FCI) como una nueva raza el 12 de junio de 1985 (Maniero, 2015) y posteriormente fue considerado como patrimonio nacional por ser una raza oriunda del Perú, existiendo representaciones de estos perros en cerámicas, pinturas rupestres y cuadros en diferentes culturas preincas, así como atribuyéndosele ciertas propiedades curativas (Osorio y Gálvez, 2015).
Información reproductiva de esta raza es escasa, habiendo un reporte de hace una década (Flores et al., 2010), donde colectaron semen a un individuo, no pudiendo tomarse estos datos como representativos para la raza. Algunas veces, la evaluación de fertilidad de los machos reproductores se realiza a través del registro de parámetros seminales macroscópicos y microscópicos (Tello et al., 1988), como el color, volumen, motilidad y concentración espermática. Sin embargo se utilizan valores de referencia generales para caninos, no teniendo en cuenta la gran variabilidad que puede existir entre razas. En ese sentido, por ejemplo, el color puede ir desde blanco nacarado a blanquecino, dependiendo de la concentración espermática y el volumen entre 1 y 15 ml (Angulo, 2011), dependiendo de la edad, nivel de excitación, peso y tamaño, así como de la raza del animal (Stornelli y De la Sota, 2016; Tessi et al., 2018). Así por ejemplo, el volumen de semen esperado en la raza Yorkshire Terrier es de 0.5 ml (Romagnoli et al., 2012) que puede variar de 4 (England, 1999) a 23 ml (Tello et al., 1988).
En el aspecto microscópico, la motilidad espermática aparentemente también estaría influenciada por la raza, aunque estaría influenciada por el tamaño de la raza (Tessi et al., 2018). La motilidad varía desde 64% en el Pastor Alemán (England, 1999) hasta valores mayores a 90% en perros cruzados (Carlotto et al., 2011) y Pastor Belga Mallinois, aunque en este último la edad también sería un factor de importancia (Reatiga, 2015). Por otro lado, la concentración tendría una mayor relación con la raza, donde en el Pastor Alemán se describe una concentración de 87 x 106 espermatozoides/ml (Tello et al., 1988), mientras que en perros cruzados se describen concentraciones entre 20 y 300 x 106 espermatozoides/ml. No obstante, un estudio comparando semen de diferentes razas (pequeñas, medianas y grandes) no encontró diferencias en la concentración espermática entre estos grupos (Tessi et al., 2018). En el caso de la morfología espermática, las anormalidades de los espermatozoides se deben principalmente a alteraciones en los testículos y epidídimos o en el manejo del semen (Angulo, 2011).
En el caso de la evaluación de la funcionalidad espermática, se debe considerar la viabilidad, potencial de membrana mitocondrial e integridad acrosomal. De este modo, en el Chihuahua se reporta 62.7% de viabilidad (Salinas et al, 2014), mientras que en Pastor Alemán, Golden Retriever y Labrador presentan un 84.5% de espermatozoides con alto potencial de membrana mitocondrial (Treulen, 2012). En el caso de espermatozoides con el acrosoma intacto se reporta hasta 97.5% en el Pastor Alemán y Labrador (Treulen, 2012).
Las evidencias de la variación de características seminales en otras razas caninas permiten suponer que el semen del Perro sin Pelo del Perú podría presentar características particulares aún no descritas. Por lo tanto, el objetivo del presente estudio fue caracterizar los aspectos básicos y funcionales del semen de la raza del Perro sin Pelo del Perú.
MATERIALES Y MÉTODOS
Animales y Muestras Seminales
Se utilizaron 15 perros machos de la raza Sin Pelo del Perú registrados en el Kennel Club Peruano, con edades entre 1 y 5 años, y clínicamente normales. La colección de semen se realizó mediante la técnica de manipulación digital (Kutzler, 2005). Para lograr la erección y el eyaculado, se retrajo el prepucio y se estimularon los bulbos del glande del pene aplicando presión intermitente con la mano del recolector. La primera fracción espermática fue desechada, colectando la totalidad del volumen de la segunda y tercera fracción.
Los eyaculados (n=15) fueron recolectados en un vaso precipitado de vidrio de 50 ml, trasladados a tubos tipo Falcon de plástico de 15 ml y transportados a temperatura ambiente (20 °C aproximadamente) hasta el Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, para su inmediato análisis. El tiempo de traslado de cada muestra dependió de la ubicación del hogar de cada uno de los perros, no siendo en ningún caso mayor a 90 minutos.
Espermatograma Básico
Evaluación macroscópica
Se registró el volumen y el color de cada muestra. El volumen fue registrado utilizando una probeta graduada de 25 ml. El color fue considerado como transparente, blanco nacarado o blanquecino.
Evaluación microscópica
Se registró la motilidad y la concentración espermática. Para la evaluación de la motilidad, se colocó 20 µl de cada muestra de semen sobre una lámina porta objeto temperada a 37 °C. Se cubrió con una lámina cubreobjeto y se observó en un microscopio con el objetivo 40X. Se determinó el porcentaje de espermatozoides mótiles con respecto al total de espermatozoides observados.
Para la concentración espermática se diluyó 10 µl de semen con agua destilada (1:20). Las muestras diluidas se colocaron en una cámara de Neubauer para el conteo del número de espermatozoides observados en cinco cuadrantes (extremos y medio) del área de conteo, utilizando un microscopio con el objetivo de 40X. La sumatoria del número de espermatozoides de los cinco cuadrantes indicó el número de espermatozoides x 106/ml.
Evaluación Funcional
Viabilidad espermática
Para la evaluación de la viabilidad se utilizó LIVE/DEAD® Sperm Viability Kit (L- 7011, Molecular Probes, USA) que contiene: SYBR-14 y ioduro de propidio (PI). Se tomaron 100 µl de cada muestra para ser incubados con 0.5 µl de SYBR-14 (20 µM) y 0.5 µl de PI (2.4 nM), para obtener concentraciones finales de 100 nM y 12 µM, respectivamente. Las muestras fueron incubadas en oscuridad durante 10 minutos a 38 °C. Se consideraron espermatozoides vivos a aquellos que presentaron fluorescencia verde (SYBR-14) en la cabeza espermática y muertos a aquellos que presentaron fluorescencia roja (PI) en dicha región.
Potencial de membrana mitocondrial
Para evaluar el potencial de membrana mitocondrial (PMM) se utilizó MitoTracker Deep Red FM (M22425, Molecular Probes, USA). Se tomó 100 µl de cada muestra y se agregó 0.5 µl de MitoTracker Deep Red FM (20 µM), para obtener una concentración final de 100 nM. Las muestras fueron incubadas es oscuridad durante 10 minutos a 38 °C en oscuridad. Se consideraron espermatozoides con alto PMM los que presentaron fluorescencia roja/naranja en la pieza media, mientras que se consideraron con bajo PMM los que no presentaron dicha fluorescencia.
Integridad acrosomal
Para evaluar la integridad acrosomal se usó isoticionato de fluoresceína conjugado Pisum Sativum (FITC-PSA, L0770, SigmaAldrich, USA) como marcador de daño acrosomal junto con iouduro de propidio (PI) como marcador de muerte celular. Se tomaron 100 µl de cada muestra para ser incubados con 2.5 µl de solución de FITC-PSA (100 µg/ml), para llegar a una concentración final de 2.5 µg/ml de FITC-PSA. A cada muestra también se le añadió 0.5 µl de PI (2.4 nM), llegando a una concentración final de 12 µM. Las muestras fueron incubadas en oscuridad por 10 minutos a 38 °C. Se consideraron espermatozoides vivos con el acrosoma intacto a aquellos que no presentaron fluorescencia verde en la región acrosomal ni fluorescencia roja en la cabeza espermática (FITC-PSA-negativo; PI negativo). Así mismo, fueron considerados como vivos con daño acrosomal (FITC-PSA-positivo; PI negativo), muertos con acrosoma intacto (FITC-PSAnegativo; PI positivo) y muertos con daño acrosomal (FITC-PSA-positivo; PI positivo). Los resultados fueron expresados como porcentaje de espermatozoides con acrosoma intacto y como porcentaje de espermatozoides vivos con acrosoma intacto.
Citometría de Flujo
Los parámetros funcionales fueron evaluados utilizando un citómetro de flujo con sistema de análisis de imágenes (FlowSight, Amnis, USA). Para cada muestra y parámetro se realizó la adquisición de 10 000 eventos compatibles con espermatozoides en función de su tamaño (área) y proporción ancho/largo (aspect ratio). Para la excitación de los fluorocromos SYBR-14, PI y FITC-PSA se utilizó un láser de 488 nm de longitud de onda, mientras que MitoTracker Deep Red FM fue excitado con un láser de 642 nm de longitud de onda de 642 nm. La emisión de la fluorescencia para el SYBR14 y FITC-PSA, fue leída utilizando el canal de detección Ch02 (505-560 nm), para PI se utilizó Ch05 (642-740 nm) y para MitoTracker Deep FM Red se utilizó Ch11 (642-740 nm). Cada población, tanto para la viabilidad espermática, alto PMM, integridad acrosomal y espermatozoides vivos con integridad acrosomal fue definida evaluando gráficos tipo Dot Plot o histogramas, verificando cada caso con el sistema analizador de imágenes.
RESULTADOS
Los resultados del espermatograma básico se presentan en el Cuadro 1 . El color fue blanquecino en todas las muestras y el volumen seminal fue alrededor de 6 ml. Si bien un macho eyaculó más de 21 ml, esto valor no fue representativo para la población, pues el percentil 75 muestra volúmenes menores a 9 ml. Por otro lado, la concentración espermática varió entre 235 (PI25) y 300 millones de espermatozoides/ml (PI 75), mientras que la motilidad fue de 67% en promedio.
Cuadro 1. Valores del espermatograma básico y parámetros funcionales del semen del Perro sin Pelo del Perú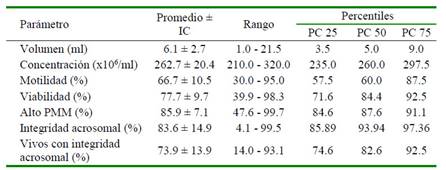
En el caso de los parámetros funcionales, las medias de viabilidad, alto PMM, integridad acrosomal y espermatozoides vivos con integridad acrosomal variaron entre 73 y 86%, aunque con rangos amplios. Al observar los percentiles, se puede notar que al menos el 50% de muestras tuvieron valores entre 70 y 90% (Cuadro 1).
La Figura 1 muestra la viabilidad espermática, donde se puede observar dos poblaciones bien definidas: los espermatozoides vivos situados en el cuadrante superior izquierdo (SYBR14 positivos, PI negativos) y los espermatozoides muertos situados en el cuadrante inferior derecho (SYBR14 negativos y PI positivos). La clasificación de estos eventos fue corroborada analizando las imágenes, tal como se observa en las Figura 1A (espermatozoide vivo) y 1B (espermatozoide muerto).
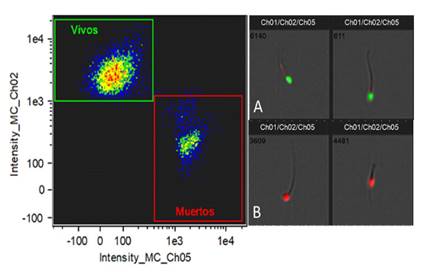
Figura 1 Gráfica de puntos (Dot plot) y fotografías representativas de la evaluación de la viabilidad espermática del semen del perro sin pelo del Perú utilizando SYBR-14/PI. A la izquierda se observa la distribución de eventos, en donde el eje X se presenta la intensidad de fluorescencia para Ioduro de propidio (Ch05) y en el eje Y la intensidad de fluorescencia para SYBR14 (Ch02). Al lado derecho, se observa: (A) 2 espermatozoides con fluorescencia verde en la cabeza (SYBR14 positivos) y (B) 2 espermatozoides con fluorescencia roja en la cabeza (PI positivos)
La Figura 2 muestra un histograma representativo del PMM, observándose dos poblaciones bien definidas. En el lado izquierdo la población con menor frecuencia y fluorescencia a MitoTracker, los cuales representan a los espermatozoides con bajo PMM, mientras que en el lado derecho se presenta la población más numerosa, con mayor intensidad de fluorescencia a MitoTracker; es decir, espermatozoides con alto PMM. Esta clasificación fue corroborada revisando la galería de fotografías de ambas poblaciones (Figuras 2A y 2B).
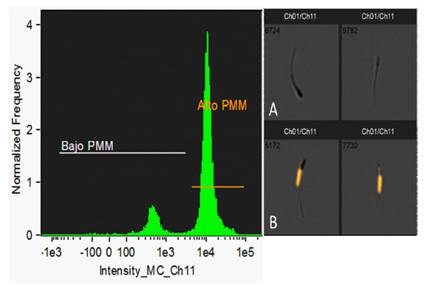
Figura 2 . Histograma y fotografías representativas de la evaluación del potencial de membrana mitocondrial (PMM) espermática del semen del Perro sin pelo del Perú utilizando MitoTracker Deep Red FM. A la izquierda se observa la distribución de eventos, en donde el eje X se presenta la intensidad de fluorescencia para MitoTracker (Ch1) y en el eje Y la frecuencia normalizada de eventos. Al lado derecho, se observa: (A) dos espermatozoides sin mostrar fluorescencia en la región de la pieza media (MitoTracker negativos) y (B) dos espermatozoides con fluorescencia en la pieza media (MitoTracker positivos)
La evaluación de la integridad acrosomal y de los espermatozoides vivos con integridad acrosomal puede observarse en la Figura 3 (gráfico Dot Plot), donde si bien es posible encontrar cuatro poblaciones, la mayor cantidad de eventos se observan en la parte inferior del gráfico; es decir sin daño acrosomal por ser FITC-PSA. No obstante, estos espermatozoides con el acrosoma intacto estuvieron divididos entre espermatozoides vivos (PI negativos) y espermatozoides muertos (PI positivos). En el lado derecho de la Figura 3 se puede observar los posibles patrones de espermatozoides encontrados al incubarlos con FITC-PSA y PI: espermatozoides muertos con reacción acrosomal (3A), espermatozoides vivos con reacción acrosomal (3B), espermatozoides muertos con acrosoma intacto (3C) y espermatozoides vivos con acrosoma intacto (3D).
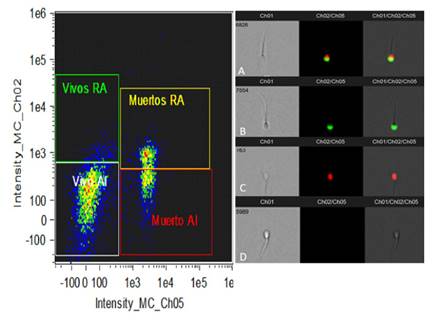
Figura 3. Gráfica de puntos (Dot plot) y fotografías representativas de la evaluación de la viabilidad e integridad acrosomal del semen del Perro sin Pelo del Perú utilizando FITC-PSA/PI. A la izquierda se observa la distribución de eventos, en donde el eje X se presenta la intensidad de fluorescencia para Ioduro de propidio (Ch05) y en el eje Y la intensidad de fluorescencia para FITC-PSA (Ch02). Al lado derecho, se observa: (A) espermatozoide muerto con reacción acrosomal (FITC-PSA positivo, PI positivo), (B) espermatozoide vivo con reacción acrosomal (FITC-PSA positivo, PI negativo); (C) espermatozoide muerto con acrosoma intacto (FITCPSA negativo, PI positivo) y (D) espermatozoide vivo con acrosoma intacto (FITC-PSA negativo, PI negativo)
DISCUSIÓN
Las características del semen canino son muy variables y han sido descritas en diferentes razas por diversos autores (Kojima et al., 2001; Lange-Consiglio et al., 2010; Peres et al., 2014; Salinas et al., 2014; Tessi et al., 2018). Existe un reporte previo donde se presentan características básicas de tres eyaculados de un Perro sin Pelo del Perú, que no puede considerarse como representativo para la raza (Flores et al., 2010). En este trabajo se utilizan eyaculados de 15 machos registrados que permiten caracterizar los parámetros seminales del Perro sin Pelo del Perú.
En caninos está descrito que el volumen seminal es altamente variable, dependiendo de factores como la edad, raza y excitación del macho (Tessi et al., 2018). En este estudio, si bien los rangos encontrados fueron amplios (1-21 ml), 14 de los 15 eyaculados presentaron volúmenes menores a 9 ml, y por lo menos el 50% fue menor a 5 ml. En razas más grandes como el Pastor Alemán se reportan volúmenes promedio de 23 ml, con variaciones entre 9 y 36 ml (Tello et al., 1988), mientras que en razas pequeñas se tienen volúmenes de eyaculado menores (Tessi et al., 2018). Estas diferencias dependen mayormente de la próstata, la única glándula accesoria en el perro, entendiendo que perros de razas grandes tendrán mayor tamaño prostático (3.44 ± 0.72 cm), en comparación con perro de razas medianas (2.90 ± 0.98 cm) y perros de razas pequeñas (2.14 ± 0.43 cm) (Miguel de Priego, 2007).
El color del semen del Perro sin Pelo del Perú fue blanquecino en todos los eyaculados, lo cual indicaría la presencia de espermatozoides en la muestra (Root Kustritz, 2007). A pesar de la variabilidad en el volumen seminal, no se detectaron diferencias en los matices del color de los eyaculados, posiblemente debido a que la variación de la concentración espermática entre eyaculados fue mínima (210-320 millones de espermatozoides/ml).
El número total de espermatozoides por eyaculado (producto del volumen por concentración espermática) debe ser superior a los 300 millones de espermatozoides, según Root Kustritz (2007). En ese sentido, se obtuvo alrededor de 1000 millones de espermatozoides por eyaculado en 14 de los 15 eyaculados del presente estudio. Solo en un caso se obtuvo 280 millones de espermatozoides y fue el eyaculado cuyo volumen fue de 1 ml, pudiendo ser el caso de falta de estimulación adecuada, que no permitió un eyaculado completo.
La motilidad promedio fue de 67%, variando en la mayoría de los casos entre 50 y 90%. Estos valores son similares a los descritos en algunas razas como Pastor Alemán (Tello et al, 1988; England, 1999), Cirneco Italiano y Sabueso Italiano (Lange-Consiglio et al., 2010), en donde la motilidad fue reportada entre 65 y 70%. No obstante, la motilidad observada en el Perro sin Pelo del Perú fue ligeramente inferior al 70% propuesto por Root Kustritz (1990) como valor mínimo de motilidad para semen canino en general, lo cual es respaldado por los reportes de otras razas como Beagles (Kojima et al., 2001), Bulldog Inglés (Sánchez y Bravo, 2013) y Golden Retriever (Peres et al., 2014), en donde los promedios de motilidad varían entre 85 a 90%. En ese sentido, es probable que el tiempo transcurrido entre la colección de semen y la evaluación de la motilidad haya podido afectar este parámetro.
La viabilidad espermática fue alrededor del 78%, siendo valores similares al 82% reportado por Cheuqueman et al. (2012) en perros de razas Pastor Alemán, Labradores y Golden Retriever, y ligeramente superiores a los reportados en Chihuahuas (63%) por Salinas et al. (2014). En los tres estudios se utilizó SYBR14/PI y citometría de flujo.
Con respecto al potencial de membrana mitocondrial de los espermatozoides del Perro sin Pelo del Perú, se obtuvieron valores alrededor del 85% descrito por Manosalva et al. (2005) en Chihuahuas, quienes utilizaron MitoTracker como marcador del PMM. Del mismo modo, los resultados fueron similares al 80-84% reportado en perros de razas Pastor Alemán, Golden Retriever y Labrador utilizando JC-1 como marcador de PMM (Cheuqueman et al., 2012; Treulén et al., 2012). Este parámetro es un indicador del estado de funcionalidad de las mitocondrias. Existe una relación entre la motilidad y el estado mitocondrial, ya que las mitocondrias son las productoras de ATP, producidas por la fosforilación oxidativa, lo cual es importante para que pueda ocurrir una correcta actividad celular como la motilidad (Salinas et al, 2013).
La integridad acrosomal encontrada para la raza en evaluación llegó al 84%, mientras que considerando espermatozoides vivos y con integridad acrosomal al mismo tiempo se obtuvieron valores cercanos al 74%. Estos valores son similares al reportado en Chihuahuas por Manosalva et al. (2005). Sin embargo, este parámetro podría estar afectado por la raza, debido a que por un lado, Treulén et al. (2012) reportan 97.5% de integridad acrosomal en las razas Pastor Alemán y Labrador, mientras que Peres et al (2014) reportan 67% de integridad acrosomal en Golden Retriever. La integridad acrosomal es importante, ya que solo los espermatozoides que tengan el acrosoma intacto tienen la capacidad de atravesar la zona pelúcida y fecundar al ovocito (Cabrera y Pantoja, 2012).












 uBio
uBio 

