INTRODUCCIÓN
Cavia porcellus fue domesticado por las antiguas poblaciones indígenas sudamericanas a partir de cuyes silvestres (Cavia tschudii) y se diseminó en épocas precolombinas a partir de cepas rurales existentes en los países andinos (Spotorno et al., 2014). El cuy es una fuente importante de proteína de origen animal (Xicohtencatl et al., 2013) que contribuye a la seguridad alimentaria de la población rural de escasos recursos en el país (Chauca, 1997). En el Perú, los principales productores de carne de cuy se encuentran en los departamentos de Ancash, Apurímac, Ayacucho, Cajamarca, Cusco, Huánuco, Junín, La Libertad y Lima (MINAGRI, 2015).
El cuy es una especie susceptible para contraer múltiples enfermedades bacterianas, micóticas y parasitarias que inciden negativamente en la producción (Morales, 2017). Dentro de estas, la leptospirosis es una enfermedad compleja, cuyo agente etiológico es una espiroqueta muy sensible a la desecación, calor y frio excesivo; su temperatura óptima de crecimiento es entre 28 y 30 °C y pH óptimo de 7.2-7.8. No se multiplica fuera del organismo del huésped, pero puede sobrevivir en el medio exterior durante días o meses, según sean las condiciones ambientales (Laguna, 2000; WHO, 2003).
La leptospirosis es una enfermedad zoonótica, de importancia y distribución mundial, presente en países desarrollados y en desarrollo (CDC, 2018). Es considerada de riesgo ocupacional, ya que muchos casos ocurren en personas que trabajan con animales o en contacto directo con el medio ambiente contaminado (OMS/OPS, 2008; Nurul et al., 2019).
Leptospira agrupa a un sin número de serovares patógenos. La existencia de las serovariedades recae en el ámbito epidemiológico, debido a su estrecha relación comensal con determinada especie animal (WHO, 2003; MINSA, 2011). Así, el cerdo está relacionado con el serovar Bratislava, el cual afecta los índices reproductivos y causa muerte neonatal; sin embargo, el roedor es su huésped de mantenimiento, sin generar enfermedad (Smith et al., 1992). El perro es reservorio del serovar Canicola, quién queda como portador excretando la bacteria por la orina por un largo periodo de tiempo (Siuce et al., 2015), habiendo sido aislada, además, en cerdos, caballos y humanos (Paz-Soldan et al., 1991; Sotomayor et al., 2012). Los serovares Pomona y Hardjo están asociados a bovinos, caprinos, ovinos, canes, cerdos, equinos, roedores y humanos (Anampa et al., 2012), mientras que serovar Icterohaemorrhagiae es el más conocido por la asociación que se presenta con los roedores, quienes son huéspedes naturales y actúan como portadores asintomáticos (Carrada-Bravo, 2005).
En el departamento de Cajamarca, Perú, se han reportado casos de leptospirosis durante los últimos años y es uno de los departamentos con mayor producción de cuyes en el país (MINAGRI, 2015). El tipo de crianza involucra factores de riesgo que pueden generar mayor exposición y susceptibilidad a enfermedades infecciosas para la especie, pudiendo comportarse como reservorio de Leptospira spp. Por otro lado, Vexelman y Morales (2017) reportaron mortalidad en cuyes gestantes y una alta incidencia de abortos con disminución en la producción. Siendo la producción de cuyes una de las actividades económicas agropecuarias más importante en esta región, y la enfermedad de interés para la salud pública, el objetivo del estudio fue estudiar los serovares que afectan a cuyes bajo crianza familiar-comercial de la provincia de Cajabamba, Cajamarca.
MATERIALES Y MÉTODOS
Lugar del Estudio
La toma de muestras se llevó a cabo en cuatro granjas de la provincia de Cajabamba, departamento de Cajamarca, Perú, en mayo de 2018. La zona posee suelos con buena capacidad de retención de humedad, adecuado drenaje y es moderadamente alcalino. Las granjas están ubicadas entre los 2300 y 3400 msnm, con una temperatura ambiental de 1724 °C. Las granjas tienen un sistema de producción familiar-comercial. Los animales son criados en pozas de aproximadamente 1 m2 a nivel del suelo y se les separa según su etapa productivas en maternidad, recría y engorde. Los animales reciben alimento balanceado y alfalfa, cuentan con algunas medidas de bioseguridad, control sanitario y registros. Las granjas fueron elegidas por presentar el mayor flujo de venta durante la época festiva, y presentaban características de manejo y sanitarias similares.
Población y Muestra
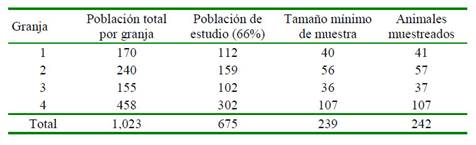
Para el cálculo del tamaño mínimo de muestra se tomó en cuenta la fórmula para estimar proporción en una población no finita (Daniel, 1991), con base a los cuyes de crianza familiar-comercial de la provincia de Cajabamba. Se consideró una probabilidad de ocurrencia del atributo de interés de 0.19 (Sacsaquispe et al., 2003), obteniéndose un tamaño mínimo de muestra de 239 individuos.
Los animales fueron seleccionados sin distinción de sexo, se encontraban aparentemente sanos, y estaban destinados a beneficio. Según la población del cada plantel, el 66% corresponden a saca (Aguilar et al., 2011), la cual corresponde a la población en estudio, manera que se tomó una proporción de esta población, según el tamaño mínimo de muestra (Cuadro 1).
Por su finalidad, el estudio es descriptivo, y por su temporalidad es un estudio prospectivo transversal, ya que sus variables se dan en una población determinada y en el momento de beneficio de cada animal.
Se tomaron muestras de sangre (5 ml) de cada individuo al momento del sacrificio, directamente de la vena yugular para serología. Las muestras fueron refrigeradas y trasladadas al Laboratorio de Microbiología de la Universidad Científica del Sur, en un tiempo menor a 12 horas, donde fueron centrifugadas a 600 g durante 5 minutos para la obtención del suero, el cual fue almacenado en crioviales de 2 ml a -20 °C hasta su procesamiento mediante la prueba de microaglutinación (MAT).
Procesamiento de las Muestras
Las serovariedades seleccionadas para el estudio fueron L. Canicola, L. Hardjo, L. Icterohaemorrhagiae, L. Pomona y L. Bratislava (INS, 2002; CDC, 2018). Se cultivaron en el medio Elinghousen-McCulloughJohnson-Harris para Leptospira a 29 ± 1 °C. Se colocó parte de cada cultivo en tubos de ensayo hasta obtener densidades aproximadas a 2x108 leptospiras/ml. Este paso fue denominado preparación del antígeno.
Para la detección de anticuerpos, se utilizaron placas de microtitulación donde se prepararon las diluciones con solución salina fisiológica (0.85%), para evaluar títulos de 1/100, 1/200, 1/400, 1/800 y 1/1600 frente a los antígenos de las leptospiras vivas de los cinco serovares. Las placas fueron incubadas a 28°C durante 2 horas. Las placas se examinaron mediante microscopía de campo oscuro. El título de punto final se define como la dilución de suero que muestra un 50% de aglutinación. Se tomó en cuenta animales seropositivos a aquellos que presentaron títulos >1:100 (INS, 2002).
Análisis Estadístico
Los resultados se presentan en cuadros de contingencia, mostrando los porcentajes de positividad. Se establece asociación estadística entre las variables cualitativas como positividad a la prueba diagnóstica frente a sexo y procedencia de la muestra con la prueba de Chi cuadrado a un valor de p<0.05.
RESULTADOS
Se obtuvo un total de 40.5% (98/242) de cuyes seropositivos para Leptospira spp, con títulos entre 1:100 y 1:200. La granja con mayor cantidad de animales seropositivos fue la Granja 3 con un 51.4% (19/37) (Cuadro 2). No se determinó asociación estadística significativa entre la positividad a Leptospira spp y las granjas.
Cuadro 2 Frecuencia de cuyes positivos a anticuerpos contra Leptospira spp según la granja de procedencia en sistemas de crianza familiar-comercial en la provincia de Cajabamba, Perú (2018)
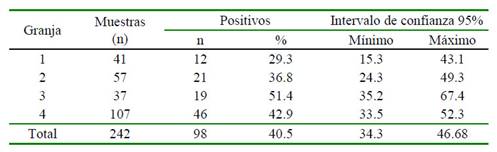
p=0.208
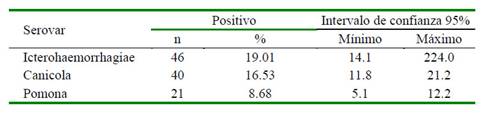
La mayor frecuencia de serovares correspondió al serovar Icterohaemorrhagiae (19.01%, 46/242), seguido de Canicola (16.53%) y Pomona (8.68%). No se encontró seropositividad para los serovares Hardjo y Bratislava (Cuadro 3). Por otro lado, nueve individuos presentaron seropositividad para los serovares Icterohaemorrhagiae y Canicola.
Cuadro 3 Frecuencia de cuyes positivos a anticuerpos contra Leptospira spp con respecto a los serovares evaluados en cuyes de sistemas de crianza familiar-comercial en la provincia de Cajabamba, Perú (2018) (n= 242)
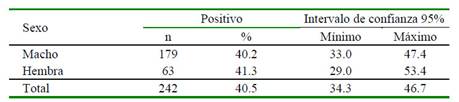
Las hembras presentaron 41.26% de seropositividad (26/63), resultando mayor en comparación al 40.22% (72/179) de los machos; sin embargo, no existe asociación estadística significativa (p>0.05) en cuanto a las variables seropositividad a Leptospira spp y sexo. Los resultados se presentan en el Cuadro 4.
DISCUSIÓN
El presente estudio demuestra que existe 40.5% de seropositividad (IC95% :34.3 46.7%) a Letospira spp en la población de cuyes evaluada (Cuadro 2), lo cual indica que estos animales fueron expuestos a la bacteria y son potenciales reservorios de la enfermedad; sin embargo, no se pudo determinar si manifestaron signología clínica o alguna infección activa; por otro lado, la seropositividad pudo estar ligada a factores ambientales (Levett, 2001).
En el país se han reportado prevalencias desde 2.9% hasta 100% en diferentes especies de mamíferos y microclimas (Bunell et al., 2000; Sacsaquispe et al., 2003; Cachata, 2006; Cueva et al., 2010; Montes et al., 2011; Sotomayor et al., 2012; Siuce et al., 2015; Llanco et al., 2017; Vexelman y Morales, 2017; Luna, 2019). Según la literatura, la supervivencia de las leptospiras depende en gran medida de la variación de las condiciones ambientales, suelo y agua, además de requerir un elevado porcentaje de humedad en el ambiente (Romero et al., 2016), condiciones que se dan en las granjas muestreadas. De otra parte, las cuatro granjas permitían la entrada de canes y se reportaba la presencia de roedores como principal plaga, lo que permite la exposición de los cuyes a un contagio directo e indirecto a través de la orina de estos.
Las prevalencias de leptospira en cuyes de crianza comercial en Lima y Junín de 30.6 y 38.4%, respectivamente (Vexelman y Morales, 2017; Luna, 2019) fueron similares a la prevalencia encontrada en el presente estudio, toda vez que las condiciones climáticas en estos lugares fueron favorables para el mantenimiento de la bacteria en el medio ambiente.
El serovar Icterohaemorrhagiae se encuentra notificado en el Perú desde muchos años atrás en humanos, perros y animales silvestres (Levett, 2001), y es el serovar que se encuentra en mayor frecuencia en diversos estudios realizados en el país, con frecuencias entre 28.3% hasta 85.4% (Céspedes et al., 2006; Montes et al., 2011; Sotomayor et al., 2012; Vexelman y Morales, 2017; Luna, 2019). Este serovar es ampliamente conocido por la asociación que presenta con los roedores, huéspedes naturales, quienes actúan como portadores asintomáticos (Laguna, 2000; WHO, 2003). A pesar de que la presentación clínica es variada, este serovar está asociado al síndrome ictérico o enfermedad de Weil (Carrada-Bravo, 2005; MINSA, 2011); por lo que su hallazgo en cuyes realza el riesgo para las personas que trabajen directamente con ellos (Agudelo-Flórez et al., 2010).
En el presente estudio se detectó la presencia del serovar Canicola en el 16.53% de los cuyes. Este serovar ha sido encontrado en roedores, con prevalencias entre 5.2 y 15% (Agudelo-Flórez et al., 2010; Montes et al., 2011; Vexelman y Morales, 2017; Luna, 2019); prevalencias relativamente menores a comparación de otros serovares. A pesar de que el huésped natural es el perro, se le puede encontrar infectando a otras especies por el contacto con la orina de perros infectados en etapa clínica o subclínica (Huerta et al., 2013; Levett, 2001). En el presente estudio, la seropositividad a este serovar puede estar ligada al contacto de los cuyes con canes.
En este estudio se encontró una frecuencia de 8.68% del serovar Pomona, habiendo reportes de este serovar en cuyes entre 7.1 y 10.1% (Blood et al., 1968; Liceras, 1975; Vexelman y Morales, 2017; Luna, 2019). Sin embargo, se reportan prevalencias que van entre 51 y 63% (Liceras, 1975; Anampa et al., 2012; Sotomayor et al., 2012) en bovinos, cerdos y yeguas. De otra parte, no se encontró seropositividad con respecto a los serovares Hardjo y Bratislava (0%), en comparación con el reporte de Vexelman y Morales (2017), quienes encontraron calores de 1.3% para estos serovares en cuyes de crianza intensiva en Lima.
Las granjas 3 y 4 son las que presentaron mayor número de animales seropositivos. Estas granjas se encontraban a 60 m de distancia entre ellas y ambas tenían el área de almacén de concentrado cerca de las pozas, donde había entrada de canes; además había vacunos cerca de las instalaciones. Las otras dos granjas estaban a más de 1 km de distancias de las granjas 3 y 4, presentaban mayor cuidado en su bioseguridad; sin embargo, se observaba la entrada de canes y si bien, no había explotaciones de ganado cerca, era común el traslado de bovinos y ovinos a poca distancia. No se encontró asociación estadística significativa frente a las variables seropositividad y granja; por lo cual, los niveles de bioseguridad y condiciones de crianza, a pesar de sus diferencias, no influyeron en la existencia de animales seropositivos.
CONCLUSIONES
Se encontró seropositividad de Leptospira con los serovares Icterohaemorrhagiae (19.01%), Canicola (16.53%) y Pomona (8.68%) en cuyes de crianza familiar-comercial en la provincia de Cajabamba, Perú.
No hubo seropositivad con los serovares Hardjo y Bratislava en las granjas de cuyes evaluadas.
No se encontró asociación estadística significativa entre los animales seropositivos frente a las variables sexo y la granja de muestreo.












 uBio
uBio