INTRODUCCIÓN
Merced al rápido crecimiento y calidad de la carcasa del pollo de engorde, atribuido parcialmente al mejoramiento genético enfocado en la eficiencia de crecimiento y conversión alimenticia, la carne de esta ave es, para la alimentación humana, la principal fuente de proteínas de origen animal (Thornton, 2010; Hocking, 2014; OCDE-FAO, 2017; Saxena y Kolluri, 2018). Esta carne contribuye significativamente con la provisión de lípidos, vitaminas y minerales (Marangoni et al., 2015); sin embargo, el mejoramiento genético de estos caracteres se asocia con acumulación de grasa abdominal (Fouad y ElSenousey, 2014; Hocking, 2014), ocasionando desperdicio de energía dietaria e influyendo negativamente en el rendimiento de la canal, el manejo de residuos y la aceptación del consumidor (Shahin y Abdel-Azeem, 2006; Fouad y El-Senousey, 2014).
La excesiva deposición de grasa abdominal determina que el pollo de engorde sea considerado «obeso» en relación con las líneas silvestres y aves destinadas a la producción de huevos. La grasa abdominal del pollo correlaciona positivamente con la concentración sérica de glucosa, triacilglicerol, colesterol total y lipoproteínas de baja densidad (c-LDL) y negativamente con la concentración de lipoproteínas de alta densidad (c-HDL) (Navidshad et al., 2010). Adicionalmente, el pollo presenta dislipidemias (Hermier, 1997), hiperglucemia, resistencia a la insulina (Wang et al., 2017) y predisposición a esteatosis hepática (Hermier, 1997); por tanto, es un modelo adecuado para el estudio del metabolismo lipídico (Huang et al., 2013; Ji et al., 2014), de las Enfermedades Crónicas No Transmisibles (ECNT) (Ayala et al., 2005; Wang et al., 2017) y de la esteatosis hepática, que es una manifestación hepática del Síndrome Metabólico, definido como la asociación de al menos tres alteraciones: resistencia a la insulina, hipertensión arterial, obesidad central y dislipidemias (Buqué et al., 2008; Lizarzaburu, 2013).
Frente a estas enfermedades, se ha propuesto el uso de fitoquímicos, entre ellos los flavonoides como una alternativa terapéutica (Balaji et al., 2015), puesto que en diversos biomodelos se ha evidenciado que su ingesta mejora el perfil lipídico, reduce la hiperglicemia, la insulinoresistencia y lesiones ateroscleróticas, y reduce la proporción de tejido adiposo (Hwang et al., 2011; Reis et al., 2016; Bhaswant et al., 2017), probablemente incrementando la tasa de β-oxidación (Guo et al., 2012) e inhibiendo la lipogénesis (Kim et al., 2012; Nakajima et al., 2015). Aunque se atribuye a las antocianinas una acción preventiva y terapéutica frente a las ECNT y EH (Pojer et al., 2013; Valenti et al., 2013), no existe información respecto a la suplementación con un extracto de maíz morado (EMM), como fuente de flavonoides, principalmente antocianinas (Pedreschi y Cisneros-Zevallos, 2007). Con base a estos antecedentes, el objetivo del presente estudio fue determinar el efecto de la suplementación dietaria de pollos de engorde con dosis crecientes de un extracto de maíz morado (Zea mays L) sobre el desempeño productivo y metabolismo lipídico.
MATERIALES Y MÉTODOS
Lugar de Estudio
La crianza de las aves y el posterior sacrificio se realizó en las instalaciones avícolas de los Laboratorios Agropecuarios de la Universidad Técnica de Manabí, en Manabí, Ecuador. Los análisis bioquímicos y toma de muestras para las determinaciones histopatológicas se desarrollaron en las respectivas áreas de dicho laboratorio.
Aves, Diseño Experimental y Dietas
Se utilizaron 200 pollos de la línea Cobb 500, sin sexar, de un día de edad y con un peso promedio de 44.2 ± 2.15 g. Las aves fueron alojadas en un galpón convencional durante los primeros 28 días, siendo alimentadas con dietas que cubrieron sus requerimientos nutricionales. Posteriormente fueron distribuidas aleatoriamente en cuatro tratamientos, designados en función de la dosis de un extracto de maíz morado (EMM) en polvo (4.41% de antocianinas, según el certificado de análisis reportado por el proveedor) adicionada a una dieta convencional en forma de harina, adquirida en el comercio local (Cuadro 1): 0% (control, T1), 0.05% (T2), 0.15% (T3) y 0.75% (T4), equivalente a 0, 22, 66 y 330.8 mg de antocianinas/kg de alimento. De esta forma se cubrió el rango de dosis de flavonoides generalmente utilizadas en avicultura (entre 0.05 y 0.2%) (Kamboh et al., 2019). Los tratamientos constaron de cinco repeticiones y 10 aves por repetición. Las aves recibieron similares condiciones de manejo: 23 horas de luz y una hora de oscuridad, alimento y agua a voluntad y densidad de 10 aves/m2. La temperatura varió entre 17.3 y 36.3 °C durante el periodo experimental.
Cuadro 1 Composición y contenido nutricional de la dieta control, fase experimental
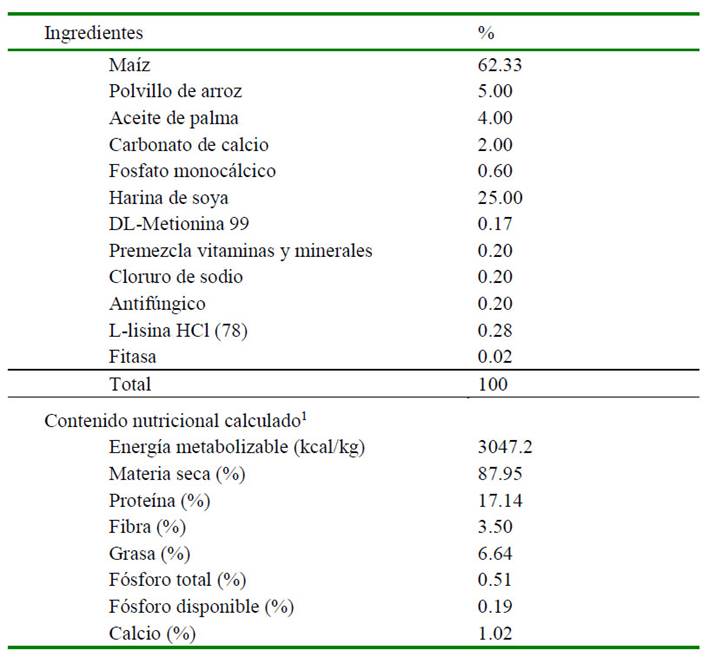
A partir de la dieta control (T1), en los tratamientos experimentales se adicionó un extracto de maíz morado en las siguientes proporciones: 0.05% (T2); 0.15% (T3) y 0.75% (T4)
1 Estimación de la composición nutricional utilizando las Tablas de la Fundación Española para el Desarrollo de la Nutrición Animal (FEDNA), 2019
El EMM, adquirido a Sensient Technologies, Lima. Perú (Lote N.° 018133) se almacenó en ambiente seco y a una temperatura inferior a 30 °C, a fin de prevenir el deterioro de las antocianinas. Las dosis del EMM se adicionaron diariamente a la dieta utilizada (Takikawa et al., 2010; Reyna et al., 2018). Para ello, se realizó una premezcla entre la dosis del EMM correspondiente a cada tratamiento y una fracción del alimento base (aproximadamente 500 g) para agregarse paulatinamente al resto del alimento, hasta lograr una homogenización completa.
Toma de Muestras
El consumo de alimento se registró diariamente, en tanto que la conversión alimenticia (CA) y mortalidad se estimaron semanalmente para el total de las aves (n=200).
La CA se determinó en función del consumo de alimento y la ganancia de peso del total de las aves según tratamiento, mientras que el índice de mortalidad se obtuvo del registro del número de aves muertas por tratamiento.
A los 56 días de edad, y posterior a un ayuno nocturno de 12 horas, dos aves macho por repetición (10 aves por tratamiento) fueron sacrificadas mediante exanguinación, evitando el maltrato y sufrimiento innecesario. De cada ave sacrificada se recolectó 5 ml de sangre en tubos sin anticoagulante. Las muestras fueron centrifugadas con una fuerza máxima de 1700 x g durante 15 min. En el plasma obtenido se determinó el perfil lipídico (triacilglicerol [TAG], colesterol total [CT], colesterol de lipoproteínas de baja densidad [c-LDL], colesterol de lipoproteínas de alta densidad [c-HDL]) y glucosa, siguiendo las indicaciones del proveedor de los kits comerciales (BioTécnica). El riesgo cardiovascular se determinó mediante los cocientes CT/cHDL y c-LDL/cHDL (Millán et al., 2009).
Se registró el peso de las aves antes del sacrificio (peso vivo) y el peso de la canal tras el descarte de vísceras, cabeza y plumaje, utilizando una balanza digital (5 kg ± 1.0 g). Para el peso de la grasa visceral, registrada acorde con las indicaciones de Crespo y Esteve-García (2001) y del hígado, se empleó una balanza digital (1000 ± 0.1 g). Además, se determinó el peso relativo de estos tejidos en relación con el peso vivo de las aves.
Adicionalmente, se tomaron ocho muestras de tejido hepático por tratamiento, que fueron fijadas en una solución de formol neutro tamponado al 10% y procesadas por la técnica clásica de inclusión y cortes en bloques de parafina, previa deshidratación en alcoholes en grados ascendentes. Los cortes fueron coloreados con la tinción de hematoxilina y eosina, acorde a los protocolos correspondientes (Aguilar et al., 2011). Para el análisis de las muestras se utilizó un microscopio óptico Optika B 383 Pli a 400x, que contó con una cámara digital AmScope MU 100 acoplada y el software AmScope 3.0.
Análisis Estadístico
Los datos se representaron como promedios ± desviación estándar (DE). La distribución normal y homogeneidad de varianza se determinó mediante las pruebas de Ryan-Joiner (similar a Shapiro-Wilk) y Levene, respectivamente. Los datos del indicador de riesgo cardiovascular colesterol total/c-HDL no presentaron una distribución normal, por lo que se analizaron mediante la prueba no paramétrica de Kruskal-Wallis. Para el análisis de los resultados restantes, excepto la comparación de la proporción de mortalidad y esteatosis hepática entre el tratamiento control y tratamientos suplementados con EMM, evaluado mediante la prueba exacta de Fisher, se empleó el análisis de varianza de una vía (Diseño Completamente al Azar, DCA). Las diferencias entre medias se calcularon utilizando la prueba de comparación múltiple de Dunett. En todos los casos el nivel de diferencias estadísticas se preestableció en un valor p<0.05. El análisis estadístico se efectuó utilizando los paquetes estadísticos Minitab v. 18 (State College, PA; USA) y GrahPad Prism 6 (La Jolla, USA).
RESULTADOS
Desempeño Productivo
El peso final de las aves fue mayor en T4 y T3 que en T1 (p=0.042), en tanto que el consumo de alimento, conversión alimenti-
cia y mortalidad fue similar entre tratamientos (Cuadro 2). Así mismo, al evaluar la respuesta productiva en 10 pollos macho por tratamiento se observó que el peso inicial de las aves (día 28) fue similar entre tratamientos, pero el peso alcanzado al día 56 fue mayor en T3 y T4 que en T1 y T2 (p=0.045). En contraste, no se evidenciaron diferencias entre el peso en canal, rendimiento en canal y los pesos relativos del hígado y grasa abdominal de los tratamientos en estudio (Cuadro 3).
Cuadro 2 Parámetros productivos de pollos de carne suplementados con extracto de maíz morado (EMM, %)
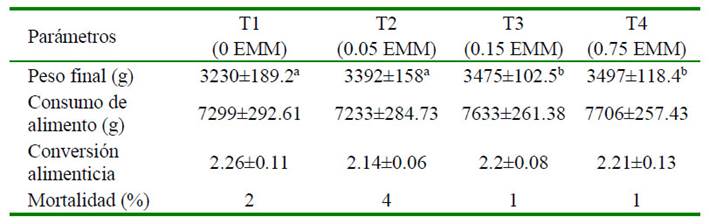
(n=50 aves por tratamiento)
a,b Superíndices diferentes dentro de filas indican diferencia significativa (p<0.05)
Cuadro 3 Parámetros productivos, peso del hígado y grasa visceral con relación al peso final en pollos de carne suplementados con extracto de maíz morado (EMM)
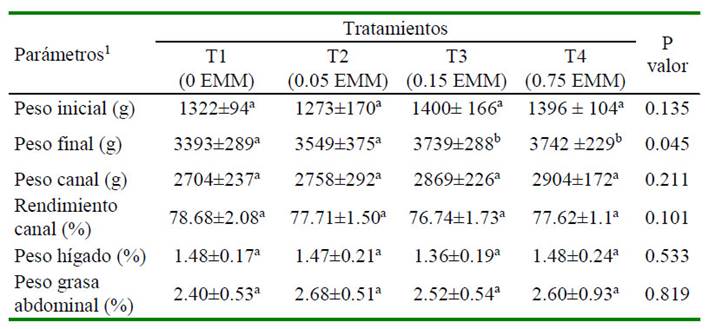
Los valores representan el promedio ± DE de 10 pollos macho por tratamiento Superíndices con letras diferentes indican diferencia significativa (p< 0.05)
1 Peso de hígado y grasa abdominal en relación al peso vivo del día 56
Esteatosis Hepática
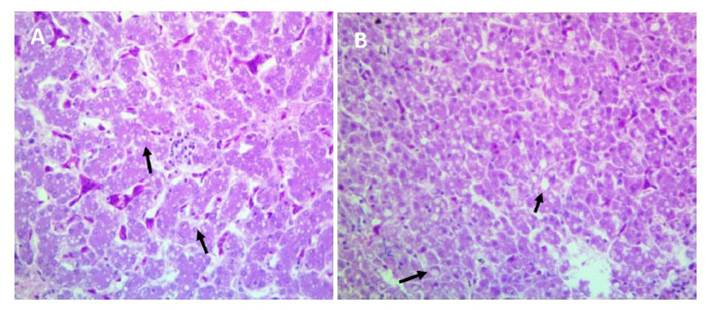
El cuadro histopatológico se caracterizó por la presencia de microvacuolas ópticamente vacías en el citoplasma de los hepatocitos. En los casos más severos se observaron macrovacuolas que rechazaban el núcleo hacia la periferia, con ligeros signos de daño hepatocelular, lo que se corresponde con la actual denominación de esteatosis simple (Figura 1). La suplementación con el EMM redujo la proporción de esteatosis hepática (EH) en las aves (p<0.007). En T1, el 87.5% de las aves presentó EH, mientras que en las muestras provenientes de tratamientos suplementados con EMM, la proporción de EH fue 45.83%, siendo de 62.5, 50 y 25% en T2, T3 y T4, respectivamente.
Parámetros Bioquímicos
El efecto del EMM sobre el perfil lipídico de las aves se aprecia en la Figura 2. La concentración sérica de triglicéridos, colesterol total, c-LDL y c-HDL fue similar entre tratamientos (p>0.05). Sin embargo, el nivel de cLDL en T2, T3 y T4 fue menor en 14.14, 5.71 y 11.05% con relación a T1, mientras que la concentración de c-HDL de T2, T3 y T4 se incrementó en 10.7, 18.5 y 5.9%, respectivamente, en comparación con T1, determinando que el riesgo cardiovascular, expresado por los índices CT/c-HDL sea menor en los tratamientos T2, T3 y T4 con relación a T1 (p=0.0019). Asimismo el índice cLDL/c-HDL fue menor en los tratamientos suplementados con EMM (p=0.0025). Por otra parte, la suplementación dietaria con EMM no modificó la concentración sérica de glucosa (Figura 3).
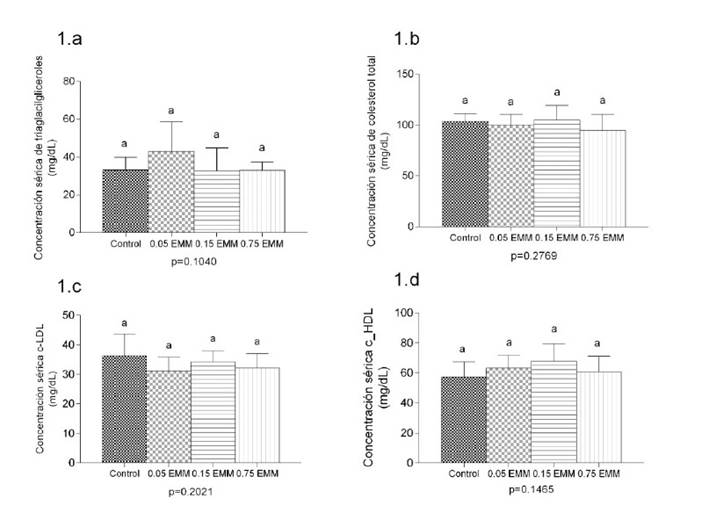
Figura 2 Perfil lipídico sérico de pollos de carne suplementados con extracto de maíz morado (EMM). Concentración sérica de triglicéridos (1.a), colesterol total (1.b), c-LDL (1.c) y c-HDL (1.d) Los valores representan el promedio ± DE de 10 pollos macho por tratamiento. Los resultados de los grupos suplementados con EMM fueron estadísticamente similares a los del grupo.
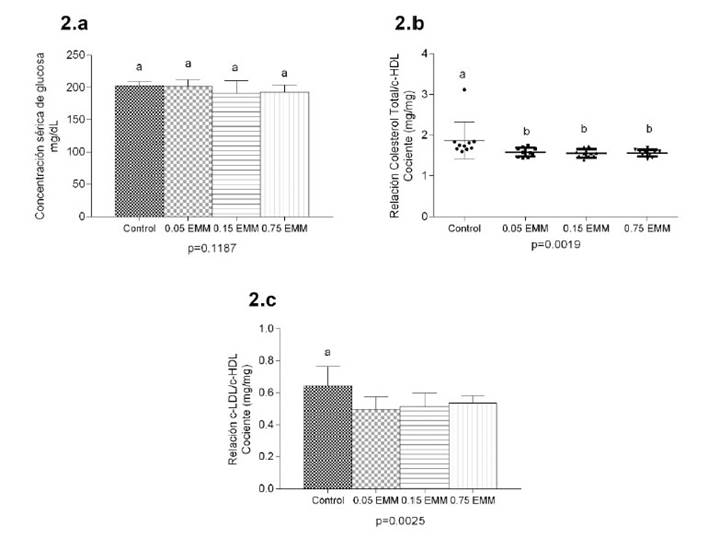
Figura 3 Concentración de glucosa e índices de riesgo cardiovascular en pollos de carne suplementados con extracto de maíz morado (EMM). Concentración sérica de glucosa (2a) e índices de riesgo cardiovascular: relación CT/c-HDL (2b) y relación LDL/HDL (2c). Los valores representan el promedio ± DE de pollos macho por tratamiento. Los grupos no etiquetados con «a» son significativamente diferentes de la media del nivel de control (p<0.05)
DISCUSIÓN
Se ha informado de los efectos benéficos que los flavonoides, entre ellos las antocianinas, ejercen sobre la producción avícola (Kamboh et al., 2019). Así, la suplementación con 0.15 y 0.75% de un EMM, como fuente de antocianinas, mejoró el peso de las aves a los 56 días de edad, con relación al grupo control no tratado. En este contexto, se ha atribuido a los flavonoides la mejora del peso final y rendimiento de la canal en pollos de engorde al incluir 10 y 20 g de semilla de uva/kg de alimento (Abu Hafsa e Ibrahim, 2018). En contraste, no se reportaron modificaciones en el peso final y las características de la carcasa de estas aves al suplementarlas con otras fuentes de flavonoides, como el extracto de arándano adicionado a razón de 40, 80 y 160 mg/kg de alimento (Leusink et al., 2010), 1% de polvo de té verde (Chen et al., 2019) y 36.66 mg/kg de antocianinas de trigo morado/kg (Stastnik et al., 2016). El rendimiento de la canal en el presente experimento no se modificó por efecto de la suplementación con un EMM.
Los flavonoides ejercen efectos multidimensionales sobre la salud (Kamboh et al., 2015), lo que reduciría la susceptibilidad de las aves frente a factores causantes de estrés oxidativo y con ello a procesos inflamatorios, muerte celular, daño tisular e incremento de la peroxidación lipídica, todo lo cual deteriora la respuesta inmune y el comportamiento productivo (Nijveldt et al., 2001; Akbarian et al., 2016; Farahat et al., 2016). Adicionalmente, se ha informado del efecto protector de las antocianinas frente a los efectos deletéreos del estrés calórico en aves (Changxing et al., 2018), ya que la zona termoneutral de pollos de engorde se reduce al aumentar su edad (Aluwong et al., 2017). Así, la suplementación con el EMM probablemente explique, bajo las condiciones de la presente investigación, su efecto sobre el peso de aves al día 56, pero no en individuos más jóvenes.
La suplementación con EMM no redujo el peso relativo de la grasa abdominal, tal y como fue reportado por Reyna et al. (2018) en ratas lactantes. Sin embargo se ha reportado la reducción de grasa abdominal en pollos de engorde tras la suplementación con compuestos ricos en flavonoides, como semillas de uva (Abu Hafsa e Ibrahim, 2018), la adición de 1% de polvo de té verde (Chen et al., 2019) y la sustitución parcial de maíz amarillo por maíz morado (Amnueysit et al., 2010). Al respecto se ha señalado que flavonoides como las catequinas reducen la deposición de grasa abdominal en pollos de engorde, al suprimir la lipogénesis y estimular la lipólisis y oxidación de ácidos grasos (Huang et al., 2015).
Múltiples factores bióticos y abióticos determinan que el perfil de flavonoides de diversos alimentos, como el maíz morado y las semillas de uva sean diferentes (Pedreschi y Cisneros-Cevallos, 2007; Cetinkaya et al., 2017; Chen et al., 2018) determinando diferentes respuestas biológicas en las aves (Kamboh et al., 2019). Otros factores, como el elevado contenido de fibra en las semillas de uva (Hajati et al., 2015) probablemente expliquen las diferencias en las características de la canal de los pollos de engorde observadas en este estudio.
La ausencia de modificaciones en el perfil lipídico de pollos de engorde tras suplementar con un EMM concuerda con Farahat et al. (2016), quienes no encontraron diferencias en la concentración sérica de colesterol total, c-HDL, c-LDL y c-VLDL al suplementar un extracto de té verde, rico en polifenoles. Así mismo Toufektsian et al. (2011) indican que la ingesta de antocianinas provenientes de un maíz con elevado tenor de antocianinas no modificó la concentración de triglicéridos, colesterol total y c-HDL en ratas. En contraste, Liu et al. (2016) señaló que la suplementación con antocianinas redujo los niveles séricos de CT, TAG y c-LDL e incrementó la concentración de c-HDL en individuos dislipidémicos, mientras que la suplementación con flavonoides (genisteína y hesperidina) ocasionó una reducción dosis dependiente de colesterol total, triglicéridos y c-LDL en pollos de engorde (Kamboh y Zhu, 2013).
Es posible que las antocianinas incidan sobre el perfil lipídico por diversos mecanismos; así, la reducción de triglicéridos en individuos diabéticos tras la suplementación con estos flavonoides se ha asociado con la disminución de apo B y apo C-III (Li et al., 2015), mientras que en pacientes dislipidémicos incrementa la concentración plasmática de c-HDL y reduce los niveles de c-LDL mediante la inhibición de la proteína transportadora de ésteres de colesterol (CETP) (Qin et al., 2009). Adicionalmente, la suplementación con antocianinas redujo la concentración de colesterol total en hámsters al incrementar la excreción fecal de ácidos biliares, reducir la absorción de esteroles y disminuir la expresión génica de HMG-CoA reductasa, enzima limitante en la síntesis de colesterol (Liang et al., 2013). Es posible, entonces, que el perfil lipídico de las aves pueda ser influido por la composición de los flavonoides suplementados y la dosis utilizada.
Aunque la suplementación dietaria con un EMM no modificó el perfil lipídico de los pollos de engorde, mejoró la relación CT/cHDL y c-LDLc/c-HDL. Altos niveles de cLDL están asociados con elevado riesgo de enfermedades cerebrovasculares, mientras elevadas concentraciones de c-HDL ejercen un efecto protector frente a estas dolencias (Reis et al, 2016), puesto que la infiltración de c-LDL en el endotelio tiende a oxidarse y formar c-LDL oxidado (oxLDL), conduciendo a la formación de células espumosas y placas de ateroma (Gormaz et al., 2016; Reis et al., 2016), en tanto que el efecto protector de HDL frente a la aterosclerosis radicaría en el transporte reverso del colesterol, removiendo el exceso de colesterol de los macrófagos en la pared arterial, hacia el hígado, previniendo la formación de las células espumosas y el desarrollo de aterosclerosis (Barter, 2011). En este contexto se ha determinado que los cocientes CT/c-HDL y cLDL/c-HDL son mejores predictores de enfermedad cardiovascular que el uso aislado de parámetros como c-LDL, c-HDL y CT (Millán et al, 2009).
El pollo parrillero es particularmente susceptible a EH, puesto que presenta elevada lipogénesis de novo en el hígado, que también está expuesto a los ácidos grasos dietarios debido al rudimentario sistema linfático de estas aves, por lo que, los portomicrones desembocan en la circulación portal (Hermier, 1997). También elevadas temperaturas, como las registradas en la presente investigación (superiores a 30 °C durante lapsos superiores a 6 h diarias) podrían ocasionar estrés oxidativo, lo que reduciría la tasa de β-oxidación y estimularía la lipogénesis (Akbarian et al, 2016; Jastrebski et al, 2017).
La proporción de esteatosis hepática se redujo significativamente en pollos de engorde suplementados con un EMM. Al respecto se ha sugerido que las antocianinas ejercen un efecto protector frente a la esteatosis hepática (Valenti et al., 2013), al reducir la lipogénesis e incrementar la β-oxidación, y disminuir el estrés oxidativo y procesos inflamatorios (Aguirre et al., 2014). Similar a otros compuestos fenólicos, se ha propuesto que cianidina 3 glucósido, la antocianina más abundante en el maíz morado (Pedreschi y Cisneros Zevallos, 2007) promueve la actividad de AMPK, incrementando la tasa de βoxidación y reduciendo la lipólisis en células HepG2 (Guo et al., 2012). Así mismo, se ha reportado que la suplementación con un extracto de maíz morado reduce la expresión génica de SREPB-1c en el hepatocito de ratas (Reyna et al., 2018). Adicionalmente, las antocianinas incrementan la actividad de las enzimas superóxido dismutasa (SOD) y glutatión peroxidasa (GPx), reduciendo el estrés oxidativo (Ucar et al., 2013; Wu et al., 2016) y procesos inflamatorios y, con ello, lesiones posteriores a la infiltración grasa del hígado (Loza-Medrano et al., 2018).












 uBio
uBio