INTRODUCCIÓN
El camarón Cryphiops caementarius es una especie endémica de los ríos de la vertiente occidental de los Andes de Perú y Chile (Moscoso, 2012); sin embargo, las mayores densidades poblacionales se encuentran en los ríos de Arequipa, Perú (Ocoña, Majes-Camaná y Tambo), que en el 2017 se extrajo 996 t (Wasiw y Yépez, 2015; PRODUCE, 2018) para abastecer al mercado de Lima, principalmente. Esta especie de camarón tiene potencialidades para cultivo, por lo que se han llevado a cabo diversos estudios sobre su reproducción (Bazán et al., 2009; Medina et al., 2019), cultivo (Reyes, 2016) y nutrición (Terrones y Reyes, 2018; Cabrera et al., 2019), entre otros.
La flor de caléndula Calendula officinalis tiene pétalos amarillos y naranjas intensos, debido a los carotenoides (Pintea et al., 2003; Kishimoto y Ohmiya, 2009). En acuicultura, la caléndula se emplea para mejorar la coloración en peces como Xiphophorus helleri (Ezhil et al., 2008) y Trichogaster trichopterus (Jorjani et al., 2018). El uso de 100 mg/kg de caléndula en la dieta de Penaeus semisulcatus incrementa la pigmentación del cuerpo (Göçer et al., 2006), en tanto que la dieta de P. monodon debe contener más de 125 mg/kg de pigmentos naturales para lograr la presencia de astaxantina en los tejidos (Boonyaratpalin et al., 2001) y de 250 mg/kg en Litopenaeus vannamei para lograr mayor pigmentación del músculo (Arredondo-Figueroa et al., 2003).
La coloración del cuerpo de los crustáceos es principalmente dependiente de la presencia de los pigmentos en los cromatóforos epidérmicos y en el exoesqueleto (Tume et al., 2009), aunque también dichos pigmentos se encuentran en los ojos, sangre, huevos, hepatopáncreas y ovarios (Meyers, 2000). La astaxantina es el principal carotenoide encontrado en la mayoría de los tejidos de crustáceos y el responsable del color típico (Jittivadhnaa et al., 2010), además de βcaroteno, equinenona y cantaxantina, que pueden ser de procedencia dietética o derivados por transformación metabólica de algún carotenoide de la dieta (Breithaupt, 2007).
En crustáceos, los carotenoides desencadenan diversos procesos fisiológicos y muy diferentes patrones de comportamiento intraespecífica de comunicación, camuflaje y protección (Tlusty, 2005). Los ejemplares machos de C. caementarius, de mayor tamaño que las hembras (Reyes et al., 2018), pierden la coloración del cuerpo cuando son cultivados en cautiverio debido a deficiencia de carotenoides en la dieta (Reyes, 2019), sin embargo, los carotenoides del cuerpo no han sido cuantificados. Por consiguiente, el objetivo fue evaluar la pigmentación del cuerpo de C. caementarius con dietas suplementadas con caléndula.
MATERIALES Y MÉTODOS
Camarones
Los camarones se colectaron del río Pativilca (10°39’ S, 77°40’ W), cerca del centro poblado Huayto (Lima, Perú). El transporte de camarones fue realizado en un sistema de vasos de plástico (200 ml) acondicionados dentro de recipientes (45 l) y a 70 camarones por recipiente (Reyes, 2016). El transporte terrestre duró 5 h y no hubo mortalidad de camarones. En laboratorio, la especie C. caementarius se reconoció mediante clave taxonómica (Méndez, 1981) y el sexo se verificó por la separación de las coxas del quinto par de periópodos y por el tamaño y grosor de las quelas (Reyes et al., 2018). Luego, los camarones fueron aclimatados por 10 días en el mismo sistema de transporte y se alimentaron con la dieta basal.
Los camarones fueron mantenidos por 30 días en el sistema de cultivo individual diseñado por Reyes (2016). Los recipientes individuales (19 cm de diámetro, 284 cm2) se dispusieron en dos grupos de tres niveles dentro de cada acuario (unidad experimental). Se emplearon ocho acuarios (0.60 m de largo, 0.31 m de ancho, 0.35 m de alto y 55 l), cada uno con un sistema de recirculación de agua tipo air-water-lift y filtro biológico percolador (1.5 l/min). En cada recipiente de cultivo fue sembrado al azar un camarón y en cada acuario hubo seis recipientes (32 camarones m-2). Se emplearon 48 camarones machos (6.22 ± 0.02 cm de longitud total y 8.75 ± 0.08 g de peso total húmedo), que fueron seleccionados entre aquellos con apéndices cefalotorácicos completos. El peso total de los camarones se determinó con balanza digital ADAM AQT600 (± 0.1 g). La longitud total (desde la escotadura post orbital hasta el extremo posterior del telson) se midió con regla graduada (± 1 mm) con los camarones posicionados ventralmente.
Los restos de alimentos y los desechos sólidos de excreción acumulados en los acuarios fueron extraídos tres veces por semana con sifón. La calidad del agua de los acuarios fue monitoreada cada semana y se registró oxígeno disuelto y temperatura con el Oxímetro digital Hatch LDO (±0.01 mg/l; ± 0.01 ºC). La dureza total, amonio total y nitritos se determinó con test colorimétricos Nutrafin (± 0.5 mg/l).
Dietas
Los pétalos maduros de caléndula C. officinalis (flores naranjas) se colectaron de un campo agrícola del Centro Poblado Cascajal (Santa, Ancash) y transportados en bolsas de papel. En laboratorio, los pétalos se secaron en estufa (40 °C por 48 h) (Acosta et al. 2001), se molieron y tamizaron (250 µm). El rendimiento de harina fue del 2%. La dieta basal (30% de proteína bruta, 8.1% de lípidos totales, 4.6% de fibra bruta, 30% de extracto libre de nitrógeno y 2600 kcal/kg) fue formulada para C. caementarius (Reyes, 2016). Para las dietas experimentales, la dieta basal fue molida en mortero, suplementada con 100, 200 y 300 mg/kg de harina de caléndula, peletizado en húmedo con prensa casera. Los filamentos (3 mm de diámetro) de alimento fueron secados al ambiente durante tres días, cortados en alrededor de 5 mm de longitud y almacenados en bolsas de papel. La dieta basal sin caléndula fue el tratamiento control. Cada tratamiento dietario tuvo dos repeticiones. La ración diaria (08:00 y 19:00 h) fue del 6% de la biomasa húmeda, suministrada durante seis días a la semana.
Cromatóforos Epidérmicos
El color de los cromatóforos epidérmicos se determinó por observación, en estereos-copio (4 X), de la parte dorsal y central del exoesqueleto del segundo segmento abdominal de cuatro camarones vivos por tratamiento. La dispersión de cromatóforos fue determinada según Hogben y Slome (1931). Las fotografías de los cromatóforos se tomaron con cámara digital Kodak (Saibershok de 10 megapíxeles) acoplado a uno de los tubos oculares del estereoscopio.
Carotenoides
La concentración total de carotenoides fue determinado a los 15 y 30 días de alimentación, según el procedimiento de ArredondoFigueroa et al. (2003) con algunas modificaciones. Para ello, fue seleccionado al azar cuatro camarones de cada tratamiento, los que fueron sumergidos en agua helada (<5 ºC) por 5 min para luego diseccionar y extraer solo las vísceras (estómago, hepatopáncreas e intestino). El resto del cuerpo del camarón (cefalotórax, abdomen, apéndices, todos con 460 su exoesqueleto) fue inmediatamente triturado en mortero, se tomaron 10 g que fueron colocados en matraz (100 ml), se adicionó 50 ml de acetona y se agitó en baño de agua a 56 ± 1 ºC durante 10 min. Después, se dejó enfriar sobre agua helada, se diluyó con acetona, fue agitado por 2 min y dejado en reposo por 15 min. De la muestra procesada, 5 ml fueron vertidos en un matraz (50 ml) que contenía 20 ml de acetona y luego se aforó. La lectura se realizó en espectrofotómetro, contra acetona, a una absorbancia de 460 nm. La concentración total de carotenoides (CTC) se calculó con la siguiente ecuación: CTC (mg/kg) = [(A 460 x 0.164 x DF) / (40 x W)], donde A = Absorbancia a 460 nm, W = Peso de muestra (g), DF = factor de dilución = (100 x 50) /5 (Bioquimex-Reka 1998, tomado de Arredondo-Figueroa et al., 2003).
Además, al final de la experiencia, se aplicó el método de la cocción a cuatro camarones por tratamiento. Para esto, se inmovilizó al camarón en agua helada (<5 ºC) por 5 min y luego fue llevado a cocción (100 ºC) por 2 min (Tume et al., 2009). En este estudio, se tuvo en cuenta la ley peruana vigente (Ley 27265, Ley de protección a los animales domésticos y a los animales silvestres mantenidos en cautiverio) y se ha hecho todo lo posible para minimizar el sufrimiento durante el sacrificio de los camarones.
Análisis Estadístico
La normalidad de los datos se determinó con la prueba de Shapiro-Wilk. Las diferencias entre las medias de los tratamientos se determinaron por análisis de varianza de una vía y con la prueba pos hoc de Tukey, en todos los casos con significancia del 5%. Los resultados se expresaron como media ± desviación estándar. La relación de la concentración de caléndula de las dietas con el contenido de carotenoides en el cuerpo del camarón fue analizada mediante regresión. El procesamiento estadístico se realizó con el software SPSS v. 23 para Windows.
RESULTADOS
Supervivencia
La supervivencia de los camarones alimentados con la dieta sin caléndula y con 100 y 300 mg/kg de caléndula fue de 100%, en tanto que la de aquellos alimentados con 200 mg/kg de caléndula fue de 88%, sin diferencias estadísticas entre tratamientos.
Cromatóforos
El incremento de la concentración de caléndula en la dieta (hasta 300 mg/kg) no produjo incremento del número de cromatóforos ni dispersión de cromatóforos en el cuerpo de los camarones; sin embargo, el color de los cromatóforos varió entre tratamientos, siendo verde claro, marrón verdoso, marrón claro y marrón amarillento en los camarones alimentados con 0, 100, 200 y 300 mg/kg de caléndula, respectivamente. Los cromatóforos epidérmicos de los camarones de todos los tratamientos se mantuvieron como puntos con ligera dispersión, pero también se observó una aparente pigmentación del integumento (Figura 1a). El color de los cromatóforos epidérmicos de cada tratamiento confirió similar color del cuerpo de los camarones (Figura 1b).
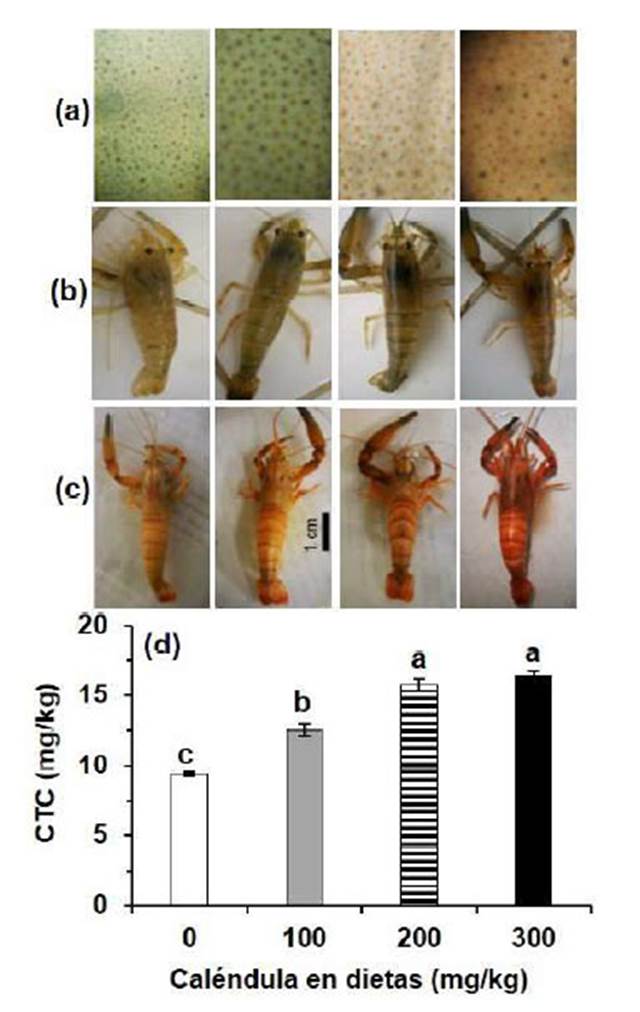
Figura 1 Pigmentación del cuerpo de Cryphiops caementarius alimentados durante 30 días con dietas suplementadas con caléndula (Calendula officinalis). a) Cromatóforos del segundo segmento abdominal de camarones vivos, observados a 4X. b) Los mismos camarones vivos empleados para fotografiar los cromatóforos. c) Color de camarones cocinados a 100 ºC por 2 min. d) Concentración total de carotenoides (CTC). Letras diferentes sobre las barras de la gráfica indican diferencia significativa (p<0.05)
Carotenoides
La concentración total promedio de carotenoides en el cuerpo de C. caementarius al inicio del experimento fue de 9.47 ± 0.30 mg/kg. A los 15 días de alimentación, el incremento de la concentración de caléndula en las dietas ocasionó aumento en la concentración total de carotenoides en el cuerpo del camarón, siendo diferente (p<0.05) entre tratamientos. El mayor contenido de carotenoides del camarón fue de 14.83 ± 0.49 mg/kg y se obtuvo en aquellos alimentados con 300 mg/kg de caléndula en la dieta, lo que permitió que acumularan 5.44 mg/kg de carotenoides en el cuerpo. Esto representó una ganancia de 57.9% en relación con el contenido inicial de carotenoides. Los carotenoides de los camarones alimentados con 200 mg/kg fue de 13.82 ± 0.45 mg/kg y acumularon 4.60 mg/kg de carotenoides cuya ganancia fue del 49.9%. Los carotenoides de aquellos alimentados con 100 mg/kg de caléndula fue de 12.22 ± 0.42 mg/kg y acumularon 2.60 mg/kg de carotenoides cuya ganancia fue del 27.0% (Figura 2a,b). Los carotenoides del cuerpo de los camarones ali mentados con la dieta sin caléndula disminuyeron a los 15 días (-0.07 mg/kg) (Figura 2b).
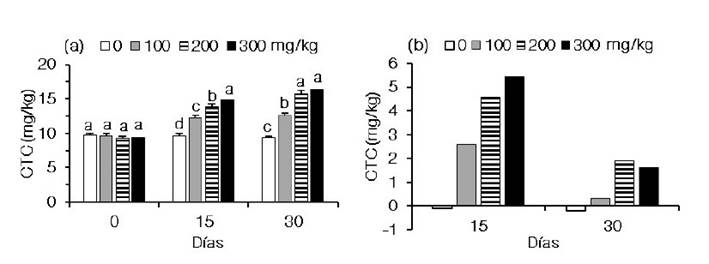
Figura 2 Concentración total de carotenoides (CTC) en el cuerpo de Cryphiops caementarius alimentados con dietas suplementadas con caléndula (Calendula officinalis). a) Variación de la CTC durante 30 días. b) Incremento de la CTC cada 15 días. Letras diferentes sobre las barras en un periodo indican diferencia significativa (p<0.05)
A los 30 días de alimentación, el color del cuerpo de los camarones después de la cocción fue más intenso conforme se incrementó la concentración de caléndula en las dietas. El color del cuerpo de los camarones del control y de los alimentados con 100 mg/kg de caléndula fue de un tono anaranjado claro y el de aquellos alimentados con 200 y 300 mg/kg fueron de un tono anaranjado y rojizo, respectivamente (Figura 1c). Durante este periodo, el contenido de carotenoides fue mayor con 300 y 200 mg/kg de caléndula en la dieta (16.44 ± 0.25 mg/kg y 15.72 ± 0.48 mg/kg, respectivamente), siendo diferentes (p<0.05) de aquellos alimentados con 100 mg/kg (12.53 ± 0.44 mg/kg) y sin caléndula en la dieta (9.37 ± 0.15 mg/kg) (Figura 1d, Figura 2a). En este último periodo, los camarones alimentados con 300, 200 y 100 mg kg-1 de caléndula acumularon en el cuerpo 1.61, 1.90 y 0.31 mg/kg de carotenoides, con ganancias de 10.9, 13.8 y 2.5%, respectivamente (Figura 2a,b). De otra parte, los carotenoides del cuerpo de los camarones alimentados con la dieta sin caléndula disminuyeron a los 30 días (-0.22 mg/kg) (Figura 2b).
La acumulación de carotenoides en el cuerpo del camarón se incrementó de manera logarítmica con relación a la concentración de caléndula en las dietas durante los primeros 15 días de alimentación; en cambio, a los 30 días, dicha relación fue una parábola cuya ecuación se ajustó a un polinomio (Figura 3).

Figura 3 Relación de la concentración de caléndula en las dietas con el promedio de la concentración total de carotenoides (CTC) acumulado en el cuerpo de Cryphiops caementarius a los 15 (Ï%) y 30 días (o) de alimentación
Los parámetros de calidad del agua de cultivo de C. caementarius se mantuvieron similares (p>0.05) en todos los tratamientos. La temperatura se mantuvo entre 20.9 y 21.3°C, la concentración de oxígeno estuvo entre 5.70 y 6.10 mg/l. El amonio total estuvo entre 0 y 0.01 mg/l, los nitritos entre 0.10 y 0.14 mg/l y la dureza total estuvo entre 124 y 132 mg/l.
DISCUSIÓN
Las dietas suplementadas con caléndula ocasionaron pigmentación del cuerpo de los camarones machos de C. caementarius debido a la acumulación de carotenoides, tal como ocurre en otras especies de crustáceos cuando son alimentados con pigmentos naturales. Por ejemplo, en Homarus americanus (Tlusty y Hyland, 2005), P. semisulcatus (Göçer et al., 2006), L. vannamei (Arredondo-Figueroa et al., 2003; AguirreHinojosa et al., 2012), Procambarus fallax (Kaldre et al., 2015), Macrobrachium rosenbergii (Zelaty et al., 2016).
Los camarones C. caementarius alimentados con dietas suplementadas con caléndula y con la dieta control no incrementaron el número de cromatóforos ni hubo dispersión de cromatóforos epidérmicos, porque se mantuvieron como puntos con ligera dispersión, que de acuerdo con Hogben y Slome (1931), corresponde al estado 3 de desarrollo. Estos resultados sugieren que la dieta no fue estímulo para que los camarones incrementen el número de cromatóforos ni dispersen los pigmentos de sus cromatóforos epidérmicos, por lo que el cambio de color del cuerpo de la especie en cautiverio y, probablemente, en el ambiente natural sería lento. La dispersión de pigmento en los cromatóforos de crustáceos es desencadenada por cambios en las condiciones de luz y para ello se necesita alta tasa de radiación (Fuhrmann et al., 2011). Esto explicaría la falta de dispersión de pigmentos de los cromatóforos de C. caementarius en el estudio, dado el sistema de manejo empleado, aunque se ha visto que la intensidad de luz en M. tenellum no ocasiona aumento del número de cromatóforos epidérmicos (VegaVillasante et al., 2015). Además, la aparente pigmentación del integumento de C. caementarius probablemente sea ocasionada por el color de la capa pigmentada de la cutícula del exoesqueleto del segundo segmento abdominal, así como del resto del cuerpo. Según Meyers (2000), dicha capa pigmentada es la zona donde también se almacenan los pigmentos, además de la hipodermis y de los órganos de los crustáceos.
El contenido total de carotenoides de C. caementarius capturados del ambiente natural fue de 9.47 mg/kg, y es el primer registro sobre este tipo de pigmentos en el cuerpo del animal, por lo que no es posible afirmar si corresponde a la concentración normal en la especie. Los carotenoides varían de acuerdo con las condiciones ambientales como en P. semisulcatus y Metapenaeus monoceros que es mayor en primavera y verano (16 a 15 mg/kg) y menor en otoño e invierno (13 a 11 mg/kg), debido a la calidad y cantidad de microalgas del ambiente natural (Yanar et al., 2004). De otra parte, cuando los camarones fueron alimentados con dietas sin caléndula, los cromatóforos epidérmicos fueron verdes claro y el contenido de carotenoides del cuerpo del animal fue de 9.37 mg/kg, similar al del inicio del experimento (9.47 mg/kg), lo que demuestra que la especie, como todo crustáceo, no sintetiza carotenoides por lo que deben ser ingeridos con la dieta (Meyers, 2000). Esta ligera pérdida de la coloración del cuerpo de C. caementarius se presenta cuando se cultiva en cautiverio, lo que es atribuido a deficiencia de pigmentos naturales en la dieta (Reyes, 2019). Por consiguiente, es conveniente incorporar pigmentos naturales en la dieta del camarón cuando se cultiva en cautiverio, para mantener o incrementar el color de los animales.
La mayor concentración de carotenoides de C. caementarius a los 15 días de alimentación fue de 14.83 mg/kg logrado con 300 mg/kg de caléndula en la dieta, siendo significativamente mayor que con las dietas suplementadas con 100 y 200 mg/kg de caléndula. Estos resultados demuestran que una dieta con alta concentración de caléndula incrementa rápidamente el contenido de carotenoides totales, y se obtiene por ello un color rojizo en el cuerpo de C. caementarius, con el que es posible dar valor agregado al camarón antes de realizar la cosecha. En P. semisulcatus alimentados con la dieta que contiene 100 mg/kg de caléndula se logra máxima acumulación de carotenoides (2.89 mg/kg) en los primeros 20 días de alimentación (Göçer et al., 2006).
El contenido de carotenoides en el cuerpo de C. caementarius incrementó de manera logarítmica con relación a la concentración de caléndula en la dieta, durante los primeros 15 días de alimentación, resultado que evidencia que los camarones metabolizaron rápidamente los carotenoides naturales. Sin embargo, en los siguientes 15 días de alimentación, los niveles de carotenoides disminuyeron abruptamente, lo que indica que la especie tuvo dificultades en incorporar carotenoides durante este último periodo, probablemente por ser ejemplares adultos cuyo metabolismo llegue a saturarse rápidamente con los carotenoides de la dieta. En P. japonicus, la absorción y transporte de astaxantina hacia los tejidos del animal puede ser saturada con 200 a 400 mg/kg de astaxantina (Yamada et al., 1990). En L. vannamei, la pigmentación muscular disminuye cuando se utilizan pigmentos naturales o sintéticos en las dietas desde el día 14 hasta el día 28, lo que significa que después de la saturación del tejido muscular con carotenoides de la dieta sigue el agotamiento (Arredondo-Figueroa et al., 2003); no obstante, en otros estudios se considera que el tiempo requerido para alcanzar la máxima deposición de pigmentos naturales varía entre 14 y 60 días (Tapia-Salazar et al., 2008).
En los camarones alimentados con 100, 200 y 300 mg/kg de caléndula durante 30 días, el color de los cromatóforos del cuerpo de ejemplares vivos fue marrón verdoso, marrón claro y marrón amarillento, y con concentraciones de carotenoides de 12.53, 15.72 y 16.44 mg/kg, respectivamente. Estos resultados evidencian que el camarón asimiló y metabolizó los pigmentos de caléndula para concentrarlos en los cromatóforos y probablemente en la capa pigmentada de la cutícula, lo que fue más intenso conforme se incrementó la concentración de caléndula en las dietas. Los pétalos de la flor de caléndula poseen carotenoides y xantofilas (Pintea et al., 2003), y es probable que la ligera pigmentación amarillenta sea consecuencia de la xantofila de caléndula. En diversos crustáceos, la astaxantina, β-caroteno y cantaxantina que reciben en las dietas son depositados en los tejidos principalmente como ésteres de astaxantina (Yamada et al., 1990; Boonyaratpalin et al., 2001; Breithaupt, 2007). El cuerpo marrón amarillento de C. caementarius vivos alimentados con 300 mg/ kg de caléndula ya es indicador de que hubo mayor acumulación de pigmentos de caléndula proporcionados con la dieta. En la langosta H. americanus la astaxantina libre se acumula más rápido de lo que el carotenoide podría transportarse y unirse a la proteína en la cutícula, cuando es alimentada con 220 mg/kg de astaxantina (Tlusty y Hyland, 2005).
La astaxantina en los crustáceos se encuentra asociada con proteínas formando carotenoproteínas (Meyers, 2000), la misma que puede desnaturalizarse por cocción y observar el color rojo de la astaxantina (Jantakoson et al., 2012). El cuerpo rojizo de C. caementarius obtenido después de la cocción permitió hacer evidente la presencia de la astaxantina. En P. monodon la coloración del cuerpo depende de la presencia de astaxantina en los tejidos y la dieta debe contener más de 125 mg/kg (Boonyaratpalin et al., 2001). De igual manera, las dietas suplementadas con zeaxantina y luteína de Tagetes erecta aumentan las concentraciones de astaxantina y carotenoides totales en L. vannamei, lo que confiere coloración rojiza principalmente en el exoesqueleto y el músculo abdominal (Aguirre-Hinojosa et al., 2012).
CONCLUSIONES
El cuerpo de los camarones machos de Cryphiops caementarius fue pigmentado con las dietas suplementadas con caléndula (Calendula officinalis).
La mayor concentración (14.83 mg/kg) y acumulación (5.44 mg/kg) de carotenoides fue logrado a los 15 días de alimentación con 300 mg/kg de caléndula en la dieta, siendo mayor (p <0.05) que con 200 y 100 mg/kg de caléndula que ocasionaron menor concentración (13.82 y 12.22 mg/kg) y acumulación (4.60 y 2.60 mg/kg) de carotenoides, respectivamente.
Los camarones no incrementaron el número de cromatóforos ni hubo dispersión de cromatóforos epidérmicos, pero el color de los cromatóforos fue marrón amarillento con el incremento de la concentración de caléndula en las dietas.
El cuerpo rojizo del camarón obtenido después de la cocción se obtuvo con la mayor suplementación de caléndula en la dieta (300 mg/kg).












 uBio
uBio 

