INTRODUCCIÓN
Los camélidos sudamericanos se caracterizan por tener una actividad ovárica que ocurre en ondas de crecimiento y regresión folicular; es decir, la onda folicular presenta fases de emergencia, selección, crecimiento, estática y regresión. Se reportan periodos variables de la onda folicular en llamas que van desde 12 hasta 24 días (Tibary, 2017), lo cual es un indicio de la inconsistencia de la información sobre la dinámica folicular y crea la necesidad de realizar trabajos de investigación para consolidar y utilizar el conocimiento generado en la aplicación de biotecnologías reproductivas (Adams et al., 1990; Bravo et al., 1990; Cancino et al., 2011; Miragaya et al., 2004; Vaughan et al., 2004).
Las biotecnologías reproductivas como inseminación artificial, transferencia de embriones y aspiración folicular para la producción de embriones in vitro requieren de conocimientos profundos de dinámica folicular y factores que rigen la actividad ovárica. Estudios iniciales sobre actividad ovárica en camélidos se basaban en la observación conductual y análisis hormonal. Actualmente el uso de la ultrasonografía reproductiva permite caracterizar in situ la dinámica folicular, ovulación y monitoreo de respuestas a tratamientos hormonales en camélidos sudamericanos (Chaves et al., 2002; Miragaya et al., 2004; Tibary, 2017).
Los transductores de uso común en ultrasonografía reproductiva en humanos como en otras especies domésticas son los lineales (transrectal) y microconvexos endocavitarios (transvaginal). Ambos tienen la disposición lineal de los cristales piezoeléctricos; sin embargo, los microconvexos se caracterizan por presentar un campo de visión más amplia, además que generan imágenes de mayor calidad, utilizados principalmente para la aspiración folicular en vacunos y equinos. Esta característica de ultrasonografía transvaginal permitiría evaluar eficientemente los fenómenos y comportamientos de la dinámica folicular en llamas (Berland et al., 2011; Bols, 2008; Trasorras et al., 2013; Wachsberg, 2003). Por este motivo, el objetivo del estudio fue la comparación ultrasonográfica transvaginal y transrectal de la dinámica folicular en llamas.
Ámbito de Estudio y Animales
La investigación se realizó durante la época reproductiva en las instalaciones del Laboratorio de Reproducción Animal de la Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional del Altiplano, en Puno, Perú. Se utilizaron 10 llamas hembras de 4 años, multíparas, sin cría y con estado corporal de 3.0 (Australian Alpaca Association, 2008). Los animales se alimentaban con pastos naturales, agua ad libitum, y se les suplementaba con heno de avena.
Evaluación Ultrasonográfica
La sujeción y preparación de las llamas se hizo siguiendo las recomendaciones de Hancco et al. (2015). La zona perineal y órganos genitales externos se lavaron e higienizaron con agua y jabón carbólico y solución de gluconato de clorhexidina 2%. Se introdujo la mano enguantada en el recto y se extrajo las heces para facilitar la evaluación ultrasonográfica.
La evaluación ultrasonográfica se hizo con un ecógrafo Sonostar SS8® (Sonostar Thecnologies, China) equipado con un transductor lineal rectal E7140 multifrecuencia para el examen transrectal y transductor microconvexo endocavitario V6S9 multifrecuencia para el examen transvaginal, ambos programados a la frecuencia de 6.5 MHz. Se hizo el examen transrectal y transvaginal de ambos ovarios en dos planos para cada animal en días alternos por un periodo de 90 días. Las imágenes se analizaron en modo 4B y almacenaron en forma digital para su posterior evaluación (Parraguez et al., 2010; Berland et al., 2011; Cancino et al., 2011; Hancco et al., 2015).
Morfología y Dinámica Folicular
La evaluación de las características morfométricas se hizo siguiendo las recomendaciones de la literatura científica (Bravo et al., 1990; Cavilla et al., 2013; Hancco et al., 2015) e incluyeron los siguientes parámetros:
Número de folículos por cohorte: Se contabilizaron al momento que existía en uno de los ovarios folículos con tamaños entre 2 y 3 mm. Folículos de este tamaño indican, además, el inicio de la fase de reclutamiento y se considera como el día 0 o inicio de la onda folicular.
Intervalo inter-onda: Número de días entre el momento en que se diferencian los folículos reclutados y uno de ellos (folículo dominante FD) alcanza 6.5 mm aproximadamente y termina cuando el FD disminuye su diámetro hasta los 5-6 mm.
Diámetro máximo del folículo: El diámetro máximo del FD alcanzado durante la onda folicular (en mm).
Tasa de crecimiento: Se consideró como la diferencia del diámetro máximo folicular del FD en una onda folicular menos el tamaño del folículo al momento de diferenciarse (folículo seleccionado) del grupo de folículos reclutados entre el número de días que duró el acontecimiento. Se expresa en mm/día.
Fases de la dinámica folicular: Se iniciacon el desarrollo sincrónico de un número determinado de folículos pequeños de 2-3 mm (fase de reclutamiento), continúa cuando uno de ellos aumenta su tamaño de forma diferenciada (fase de desviación folicular) y se hace dominante aumentando su diámetro (fase dominancia), momento en que se hace el registro para su evaluación. Luego, el folículo comienza una fase de regresión donde disminuye su diámetro hasta alcanzar aproximadamente los 6.5 mm (fase de regresión) (Bravo et al., 1990; Chaves et al., 2002; Manjunatha et al., 2012).
Relación entre el Diámetro Máximo Folicular y la Duración de la Onda Folicular
La relación entre el diámetro máximo (mm) folicular y la duración de la onda folicular (días) fue evaluada mediante una ecuación de regresión, siendo la variable predictora o independiente el diámetro máximo folicular y la variable respuesta o dependiente la duración de la onda folicular.
Análisis Estadístico
Las características morfométricas foliculares y fases de la dinámica folicular fueron evaluadas mediante estadística descriptiva (promedio, desviación estándar) según las técnicas de ultrasonografía transrectal y transvaginal mediante la prueba de t Student. La relación del diámetro máximo folicular y duración de onda folicular para ambas técnicas fue evaluada mediante regresión lineal (y=a+bx). La relación con número de folículos detectados mediante las técnicas transrectal y transvaginal fue sometida a una correlación de Pearson (Cavilla et al., 2013; Hancco et al., 2015). Los análisis estadísticos fueron procesados mediante el programa estadístico R 3.5.1 (R Core, 2018).
RESULTADOS Y DISCUSIÓN
Características Morfométricas Foliculares
Las características morfométricas de intervalo inter-onda (días), diámetro máximo del folículo (mm) y tasa de crecimiento (mm/ día) fueron similares tras la evaluación ultrasonográfica vía transrectal y transvaginal. Sin embargo, se registró un mayor el número de folículos/cohorte (folículos reclutados) al realizar la ecografía vía transvaginal (p<0.01).
Los patrones del desarrollo folicular en llamas en ausencia de un estímulo de ovulación se caracterizan por ser continuas con ondas sobrepuestas (overlapping) entre ellas, con duraciones de 20 ± 4.4 días, determinado por vía transrectal y de 22.5 ± 5.3 días por vía transvaginal (intervalo inter-onda), resultados diferentes a los reportados por Bravo et al. (1990) y similares con la mayoría de los estudios reportados en llamas (Adams et al., 1990; Chaves et al., 2002; Cavilla et al., 2013). Estas ondas corresponden a la renovación continua en el desarrollo de folículos, tal y como ha sido reportado en estudios en alpacas, vicuñas y guanacos (Vaughan, 2001; Miragaya et al., 2004; Riveros et al., 2010; Hancco et al., 2015). La variabilidad en la duración del intervalo inter-onda en las llamas evaluadas se debe a que mientras un FD está en fase de regresión, otro grupo de folículos está desarrollando para convertirse en el nuevo FD. Este fenómeno provoca que las hembras sean receptivas la mayor parte del tiempo (Bravo et al., 1990; Cavilla et al., 2013; Vaughan y Tibary, 2006).
Cuadro 1 Características morfométricas foliculares determinadas mediante ultrasonografía transrectal y transvaginal en 10 llamas
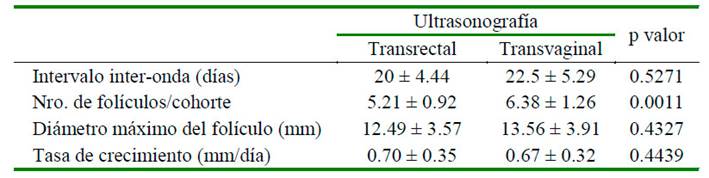
La onda folicular se inicia con el desarrollo de folículos reclutados. En este caso, el Nº de folículos/cohorte fue de 5.21 ± 0.92 y
6.38 ± 1.26 (Cuadro 1) para las evaluaciones vía transrectal y transvaginal respectivamente (p=0.0011). Mediante el uso del transductor endocavitario transvaginal se pudo observar un mayor número de folículos dado su mayor área de contacto, imágenes más amplias y de mayor calidad (Tenório Filho et al., 2007); resultados diferentes a otros reportes que indican entre 8 a 10 folículos/cohorte de 2 a 3 mm en llamas y alpacas (Adams et al., 1990; Vaughan et al., 2004). El desarrollo de folículos pequeños está asociado a un aumento y disminución inmediata de FSH, en tanto que el número de folículos reclutados depende del tamaño de la reserva ovárica, por lo menos en el bovino (Adams et al., 1992; Cushman et al., 1998). Sin embargo, no se dispone de información precisa sobre la secreción de gonadotropinas durante las ondas foliculares en camélidos sudamericanos.
El diámetro máximo del folículo fue de 12.49 ± 3.57 mm para la ecografía transrectal y de 13.56 ± 3.91 mm para ecografía transvaginal, sin diferencias significativas entre estos procedimientos (Cuadro 1). Los valores obtenidos fueron ligeramente superiores a los obtenidos en otros estudios (Bravo et al., 1990; Chaves et al., 2002; Cavilla et al., 2013) y similar al reportado por Adams et al. (1990) realizados por ecografía transrectal. Algunas características que merecen resaltarse son la alternancia del funcionamiento ovárico, siendo de 52.6% para el ovario derecho y 47.4% para el izquierdo; la presencia de folículos de mayor tamaño (>20 mm) con relación al total de folículos dominantes fue de 10.5%, y la sobreposición de ondas foliculares estuvo presente en 36.8% del total de ondas evaluadas. Asimismo, el 10.5% de las ondas tuvieron un comportamiento de codominancia (crecimiento de dos folículos diferenciados de los demás al mismo tiempo), característica también reportada en otros estudios en camélidos (Bravo et al., 1990; Chaves et al., 2002; Vaughan, 2011; Cavilla et al., 2013; Hancco et al., 2015).
El diámetro máximo del folículo sigue un proceso de crecimiento (fase de dominancia) que se relaciona directamente con el incremento de concentraciones de 17β-estradiol (Bravo et al., 1990; Chaves et al., 2002). Sin embargo, otros estudios indican un periodo de transición en que la relación entre el desarrollo folicular y la producción de estrógenos es variable (Cavilla et al., 2013). Con base a los resultados del presente estudio, se podría relacionar esta variabilidad de relación al porcentaje significativo de las ondas sobrepuestas.
La tasa de crecimiento fue de 0.70 ± 0.35 mm/día y 0.67 ± 0.32 mm/día para las evaluaciones transrectal y transvaginal, respectivamente (Cuadro 1) y sin diferencia estadística entre ellas. Estos resultados concuerdan con los valores reportados por Adams et al. (1990) y Cavilla et al. (2013). Este crecimiento se inició con la desviación del futuro folículo dominante (FD), posiblemente a causa del aumento del estradiol y receptores de LH a nivel de la capa de la granulosa, juntamente con el mantenimiento del factor de crecimiento de insulina tipo I (IGF1) (Ginther et al., 2017); sin embargo, no existe información sobre los patrones generales de la secreción de gonadotropinas (FSH y LH) durante las ondas foliculares de camélidos sudamericanos y camellos (Manjunatha et al., 2012).
Relación del Diámetro Máximo Folicular y Duración de la Onda Folicular
La relación entre el diámetro máximo (mm) folicular y la duración de la onda folicular (días) fue evaluada mediante una ecuación de regresión, siendo para la evaluación transrectal y = 0.89766x + 6.5554 (R²=0.423) y para la transvaginal de y = 0.8466x + 10.184 (R²=0.479), observándose en ambos casos una pendiente positiva, por lo que al aumentar el diámetro folicular aumentará la duración de la onda folicular. Sin embargo, los datos ultrasonográficos transvaginales muestran una R²=0.479 mayor en comparación al R²=0.423 para la vía transrectal, indicando que los datos se alinean con superioridad cuando se realiza la evaluación transvaginal. Es posible, que, al igual que en vacunos, los folículos de mayor tamaño suprimen la liberación de FSH por mayor tiempo, causando un intervalo inter-onda más largo, además que el FD secreta inhibina, que se caracteriza por la supresión en el desarrollo de folículos pequeños provenientes de una nueva onda folicular (Ginther et al., 1996; Ginther, 2016; Tibary, 2018).
Fases de Dinámica Folicular
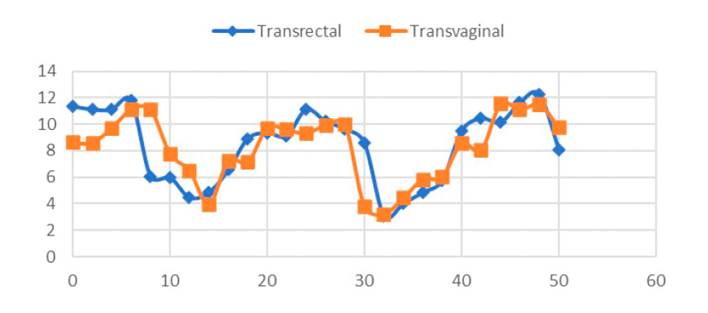
En el Cuadro 2 y Figura 1 se presentan la duración de las fases de la dinámica folicular en las 10 llamas del estudio. Se observa una concordancia en la duración de las fases de reclutamiento y regresión al utilizar las vías transrectal y transvaginal, mientras que la fase de dominancia tuvo una duración de casi dos días mayor al ser evaluado vía transrectal (p<0.05).
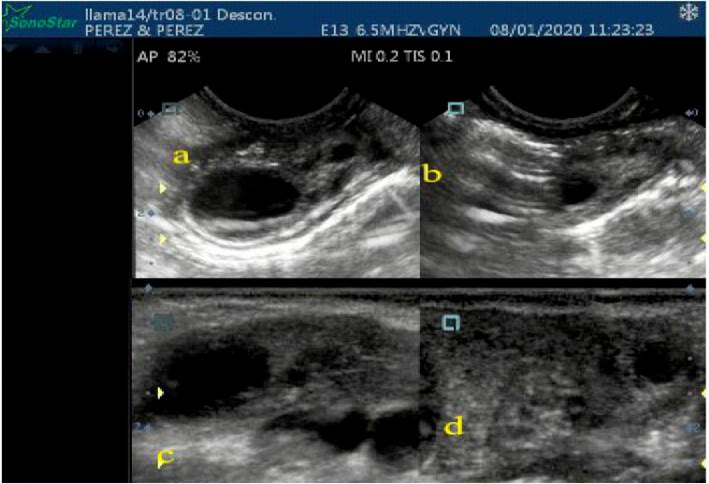
Esta diferencia se ha debido probablemente a que la evaluación con transductor endocavitario transvaginal permite observar con mayor detalle las características de crecimiento, estática e inicio de la regresión, debido a que estos transductores necesitan de un área pequeña de evaluación y por su forma microconvexa (forma triangular de la imagen) permite ampliar el campo de exploración, mientras que el transductor lineal transrectal tiene los cristales distribuidos en un superficie plana produciendo un campo de exploración rectangular, indicado para superficies más grandes (DesCoteaux et al., 2010), tal como se observa en la Figura 2. Resulta dos similares en la duración de las fases de la dinámica folicular han sido reportados en llamas con evaluaciones transvaginal y transrectal (Chaves et al., 2002; Cancino et al., 2011) e inferiores (Bravo et al., 1990).
Cuadro 2 Comparación ultrasonográfica transrectal y transvaginal de la duración de fases de la dinámica folicular en llamas.

Relación entre Diámetro Folicular y Número de Folículos
La relación entre el diámetro del FD y el número de folículos detectados por las técnicas transvaginal y transrectal muestran una correlación negativa baja (R²=-0.0827 y R²=0.0876, respectivamente), determinando que no existe una relación entre la presencia de mayor número de folículos detectados en ausencia de un FD o viceversa (Figura 3).
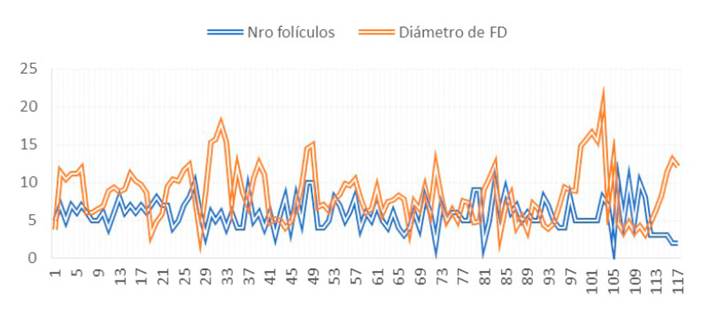
Figura 3 Relación inversa entre el número de folículos y diámetro del folículo dominante (FD) en llamas (n=10)
La relación inversa determinada en el estudio es similar a lo reportado en guanacos (Riveros et al., 2010), vicuñas (Miragaya et al., 2004) y camellos (Manjunatha et al., 2012). Estas similitudes respaldan la hipótesis de que el FD suprime, en cierta medida, el crecimiento de folículos subordinados en la onda existente (Manjunatha et al., 2012). Sin embargo, es necesario manifestar que los coeficientes de correlación que se obtuvieron fueron de baja intensidad, debido probablemente a la presencia de elevado número de ondas sobrepuestas que se desarrollan antes de que el FD termine su dominio.
Se puede concluir que la evaluación ultrasonográfica de los ovarios con transductor endocavitario transvaginal permite determinar con mayor precisión las características de la dinámica folicular en llamas en sus fases de reclutamiento, dominancia y regresión con la sobreposición de ondas foliculares como característica importante.












 uBio
uBio