INTRODUCCIÓN
Entre los aspectos limitantes de la crianza de llamas se encuentran los bajos índices de fertilidad (Díaz et al., 2011), en parte por la baja calidad del semen (Giuliano et al., 2008). La evaluación del semen es de extrema importancia para dilucidar la posible fertilidad de los machos. El espermiograma usualmente incluye la evaluación de la movilidad, concentración y morfología de los espermatozoides, teniendo este último una asociación con aspectos genéticos (Landry et al., 2003; Kosova et al., 2014; Ray et al., 2017). La variabilidad de la morfología del espermatozoide dificulta la evaluación subjetiva del operador, de allí las grandes variaciones intra e inter observador, reduciendo la fiabilidad de los resultados (Yeung et al., 1997).
La tecnología CASA (Computer Assisted Semen Analysis) ha sido usada en el estudio de la evaluación seminal de diversas especies, incluyendo a los camélidos (Soler et al., 2014a,b; Meza et al., 2018, Cucho et al., 2019). Así, la tecnología CASA-Morph permite realizar una evaluación objetiva de la morfología espermática (Soler et al., 2005a, Yániz et al., 2015; Maroto-Morales et al., 2016), eliminando de esta manera las evaluaciones subjetivas de los técnicos de laboratorio (Soler et al., 2016).
Usualmente, en las evaluaciones de la morfología espermática se considera a la muestra como una población homogénea, con una distribución normal, lo cual puede llevar a errores de interpretación, toda vez que existen subpoblaciones espermáticas (Valle et al., 2012, Valverde y Madrigal-Valverde, 2018), determinadas a partir del análisis multivariado de los parámetros morfométricos (Hirai et al., 2001; Valverde et al., 2016). Subpoblaciones espermáticas han sido reportadas en bovinos y ovinos (Rubio-Guillen et al., 2007; Martí et al., 2011; Maroto-Morales et al., 2012), así como en especies silvestres tales como ciervos rojos o pumas (Esteso et al., 2009; Cucho et al., 2016). El objetivo del presente estudio fue determinar la existencia de subpoblaciones espermáticas según la morfometría de los espermatozoides de llama, empleando el Integrated Semen Analysis System (ISAS®v1).
MATERIALES Y MÉTODOS
Lugar del Estudio y Animales
El estudio fue realizado entre enero y julio de 2018 en el Centro de Investigaciones en Camélidos Sudamericanos (CICAS) La Raya, de la Universidad Nacional de San Antonio Abad del Cusco. El Centro se encuentra en el distrito de Maranganí, Región Cusco, Perú, a una altitud de 4130 msnm. El área pertenece a la zona de vida de páramo húmedo-subalpino subtropical (Holdridge, 1967).
Se seleccionaron cuatro llamas Q’ara, de 4-6 años, sin problemas reproductivos y pertenecientes al plantel de reproductores del CICAS La Raya. El peso promedio fue de 121.2 ± 12.2 kg. El tamaño del testículo izquierdo fue de 4.38 ± 0.94 x 3.08 ± 0.34 cm, y el derecho fue de 4.35 ± 1.36 x 3.03 ± 0.28 cm. La alimentación de los animales era en base a pradera natural, siendo Stipa obtusa, Festuca sp, Calamagrostis amoena y Scirpus rigidus las especies predominantes.
Colección de Semen
La colección de semen se realizó mediante electroeyaculación, siguiendo el procedimiento propuesto por Director et al. (2007). Para esto, los machos fueron pesados y la distancia ano-próstata fue determinada con un ecógrafo Agroscan® L (Angoulême, Francia). Las colectas de semen se realizaron entre las 07:00 y 08:00 h, previo estímulo urinario. Las llamas estuvieron en ayuno desde las 17:00 h del día anterior. Se aplicó 0.3 ml de xylacina y 2.8 ml de ketamina por 100 kg de peso corporal (Rodríguez, 2013), se limpió la zona peniana con 10 ml de agua destilada a 37 °C, y se extrajeron las heces del recto. La sonda del electroeyaculador (Minitube®, Tiefenbach, Alemania), lubricada con gel de ecografía, fue introducida vía rectal y posada sobre la próstata. Se inició la estimulación eléctrica con 3 voltios (V), con tres descargas de 1 s y 2 s de descanso, tras lo cual se incrementaba el voltaje en 1 V. El procedimiento tuvo una duración de 15.5 ± 1.3 minutos, alcanzando un voltaje máximo de 17 V. La erección del pene se logró a los 11.8 ± 1.0 V, y la eyaculación a los 15.3 ± 1.0 V. El intervalo entre las colecciones de semen fue de una semana.
Se obtuvieron cuatro colectas por llama, con cuatro repeticiones (n=4, r=4). Las muestras de semen se recuperaron en tubos Falcon graduados de 50 ml. Se desechó el semen contaminado con orina o con bajas concentraciones.
Análisis del Semen
Se midió el volumen (ml) del semen así como se determinaron las características macroscópicas.
La movilidad de los espermatozoides se evaluó utilizando un sistema CASA Mot (ISAS®v1, Proiser R + D, Paterna, España), los archivos de video se analizaron a 25 cuadros por segundo (fps) durante un segundo.
La movilidad total (MT; %) se definió como el porcentaje de células móviles dentro de la muestra.
La concentración de espermatozoides (millones de espermatozoides por ml), se evaluó con un Spermtrack® (Proiser R+D, SL, España), empleando 3 µl de semen (100x).
El porcentaje de espermatozoides vivos se valoró empleando eosina y nigrosina (Minitube®, Alemania), usando 5 µl de semen y el porcentaje de espermatozoides con acrosoma reaccionado se evaluó con azul de Coomassie (Sigma-Aldrich®), según lo descrito por Fumuso et al. (2014). Espermatozoides con acrosoma intacto mostraban una coloración azul. Para esto, se empleó un microscopio de contraste de fase (UOP; Proiser R+D) del sistema ISAS® v1, contando no menos de 200 espermatozoides por muestra a 400x.
Análisis Morfométrico
El análisis de morfometría espermática se realizó usando el sistema ISAS® v1 CASAMorph (Proiser R+D, España). Las células espermáticas fueron capturadas empleando un microscopio de contraste de fase (UOP; Proiser R+D) equipado con un objetivo de 100x de campo claro (AN 0.17) y una cámara digital de video (Proiser 782M). El tamaño de las cuadrículas de captura de video fue de 768x576x8 bits con 256 niveles de grises. La resolución de las imágenes fue de 0.084 µm/ pixel en ambos ejes.
Se realizaron frotis empleando 5 µl de semen. Luego de 20 minutos de secado se tiñeron con Hemacolor® (Merck, Alemania), según protocolo del producto. Las imágenes en promedio de 270 espermatozoides de cada colecta de semen fueron capturadas y analizadas. Se analizaron los siguientes parámetros morfométricos: longitud (L, µm), anchura (W, µm), área (A, µm2), perímetro (P, µm), elipticidad (L/W), elongación ([L W]/[L+W]), regularidad (πLW/4A) y rugosidad (4πA/P2) de la cabeza del espermatozoide. Así mismo, la anchura (µm), área (µm2), distancia de inserción (distancia entre la cabeza y el eje de la pieza intermedia, µm) y ángulo de inserción (°) de la pieza intermedia del espermatozoide. La evaluación de la morfometría de un espermatozoide permite detectar alteraciones en la espermiogénesis y en la maduración epididimaria (Hidalgo et al., 2006).
Análisis Estadístico
Se usó la estadística descriptiva para el volumen, movilidad total, concentración, espermatozoides vivos y reacción acrosomal. En el caso de las variables de morfometría, se determinaron los supuestos de normalidad y homocedasticidad mediante las pruebas de Shapiro-Wilks y Levene para los datos obtenidos del análisis CASA-Morph de todas las células analizadas. Se realizaron procedimientos de agrupamiento para identificar subpoblaciones espermáticas del conjunto de datos de morfometría. Todos los valores para las variables morfométricas se estandarizaron para evitar cualquier efecto de escala.
El primer proceso consistió en realizar un análisis de componentes principales (PCA) o análisis factorial de todos los datos para obtener un menor número de combinaciones lineales (PC) que aún conservaran la mayor cantidad de información posible de las variables originales. El número de componentes principales (PC) utilizados en el siguiente proceso del análisis se determinó a partir del criterio de Kaiser; es decir, seleccionando solo aquellos con un valor propio (eingenvalue; varianza extraída de cada PC >1). Además, se realizó la prueba de esfericidad de Bartlett y la prueba KMO (Kaiser-Meyer-Olkin) (Spencer, 2013). Como método de rotación, se utilizó el método varimax con la normalización de Kaiser (Kaiser, 1958).
El segundo proceso consistió en realizar un análisis no jerárquico con el modelo de k-medias (k-means) que utiliza distancias euclidianas de las variables cuantitativas después de la estandarización de los datos, por lo que los centros de agrupación fueron las medias de las observaciones asignadas a cada agrupación (Kaufman y Rousseeuw, 2005). El análisis multivariado de grupos de k-medias se realizó para clasificar los espermatozoides en un número reducido de subpoblaciones (clusters o grupos) de acuerdo con sus variables morfométricas. En el proceso final, para determinar el número óptimo de grupos, los centroides finales se agruparon jerárquicamente utilizando el método Ward (Murtagh y Legendre, 2014). El procedimiento de agrupamiento permite la identificación de subpoblaciones de espermas ya que cada grupo contribuyó a un grupo final formado por los espermatozoides unidos a los centroides.
Se realizó un análisis de la varianza para determinar las diferencias estadísticas en las distribuciones de observaciones dentro de las subpoblaciones de espermatozoides para cada variable morfométrica. Las diferencias entre medias se analizaron mediante la prueba de Bonferroni. Los resultados se presentan como media ± error estándar de la media (SEM). La significación estadística se consideró en p<0.05. Todos los datos se analizaron utilizando el paquete IBM SPSS v 23.0 para Windows (SPSS Inc., EEUU).
RESULTADOS
Colección y Evaluación del Semen
La eficiencia de las colecciones de semen con el método de electroeyaculación fue de 84%. El 16% restante presentó baja concentración de espermatozoides (<50x106/ml), presencia de orina, o eran eyaculados parciales, lo cual determinó su exclusión del estudio. En total, se analizaron 16 muestras de semen, cuatro de cada animal. La duración promedio de las colectas fue de 15.5 ± 1.3 minutos. Las características seminales por macho se muestran en el Cuadro 1.
Morfometría Espermática
Se encontró un efecto animal (p<0.05) en las variables morfométricas de cabeza y pieza intermedia de los espermatozoides. Las variables morfométricas que indicaron la mayor variabilidad correspondieron a la pieza intermedia, y fueron la distancia, el ángulo de inserción y área, con coeficientes de variación de 78.0, 82.1 y 29.1%, respectivamente. Hubo diferencias significativas (p<0.05) entre animales para las variables de morfometría, especialmente las variables de cabeza del espermatozoide: longitud, ancho y área (Cuadro 2).
Componentes Principales (PCs) y Estructura Subpoblacional
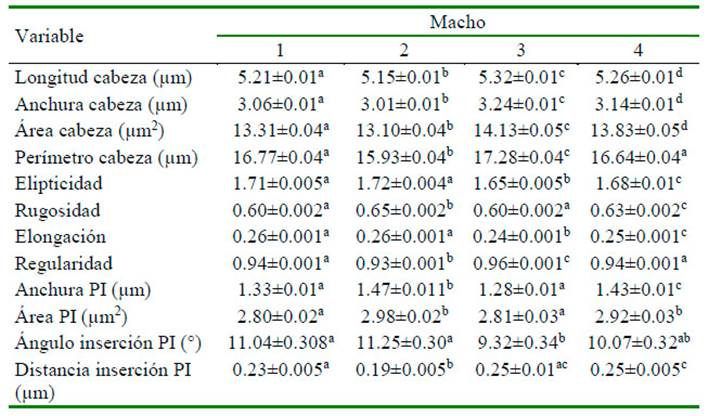
El análisis de componentes principales indicó cinco PCs:
Elongación (PC1), representada por la elipticidad, la elongación y la anchura de la cabeza del espermatozoide. El efecto del valor propio de las dos primeras variables fue el mismo, mientras que para la anchura de la cabeza fue de -0.710 indicando que en este grupo se encontraban aquellas células con menor anchura de la cabeza.
PC2 se refería a anchura, longitud y área de la cabeza, llamado longitud con un mayor efecto por anchura de la cabeza.
PC3, representado por el perímetro y la rugosidad, denominada circularidad dada principalmente por rugosidad (-0.860).
PC4, representado por anchura de la pieza intermedia (0.867) y área de la pieza intermedia, denominado anchura de la pieza intermedia.
PC5, representado por la distancia y el ángulo de inserción de la pieza intermedia, llamado inserción de la pieza intermedia y con una variación total explicada de 81.60%.
Los resultados indicaron que la forma y el tamaño del espermatozoide tiene un efecto relativamente mayor sobre la varianza total que las otras variables (Cuadro 3).
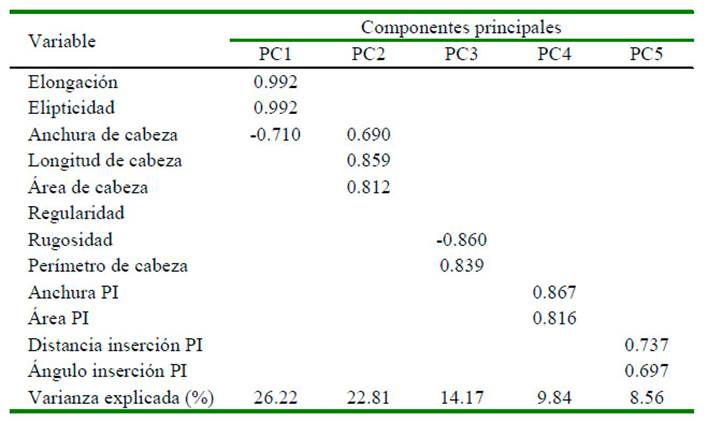
Los datos del análisis de conglomerados mostraron cuatro subpoblaciones (SP). Los valores morfométricos correspondientes a cada subpoblación se caracterizaron por: (a) células pequeñas con baja elongación y elipticidad (SP1), que mostró la longitud de la cabeza (5.03 ± 0.01 µm) y elipticidad (1.57 ± 0.003) más baja; y comprendía el 36.8% del total de células; (b) células de tamaño intermedio (SP2), tanto en la cabeza como en la pieza intermedia, exhibiendo longitudes de cabeza (5.20±0.02 µm) y anchura (3.15±0.01 µm) intermedias; (c) células alargadas y con valores bajos de anchura de cabeza (SP3 3.00±0.01 µm) y pieza intermedia (1.17±0.01 µm). Además, esta subpoblación presentó células con valores mayores de elipticidad (1.82±0.003) y elongación (0.29±0.001), y representó el 33.0% del total de células; y (d) células de pieza intermedia grande (SP4), que se caracterizó por la anchura de la pieza intermedia más alta (1.83±0.01 µm). La subpoblación SP2 mostró la menor proporción de células (9.9%), seguida de SP4 con 20.2% del total de células espermáticas (Cuadro 4).
Cuadro 1 Características seminales de cuatro llamas machos reproductores (promedio, desviación estándar [D.E.] y coeficiente de variabilidad [C.V.]) colectados por electroeyaculación (n = 4 muestras por macho)
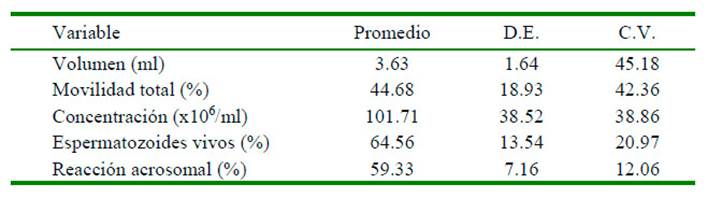
Cuadro 2 Variables morfométricas de la cabeza y pieza intermedia (medias ± SEM) del espermatozoide de llama (Lama glama)
Número total de células por macho: 1 = 1147; 2 = 1229; 3 = 915; 4 = 1056
PI: pieza intermedia; SEM: error estándar de la media
a-d Superíndices distintos dentro de fila indican diferencias significativas entre machos (p<0.05)
Cuadro 3 Valores propios de componentes principales (PCs) para variables morfométricas en espermatozoides de llama (Lama glama)
Varianza total explicada = 81.60%
Cuadro 4 Subpoblaciones espermáticas para variables morfométricas (medias ± SEM) en llamas (Lama glama)
SP: subpoblación; PI: pieza intermedia. a-d Superíndices distintos dentro de fila indican diferencias significativas entre subpoblaciones espermáticas (p<0.05)
Cuadro 5 Porcentaje de células espermáticas en cada subpoblación caracterizada en semen de cuatro llamas (Lama glama)
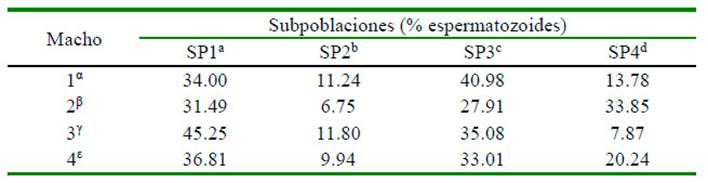
Cada fila indica el porcentaje de espermatozoides en cada subpoblación Conglomerado; suma de porcentajes de cada animal = 100
Número total de células por macho: 1 = 1147, 2 = 1229, 3 = 915, 4 = 1056
a,b,c,d Superíndices distintos indican diferencias dentro de fila respecto a las subpoblaciones espermáticas
α,β,γ,ε Superíndices distintos indican diferencias dentro de columna para cada animal Chi cuadrado, p<0.05
Los análisis de la proporción de espermatozoides en cada subpoblación para los cuatro machos revelaron diferencias entre machos y subpoblaciones de cada macho. Las subpoblaciones de esperma se distribuyeron de manera desigual para cada macho. Las subpoblaciones de espermatozoides con el mayor número de células se asociaron con un macho específico, [macho 1: SP3 (40.98%); macho 2: SP4 (33.85%); macho 3: SP1 (45.25); macho 4: SP1 (36.81%)]; sin embargo, las subpoblaciones con porcentajes más bajos de células en los machos 2 y 4 se asociaron en SP2 (Cuadro 5).
DISCUSIÓN
Colección y Evaluación del Semen
El tiempo de colecta (15.5 ± 1.3 minutos) fue mayor al reportado por Giuliano et al., (2008) de 6-12 minutos en Argentina. El volumen de 3.63 ± 1.64 ml fue inferior a los valores de 3.82-4.90 ml descritos por Carretero et al., (2016), Casaretto et al., (2012) y Fumuso et al., (2018), pero mayor a los valores de 2.1-2.8 obtenidos por Giuliano et al. (2008) y Carretero et al. (2015), siendo el semen colectado por electroeyaculación en todos los casos. Esta variable es dependiente de la libido del macho y de la estación reproductiva (Giuliano et al., 2008).
La movilidad espermática total (44.68 ± 18.93%) fue superior a las movilidades de 26.1 a 35.4% reportadas por otros autores (Giuliano et al., 2008; Casaretto et al., 2012; Carretero et al., 2015; Fumuso et al., 2018), quienes hicieron las evaluaciones de forma subjetiva. De otra parte, la concentración espermática obtenida en el presente estudio (Cuadro 1), fue similar a la reportada por (Fumuso et al. (2018)), pero mayor a los valores de 50.4-78.3x106/ml reportada por Giuliano et al. (2008), Casaretto et al. (2012) y Carretero et al. (2015), posiblemente debido a la libido de los animales, y al instrumento de medición (cámara hemocitométrica), ya que en este estudio se empleó un Spermtrack®, que muestra una mejor performance que las cámaras de Neubauer para estas evaluaciones (Soler et al., 2012; Crespilho et al., 2017).
El 64.56% de espermatozoides vivos encontrado en el presente estudio se encuentra dentro del rango de 52.2 y 65.2% reportado en la literatura (Giuliano et al., 2008; Casaretto et al., 2012; Carretero et al., 2015; Fumuso et al. 2018). El 59.33% de reacción acrosomal del estudio fue inferior a los valores reportados por Fumuso et al. (2018) y Carretero et al. (2015) en semen de llama colectado por electroeyaculación. En llamas, esta variable es importante, ya que permite evaluar los efectos de las biotecnologías reproductivas empleadas en esta especie (Giuliano, 2012).
Morfometría Espermática
En la actualidad, el análisis de la morfometría espermática con los sistemas de análisis computarizado de semen (CASAMorph), dan información precisa y objetiva de las variables morfométricas de una muestra de semen (Martí et al., 2012). En este estudio, la morfometría de 4347 espermatozoides de llama permitió encontrar diferencias significativas (p<0.05) entre machos en todas las variables evaluadas, al igual que en otros estudios (Casaretto et al., 2012; Soler et al., 2014a).
En el análisis de la morfometría de la cabeza del espermatozoide de llama, los valores de longitud, anchura, área, perímetro, elipticidad, rugosidad, elongación y regularidad, son similares a los reportados por Soler et al. (2014a,b), empleando el mismo sistema de análisis computarizado (ISAS®, Proiser R+D, S.L.) y la tinción Hemacolor®. No obstante,Casaretto et al. (2012) reportaron valores mayores para la longitud, anchura, área, perímetro, rugosidad y elongación de la cabeza del espermatozoide, posiblemente debido al software generalista que usaron para dichos análisis (QWin Plus, Leica Microsystems, Alemania) y la Tinción 15® (Biopur, Argentina), ya que diferentes técnicas de tinción proporcionan diferentes valores de morfometría (Soler et al., 2005b; Cucho et al., 2019).
Los valores del presente estudio para anchura, área, distancia y ángulo de inserción de la pieza intermedia del espermatozoide de llama (Cuadro 2), muestran diferencias significativas entre animales, así como elevados coeficientes de variación. La anchura, área y distancia de inserción de la pieza intermedia fueron similares a los reportados, en tanto que el ángulo de inserción de la pieza intermedia fue menor al hallado en alpacas (Cucho et al., 2019).
Subpoblaciones Espermáticas
Existen dos tipos de espermatozoides en función de la morfología espermática, los homomorfos y los heteromorfos. Los primeros tienen una morfología constante entre individuos, así como dentro del animal (Soler et al., 2014a). Los camélidos sudamericanos pertenecen al grupo de los heteromorfos (Buendía et al., 2002; Casaretto et al., 2012; Soler et al., 2014a; Cucho et al., 2019); es decir, estas especies muestran gran variabilidad de su morfometría intra e inter animal. En los últimos años la información proporcionada por los sistemas CASA combinada con la estadística multivariada, ha mostrado la verdadera estructura de la población espermática, la cual está compuesta por diferentes subpoblaciones (Soler et al., 2017).
Este es el primer estudio que ofrece información de la estructura de subpoblaciones espermáticas de llamas y de camélidos en función de la morfometría de dicha célula, en la cual se identificaron cuatro subpoblaciones espermáticas, como las halladas por Gutiérrez-Reinoso y García-Herreros (2016) en gatos, mientras que se han reportado tres SP en pumas (Cucho et al., 2016) y cinco SP en gallinas de guinea (García-Herreros, 2016). La evidencia que los espermatozoides se agrupan en subpoblaciones bien definidas de acuerdo con sus características cinéticas y/o morfométricas, permite dar una visión más amplia del comportamiento espermático; además, se ha visto que la distribución subpoblacional varía entre individuos, lo cual indicaría diferentes estrategias de competencia entre eyaculados (Valverde et al., 2019). La información hallada en este estudio proporciona nuevos conocimientos que podrían usarse en futuros estudios que emplean la morfometría del espermatozoide de llama como un indicador del estado reproductivo de esta especie.
CONCLUSIONES
El empleo de un sistema CASA-Morph apoyado con la estadística multivariada basada en el análisis de componentes principales permitió identificar cuatro subpoblaciones espermáticas con características diferentes de su morfometría en los eyaculados de llamas, hallándose diferencias significativas de subpoblaciones intra e inter animal.












 uBio
uBio 

