INTRODUCCIÓN
El cuy (Cavia porcellus) es una especie endémica de la región andina, y es una importante fuente de proteína animal para los pobladores de las zonas rurales. Esta especie es sensible a padecer de diversas enfermedades perjudicando su productividad (Morales, 2013). Las enfermedades infecciosas causan diversas lesiones en diversos órganos y tejidos (Morales et al., 2007; Matsuura et al., 2010; Morales, 2013, 2017). Por lo que, el uso de antibióticos se ha convertido en una alternativa esencial frente a muchas enfermedades, siendo usados por los productores a veces de manera inadecuada (Sachi et al., 2019), tanto en tiempo como en concentración, generando problemas de presencia de residuos de antibióticos en los tejidos corporales (Ujueta y Araque, 2016; Ramatla et al., 2017; Sarker et al., 2018).
Existen reportes en el país de 15-18% de mortinatalidad (Jiménez y Huamán, 2010), causando pérdidas económicas de hasta 53% por morbilidad y 95% por mortalidad en crianzas formales (Morales et al., 2007). Los reportes de brotes infecciosos evidencian patógenos como Salmonella enterica, Bordetella bronchiseptica, Diplococcus pneumoniae, Yersinia pseudotuberculosis, Streptococcus pyogenes, Pasteurella multocida, Escherichia coli, Clostridium sp, Streptococcus zooedpidermicus, Rickettsia,Chlamydia y Mycoplasma, entre otros (Morales, 2013, 2017; Oka et al., 2000; Samanidou et al., 2007), como causantes de enfermedades que van a requerir tratamientos antibióticos utilizando concentraciones y tiempos definidos.
Dentro de los antibióticos más usados, están las fluoroquinolonas, antimicrobianos sintéticos ampliamente utilizados en medicina veterinaria, con metabolismo hepático y excreción renal (Giguere y Fowling, 2013), con un periodo de retiro 28 días (Sumano y Ocampo, 2006). Además, están la cefalexina con eliminación renal y tiempo de retiro aproximado de 7 días (Sawant et al., 2005; Sumano y Ocampo, 2006); la oxitetraciclina cuya eliminación es por vía renal con un tiempo de retiro de 21 días (Oka et al., 2000; PérezTrallero e Iglesias, 2003; Agwuh y MacGowan, 2006; Sumano y Ocampo, 2006; Samanidou et al., 2007) y las sulfamidastrimetoprim con tiempo de retiro de 8 días (Sumano y Ocampo, 2006; Giguere y Fowling, 2013; Hyo-Ju et al., 2018).
Se dispone de una norma sanitaria con los límites máximos de residuos de antibióticos que pueden contener los productos animales, lo cual permite identificar su inocuidad (El Peruano, 2016); sin embargo, no existe la vigilancia sanitaria adecuada en los productos animales destinados al consumo humano, de modo que los residuos de los medicamentos usados profilácticamente en los animales pueden llegar al consumidor a través de la cadena alimenticia, provocando reacciones alérgicas, resistencia bacteriana y otras formas de toxicidad aguda (Medina et al., 2008; Ramatla et al., 2017). La OMS, sugiere que las industrias agropecuarias, piscicultora y alimentaria dejen de utilizar antibióticos sistémicos, teniendo como finalidad preservar la efectividad de los antibióticos para la medicina humana (OMS, 2018); evitando el desarrollo de resistencias bacterianas (Prado et al., 2002; Riedl y Casillas, 2003; Woodward, 2005; Hyo-Ju et al., 2018).
La OMS (2018) indicó que los antibióticos considerados de máxima prioridad y de importancia crítica son las quinolonas, cefalosporinas de tercera generación, macrólidos y cetólidos, glicopéptidos y polimixinas, previniendo de esta forma el incumplimiento de los tiempos de retiro de los medicamentos utilizados sobre los animales de consumo humano (Kabir et al., 2004). En el Perú, la Ley de Inocuidad de los Alimentos, aprobada mediante Decreto Legislativo N,° 1062 (El Peruano, 2008), presenta la Norma Sanitaria que establece los Límites Máximos de Residuos (LMR) de medicamentos veterinarios en alimentos de consumo humano mediante la Resolución Ministerial N.º 372-2016/MINSA (El Peruano, 2016).Ante esto, el objetivo del presente estudio fue determinar la posible presencia de antibióticos en carcasas de cuy comercializados para el consumo humano.
MATERIALES Y MÉTODOS
Lugar de Estudio
El muestreo se realizó en centros de abastos de Cajamarca, Chiclayo, Huancayo y Lima, y el procesamiento de las muestras se realizó en el Laboratorio de Microbiología y Microscopía de la Universidad Científica del Sur en Lima.
Población Muestral
La toma de muestras fue al azar a partir de cuyes beneficiados para el expendio. El tamaño mínimo de muestra se calculó mediante la fórmula para proporciones en poblaciones no finitas, tomando en cuenta una proporción referencial de 56% (Omotoso y Omojola, 2015) y un error de 5%, resultando en 379 muestras. Sin embargo, por disponibilidad de recursos y muestras, y a fin de hacer más representativo el estudio, se procesaron 410 carcasas (hígado, riñón y músculo).
Muestras y Análisis
Se tomaron muestras de riñón, hígado y músculo de cuyes beneficiados durante la etapa de oreo en centros de abasto de cuatro localidades (Huancayo, Chiclayo, Lima y Cajamarca), donde el beneficio es de tipo irregular y no formal. El muestreo fue al azar en base a la disponibilidad de animales beneficiados en los días de muestreo programados. Las muestras fueron colocadas en bolsas con cierre hermético dentro de cajas térmicas con refrigerantes, manteniendo una temperatura aproximada de 4 °C, y se remitieron al laboratorio para su procesamiento.
Se utilizó la técnica microbiológica de difusión en agar Mueller Hinton, la cual permite la difusión de diferentes moléculas, entre ellas, los antibacterianos y como cepa sensible el Bacillus subtilis ATCC 6633. Como control se utilizó un disco comercial de enrofloxacina de 5 µg de potencia. Esta técnica microbiológica permite la difusión de los potenciales residuos de antibióticos presentes en músculo, hígado, y riñón, basándose en la inhibición el crecimiento bacteriano de la cepa patrón, pudiéndose medir el diámetro de inhibición (Espitia, 2016).
Para estandarizar la densidad del inóculo se usó una suspensión de sulfato de bario (0.5 de la escala de McFarland) como estándar.
Se agregaron 0.5 ml de una solución de BaCl2 0.048 M (BaCl22H2O al 1.17% P/V) a 99.5ml de una solución de H2SO4 0.18 M (0.36N)(1% V/V) en constante movimiento para mantener la suspensión. Se verificó la densidad correcta del estándar usando un fotocolorímetro, cuya absorbancia a 625 nm fue 0.08 a 0.10 para el estándar 0.5 de la escala de McFarland. Luego se distribuyeron de 4 a 6 ml en tubos con tapa rosca o tapa de jebe.
Se seleccionaron 4-5 colonias de Bacillus subtilis ATCC 6633 con un ansa de siembra y se colocó en un tubo que contenía 4 ml de caldo tripticasa de soya y se incubaron a 35-37°C, hasta lograr la turbidez del estándar 0.5 de la escala McFarland. Luego de 15 minutos, se sumergió un hisopo estéril en la suspensión, se giró varias veces presionando firmemente sobre la pared interior del tubo por encima del nivel del líquido para remover el exceso de inóculo, para finalmente sembrar en estrías en tres direcciones diferentes. Pasados 5 minutos, se colocaron dentro de los orificios las muestras de hígado, riñón y músculo trituradas previamente en un mortero; asimismo, se colocó el disco control de enrofloxacina y se incubó por 24 horas a 37 °C. Luego de la incubación, se midió el diámetro de las zonas de inhibición bacteriana con la regla de Kirby-Bauer para cada muestra y disco control. Se consideró como resultado positivo a las muestras con zona de inhibición mayor o igual a 2 mm y resultado negativo a zona de inhibición menor a 2 mm o inexistente.
Análisis de Datos
La presentación de resultados se realizó en tablas de frecuencia con sus respectivos porcentajes e intervalo de confianza al 95%. La asociación entre la variable dependiente (residuos de antibióticos en tejidos evaluados) e independiente (Localidad) se hizo a través de la prueba de Chi cuadrado, utilizando el paquete estadístico STATA 12.0.
RESULTADOS
Se encontró la presencia de residuos de antibióticos en las muestras de hígado, músculo y riñón, mediante la técnica microbiológica de difusión; siendo validado por la presencia del halo de inhibición producido por el antibacteriano control (enrofloxacina). La frecuencia de halos de inhibición en los tres órganos se muestra en el Cuadro 1, habiendo en promedio 27.40% de muestras positivas a residuos de antibióticos, sin diferencia estadística entre órganos.
A nivel de las muestras evaluadas según localidad, ninguna de las muestras provenientes de Huancayo evidenció la presencia de residuos de antibióticos, a diferencia de las muestras de cuyes de Chiclayo que revelaron 81.25% (273/336) de positividad. Las muestras de Cajamarca y Lima tuvieron niveles menores de presencia de residuos de antibióticos (Cuadro 1). Los resultados se pueden atribuir al uso inadecuado de los antibióticos por parte de los productores y personal veterinario de las granjas de cuyes.
Las frecuencias de muestras positivas por localidad, según el órgano muestreado se presentan en los Cuadros 2, 3 y 4. En todos los casos, las muestras provenientes de cuyes de Huancayo fueron negativas a residuos de antibióticos, y las muestras provenientes de Chiclayo presentaron las mayores frecuencias de positividad.
DISCUSIÓN
En el presente trabajo se evidenció la presencia de residuos de antibióticos en 27.4% (337/1230) de las muestras analizadas de 40 carcasas de cuyes (Cuadro 1) listas para su expendio al público. Existen reportes similares, debido a que este tema es vigente y de prioridad en el país y en el mundo.
Cuadro 1 Frecuencia de presentación de residuos de antibióticos en muestras de músculo, hígado y riñón en 410 carcasas de cuy en expendio
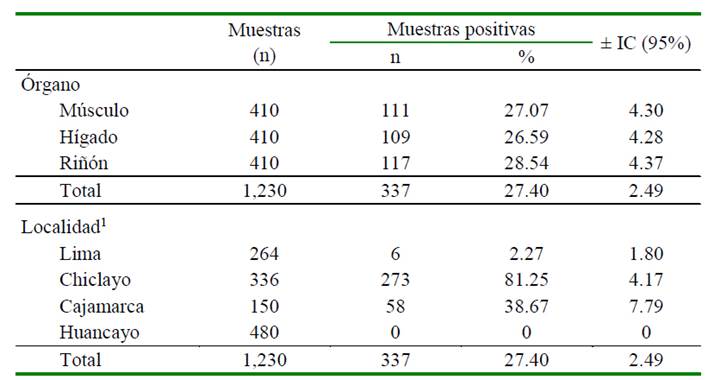
1 Se consideran 3 muestras por carcasa (músculo, hígado y riñón) para este análisis
Cuadro 2 Porcentaje de muestras de hígado positivas a la presencia de residuos de antibióticos según localidad (n=410)
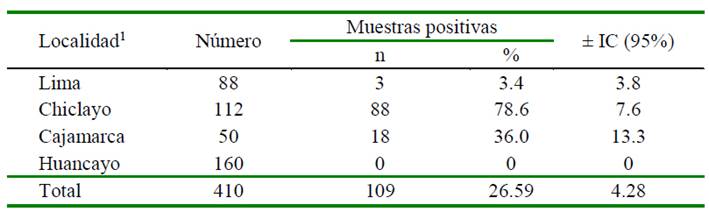
1 Asociación estadística significativa entre el órgano y la localidad (p<0.05)
Cuadro 3 Porcentaje de muestras de músculo positivas a la presencia de residuos de antibióticos según localidad (n=410)
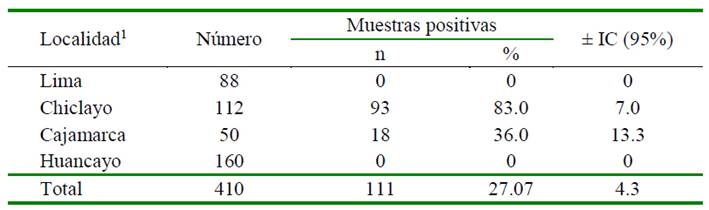
1 Asociación estadística significativa entre el órgano y la localidad (p<0.05)
Cuadro 4 Porcentaje de muestras de riñón positivas a la presencia de residuos de antibióticos según localidad (n=410)
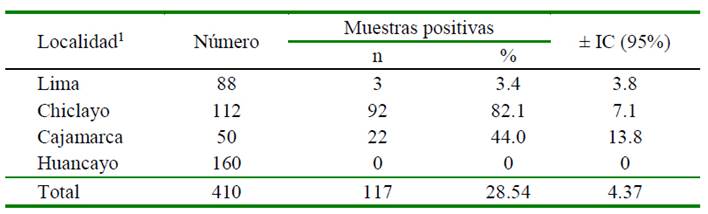
1 Asociación estadística significativa entre el órgano y la localidad (p<0.05)
Así, se reporta 49% (73/149) y 16.5% (40/242) de muestras positivas en plantas de beneficio municipal en Colombia y México, respectivamente (Acosta et al., 2014; Espitia, 2016), 43.4% (92/212) de muestras positivas a residuos de antibióticos en músculo, hígado y riñón en Bogotá (Ujueta y Araque, 2016), 45% en pollos, especialmente por enrofloxacina (Hyo-Ju et al., 2018), y en leche cruda y pasteurizada en El Salvador (Barrera y Ortez, 2012). El problema de residuos de antibióticos no es dependiente de la especie animal, sino corresponde a las malas prácticas de manejo de los antibióticos en la intención de prevenir o controlar enfermedades infecciosas (Sumano y Ocampo, 2006; Sarker et al., 2018; Kabrite et al., 2019; Sachi et al.,2019).
Además de la técnica microbiológica de inhibición en placa, existen otras técnicas, algunas más sofisticadas (Sachi et al., 2019). Así, Acosta et al. (2014) utilizaron la técnica de cromatografía líquida de alta eficiencia para determinar muestras de músculo de bovino positivas a oxitetracicilina, técnica que permite cuantificar los niveles de antibióticos y comparar con los límites permisibles internacionales como los declarados por la Unión Europea. Guerrero et al. (2009), de otra parte, analizaron muestras de leche cruda comercializada en mercados del distrito del Callao empleando el método presuntivo para antibióticos β-lactámicos y tetraciclinas de IDEX Laboratories, el cual cumple con los límites de sensibilidad de residuos de la FDA
Uno de los órganos más estudiados con la intensión de determinar la presencia de residuos de antibióticos es el músculo (Acosta et al., 2014; Espitia, 2016; Ujueta y Araque, 2016; Hyo-Ju et al., 2018; Paredes, 2018). La mayoría de las sustancias son eliminadas rápidamente del tejido muscular, por lo que las muestras de músculo positivas evidencian mayormente un nivel farmacológico que un nivel de residuos (Koenen-Dierick et al., 1995).
El riñón es un órgano que forma parte de la carcasa de los cuyes. En este estudio, 28.54% (117/410) de las muestras analizadas resultaron positivos a la presencia de residuos de antibióticos, siendo 82.14% de las muestras de Chiclayo (Cuadro 4). En otras especies existen numerosos reportes de presencia de residuos de antibióticos en este órgano; por ejemplo, Medina et al. (2008) reportaron 41.9% (26/62) de muestras positivas en cerdos y Noroña (2017), quién encontró 59.3% (16/27) de muestras positivas en bovinos de Quito, Ecuador.
En este estudio, el riñón presentó una relativa mayor frecuencia de casos con residuos de antibióticos en comparación con el músculo y el hígado (Cuadro 1); debido a que el riñón cumple un papel determinante sobre la cinética de los fármacos, específicamente sobre su proceso de eliminación. El riñón se encarga predominantemente de excretar la droga original o sus metabolitos hidrosolubles, activos o inactivos producidos en el hígado, y su participación en el metabolismo es relativamente pequeña (Arguedas, 1997; Sachi et al., 2019).
Este estudio reporta que 26.59% (109/410) de las muestras de hígado resultaron positivas a la presencia de residuos de antibióticos (Cuadro 2). Los resultados coinciden con lo reportado por diversos autores que encontraron el hígado como un órgano adecuado para la búsqueda de residuos de antibióticos (Valiente, 2002; Medina et al., 2008; Albujar, 2015). Estos resultados se deben a que la mayoría de los fármacos pasan por el proceso metabólico (oxidación, reducción, hidrolisis y conjugación) por las enzimas que se encuentran fundamentalmente en el hígado. Sin embargo, hay un reducido número de fármacos que son excretadas sin modificarse (Del Arco, 2008).
La alta frecuencia de residuos de antibióticos en las muestras analizadas cobra mayor importancia dado que tanto el hígado como el riñón son considerados parte de la carcasa del cuy. El estudio presenta la necesidad del país de establecer normas para el uso de antimicrobianos en la producción intensiva de cuyes, y disponer de pruebas validadas para su vigilancia (Sachi et al., 2019), a fin de prevenir y controlar la presencia de estos residuos que comprometen la inocuidad de la carcasa de cuy y ponen en riesgo la salud pública.












 uBio
uBio 

