INTRODUCCIÓN
Mycobacterium bovis (M. bovis) es el agente etiológico de la tuberculosis bovina (TB), enfermedad que se caracteriza por producir lesiones granulomatosas principalmente en linfonodos de cabeza, cuello, tórax y pulmón, además de otros tejidos. Afecta a una amplia gama de animales domésticos y silvestres, así como al humano (Corner, 2006, Michel et al., 2010). La tuberculosis bovina sigue siendo una de las enfermedades que más afecta la producción pecuaria de países en desarrollo, con importantes efectos en la salud humana y animal.
Las principales vías de infección de M. bovis son las vías respiratoria y alimentaria. La transmisión alimentaria puede explicarse por la práctica común de alimentar a los becerros recién nacidos con calostro procedente de vacas reactoras a tuberculosis, o con leche de tanque que puede estar contaminada con leche de vacas con mastitis tuberculosa (Neill et al., 1994; Houlihan et al., 2008). Se han descrito rutas adicionales de transmisión como infección cutánea por heridas, congénitas y rutas sexuales, que pueden conducir a lesiones extrapulmonares (Neill et al., 1994). La infección tuberculosa prenatal está altamente asociada con la presentación de lesiones tuberculosas en el útero o la placenta (Ozygit et al., 2007). La infección puede
propagarse a través de las venas umbilicales y por la ingestión o aspiración de líquido amniótico contaminado en el útero o durante el parto (Neill et al., 1994; Ozygit et al., 2007) La infección tuberculosa congénita puede ocasionar enfermedad en becerros jóvenes, lo cual se ha descrito con poca frecuencia. Existen informes previos de neumonía grave con lesiones granulomatosas en pulmón, hígado y ganglios linfáticos en becerras de 15 y 45 días de edad (Vural y Tunca; 2001; Ozyigit et al., 2007). Asimismo, Oruc (2005) y Roels et al. (2003) reportaron casos de tuberculosis meníngea bovinos adultos.
El presente reporte describe un caso clínico de meningoencefalitis tuberculosa en un ternero de cinco meses de edad, procedente de un hato lechero con antecedentes de 30% de prevalencia de tuberculosis.
CASO CLÍNICO
Un ternero Holstein Friesian de cinco meses, que mostró signos neurológicos como falta de coordinación, apatía, inclinación lateral de la cabeza y salivación excesiva fue presentado para su evaluación clínica. El animal era parte de un hato lechero con antecedentes de 30% de prevalencia a tuberculosis, que se encuentra ubicado en Río Verde, San Luis Potosí, México. La madre del ternero fue diagnosticada como reactor TB mediante la prueba cervical comparativa de tuberculina. Se realizó la necropsia del animal luego que el propietario autorizó el sacrificio humanitario. Se tomaron muestras de encéfalo para el diagnóstico de laboratorio.
Pruebas de Laboratorio
Histopatología
El tejido nervioso se fijó en formalina tamponada al 10%, y fue procesado por métodos de inclusión en parafina estándar, haciendo cortes de 5 µm de espesor que se fijaron en láminas portaobjetos y teñidas con hematoxilina-eosina (HE) y Ziehl Nielsen (ZN) para bacilos ácido alcohol resistentes (BAAR) (Corner, 1994).
Bacteriología
Se realizó el cultivo bacteriológico en medio de cultivo de agar sangre y agar chocolate para el aislamiento de Listeria e Histophilus, respectivamente (OIE, 2012a).
Para el aislamiento de M. bovis, la muestra de encéfalo se maceró y descontaminó utilizando el método modificado de Petroff (Payeur et al., 1992). Las muestras se sembraron en dos tubos de medio de cultivo Stonebrink y uno de Löwenstein-Jensen. Los medios de cultivo permanecieron a 37 °C durante nueve semanas. La identificación de M. bovis se realizó con pruebas bioquímicas y frotis teñidos con ZN (Payeur et al., 1992).
Diagnóstico de rabia
Se enviaron muestras del encéfalo frescas al Laboratorio Nacional de Referencia (CENASA-México) y se realizó el ensayo de anticuerpos fluorescentes (FAA) (OIE, 2012b).
Prueba molecular
La extracción de ADN se realizó a partir de la muestra de encéfalo con el paquete comercial DNeasy® para extracción de ADN de tejido y sangre (QIAGEN), siguiendo las instrucciones del fabricante. El ADN se usó para llevar a cabo la prueba de Reacción en Cadena de la Polimerasa Multiplex (PCR-MRD1) usando los oligonucleótidos específicos que amplifican un fragmento de 200 pb de la región RD1 en M. bovis BCG y de 150 pb para el complejo M. tuberculosis. Se incluyeron como controles positivos DNA de M. bovis BCG Cepa Pasteur (ATCC #35734) y M. bovis AN5 (ATCC #35726) (Talbot et al., 1997; Ramírez et al., 2004).
RESULTADOS
Hallazgos Macroscópicos
No se detectaron lesiones sugestivas o cambios macroscópicos visibles en piel, tejido subcutáneo, cuello ni en órganos de la cavidad torácica y abdominal. En el encéfalo se observó una lesión inflamatoria con congestión, aspecto granular en meninges y adherencias fibrosas en la zona ventral del encéfalo (Figura 1a,b); así como la presencia de varios nódulos pequeños (menores de 1.0 cm3) en la corteza cerebral y bulbo raquídeo. Las lesiones eran ligeramente amarillentas, casi redondeadas, bien delimitadas y suaves (Figura 1c). El líquido cefalorraquídeo era abundante y sanguinolento.
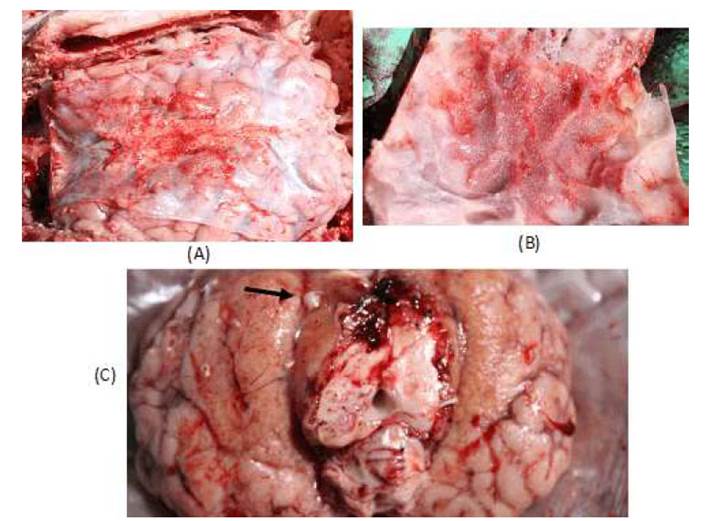
Figura 1 Lesión macroscópica en cerebelo de un ternero Holstein de 5 meses con sospecha de meningoencefalitis causada por Mycobacterium bovis. (A) Engrosamiento nodular de meninges, con hemorragia y congestión difusa moderada; (B) Hemorragia subdural con presencia de adherencias; (C) Médula oblonga con congestión difusa, petequias y presencia de un nódulo granulomatoso (flecha)
Hallazgos Histopatológicos
Microscópicamente se observó un infiltrado inflamatorio multifocal, compuesto por linfocitos, macrófagos, células epitelioides y células gigantes multinucleadas, rodeadas por una cápsula fibrosa externa. Se observó un área de necrosis caseosa y mineralización distrófica en el centro de las lesiones. Los BAAR se visualizaron mediante tinción de ZN en las áreas necróticas o en el citoplasma de células gigantes multinucleadas y epitelioides. El diagnóstico morfológico se estableció como meningoencefalitis granulomatosa con bacilos ácido-alcohol resistentes compatibles con tuberculosis (Figura 2).
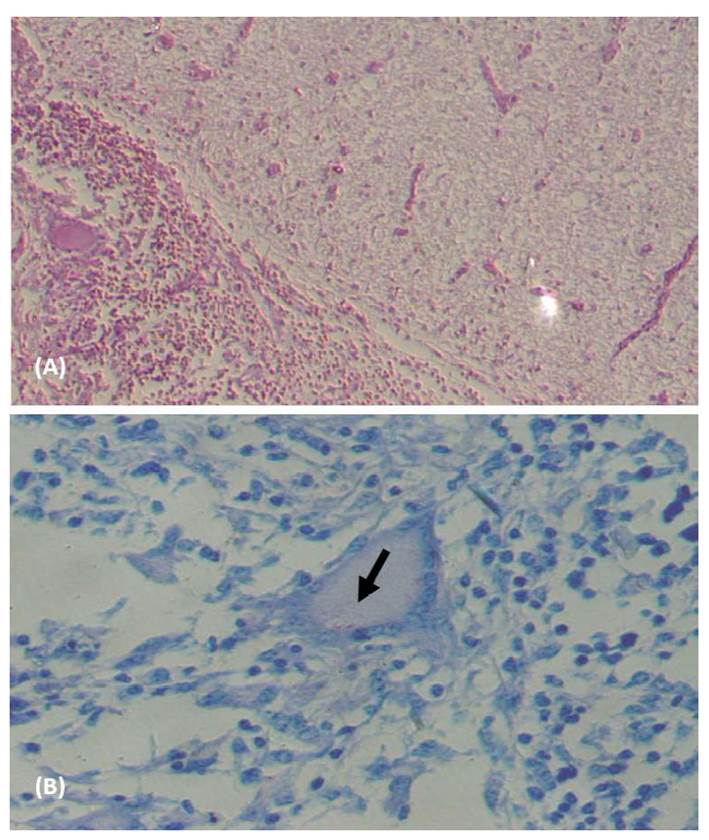
Figura 2 Fotomicrografía de corte histopatológico del encéfalo de un ternero Holstein de 5 meses con sospecha de meningoencefalitis causada por Mycobacterium bovis. (A) Infiltrado inflamatorio granulomatoso compuesto por macrófagos epitelioides y células gigantes multinucleadas, adyacentes a un área de degeneración difusa del neuropilo. Tinción HE, 100x; (B) Presencia de células epitelioides, y células gigantes multinucleadas con bacilos ácido alcohol resistentes intracitoplasmáticos (flecha). Tinción Ziehl Nielsen (ZN), 100x
Pruebas Microbiológicas
No se obtuvo aislamiento bacteriano de Listeria ni de Histophilus. La prueba de anticuerpos fluorescentes (FAA) para rabia fue negativa. Se detectó el crecimiento de colonias micobacterianas en los tubos de medio de cultivo de Stonebrink en la cuarta semana de incubación, donde la tinción de Ziehl-Neelsen permitió la detección de los BAAR. Los resultados de las pruebas bioquímicas clasificaron el aislamiento como M. bovis.
PCR-MRD1
Se obtuvo un producto de amplificación de 150 pb correspondiente al complejo M. tuberculosis en el PCR-MRD1 a partir del ADN del encéfalo del ternero (Figura 3).
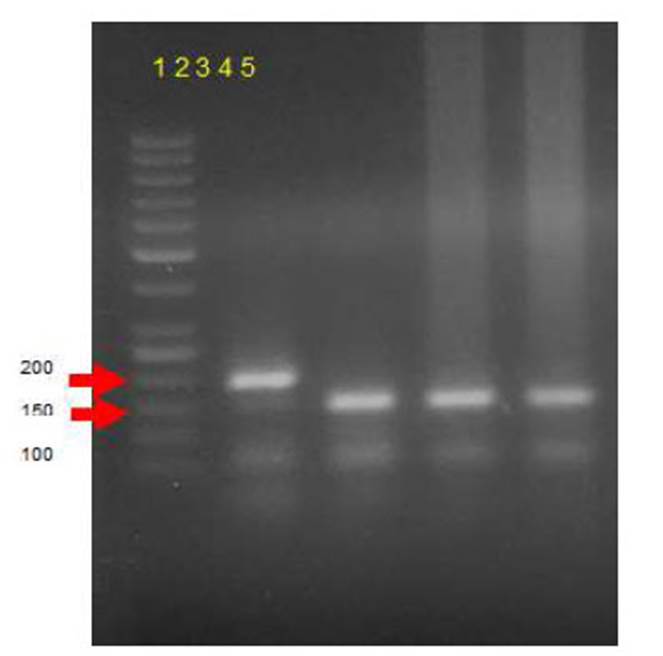
Figura 3 PCR-M RD1 realizado a partir de muestras de DNA del encéfalo del un ternero con meningoencefalitis tuberculosa. Carriles 1) Peso molecular (50 bp), 2) Control + BCG cepa Pasteur (200 pb), 3) Control + M. bovis AN5 ATCC (150 pb), 4 y 5) muestras del encéfalo de ternero (150 bp). Gel de agarosa 1.5%, teñido con bromuro de etidio
DISCUSIÓN
Se han descrito casos excepcionales de meningitis por M. bovis en humanos, jabalíes y ganado, pero la patogenia de esta presentación de tuberculosis en tejido nervioso sigue sin estar bien definida (Roels et al., 2003; Oruc, 2005; Evans et al., 2007; GarcíaSánchez et al., 2007).
El presente reporte describe la distribución de lesiones atípicas y los signos clínicos neurológicos en un ternero de cinco meses de edad con meningoencefalitis tuberculosa. No se detectó lesión tuberculosa primaria en pulmón, linfonodos, hígado o intestinos durante la inspección clínica. Las lesiones se presentaron principalmente en meninges craneales, lo que sugiere diseminación hematógena. Por lo general, las lesiones iniciales se producen en las meninges basilares, extendiéndose a través de los espacios aracnoideos hasta el plexo coroideo y los ventrículos (Oruc, 2005). Las apariencias macroscópicas e histopatológicas de las lesiones fueron similares a las descripciones previas de tuberculosis en el sistema nervioso central (Roels et al., 2003; Oruc, 2005).
La rápida progresión de la enfermedad puede explicarse debido a la infección congénita con elevada presencia del patógeno (García-Sánchez et al., 2007; Tomar et al., 2008; Nelson y Zunt, 2011). El ganado infectado experimentalmente con dosis altas de M. bovis (5 x 105 ; 1 x 106 unidades formadoras de colonias) desarrollaron enfermedad fulminante y lesiones pulmonares extensas en solo semanas después de la inoculación intranasal o intratraqueal, mientras que la infección a dosis bajas produce lesiones pequeñas sin signos de infección (Neill et al., 1988; Buddle et al., 1994). Además, se ha propuesto que la infección con cepas de M. bovis con mayor virulencia podría aumentar el riesgo de diseminación hematógena e infección del sistema nervioso central (Neill et al., 1994; Hernández-Pando, 2011).
La madre del becerro dio positivo en la prueba de tuberculina intradérmica; sin embargo, el animal no estuvo disponible para la confirmación de la enfermedad durante la evaluación del presente caso, de allí que no se pudo comprobar la posible infección uterina. Los criterios de diagnóstico para la tuberculosis congénita implican el diagnóstico en los primeros días o semanas de vida (Neill et al., 1994; Tomar et al., 2008). Se ha propuesto el término tuberculosis perinatal, ya que es difícil distinguir la tuberculosis verdaderamente congénita de la tuberculosis posnatal temprana adquirida, la cual no difiere mucho en cuanto a la presentación clínica y el pronóstico (Tomar et al., 2008). El curso clínico a menudo es fulminante y se caracteriza por diseminación rápida y la presentación de meningitis (Neill et al., 1994; Starke y Smith, 2001).
El hato de procedencia del ternero está ubicado en una región que se considera como endémica de rabia paralitica bovina. En un principio se tuvo la sospecha de rabia o de una encefalitis bacteriana, pero los resultados de laboratorio, tanto de la prueba de anticuerpos fluorescentes y la bacteriología para el aislamiento de Listeria e Histophilus fueron negativos. En este caso, la alta prevalencia de tuberculosis en el hato pudo haber facilitado la infección por M. bovis o la reinfección posparto. Por lo tanto, la contaminación ambiental y la práctica de alimentar a los terneros con leche de tanque a granel podría haber aumentado el riesgo de infección y la presentación poco común de la meningoencefalitis tuberculoso en el ternero.
La tuberculosis meníngea en el ganado bovino se ha propuesto como diagnóstico diferencial de la encefalopatía bovina (EEB), otra enfermedad crónica del ganado (Roels et al., 2003). La tuberculosis debe incluirse en el diagnóstico clínico diferencial en los bovinos que muestran signos clínicos neurológicos en hatos con alta prevalencia de tuberculosis.












 uBio
uBio 

