INTRODUCCIÓN
La crianza bovina en el Perú es principalmente de doble propósito (carne/leche), teniendo una distribución de 78% en la sierra, 11% en la costa y 10% en la selva. La provincia de Parinacochas en el departamento de Ayacucho se caracteriza por una crianza extensiva de ganado bovino, con una población de 49 275 cabezas (Aronés y Castillo, 2003; INEI, 2012; Rosemberg, 2012), la cual se ve afectada por diversas enfermedades reproductivas que ocasionan importantes pérdidas económicas a los productores.
Se estima que las pérdidas embrionarias y abortos afectan a un 20% de las vacas preñadas, perjudicando la producción láctea (Kemmerling et al., 2009; Rojas et al., 2018). Chlamydophila abortus (C. abortus) es uno de los patógenos más frecuentemente relacionados a pérdidas reproductivas, y la vía de diseminación del patógeno está relacionada a descargas uterinas, placenta y secreciones reproductivas relacionadas al ternero abortado, contaminando durante meses las áreas de crianza (Entrican et al., 2001; Caro et al., 2009).
C. abortus es una bacteria gramnegativa intracelular obligada eucariota, y cuyo órgano diana es la placenta (Cheong et al., 2019; Everett et al., 2000; Longbottom y Coulter, 2003; Pospischil et al., 2010). Se desarrolla en un medio ambiente extremo, presentando un ciclo con dos formas: un cuerpo elemental (CE) infeccioso, metabólicamente inerte y un cuerpo reticulado (CR), metabólicamente activo que solo se encuentra dentro de las células (Caro et al., 2009; Orellano, 2016). Este patógeno pertenece al orden de los Clamidiales, familia Chlamidiaceae y presentan dos géneros, Chlamydia y Chlamidophila, con nueve especies en total (Longbottom y Coutler, 2003; Quinn et al., 2005).
C. abortus es un patógeno con amplia distribución mundial y es la mayor causa de abortos en vacas, ovejas, cabras, además de ser un agente zoonótico para el humano (Orellano, 2016; Cheong et al., 2019). Las infecciones ocurren mayormente en sistemas de crianza intensiva debido a la concentración de animales, sobre todo en periodos de parto (Karlsson et al., 2010; Bhandi et al., 2019). La transmisión ocurre principalmente a través de la ruta horizontal por ingestión o inhalación, pero también se reporta la transmisión venérea, dependiendo de la carga bacteriana en el semen (Cheong et al., 2019).
C. abortus normalmente ingresa a las tonsilas, para luego diseminarse por la sangre y linfa. En animales no gestantes permanece latente en los tejidos linfoides (Da Silva et al., 2006). El patógeno afecta la placenta (Pospischil et al., 2010), ocasionado pérdida de células epiteliales coriónicas, involucrando a los cotiledones y tejido adyacente, con necrosis focal, desencadenando el aborto en el último tercio de gestación (Albarracin, 2010) o el parto prematuro (Orellano, 2016). La respuesta inmune en el bovino es efectiva para eliminar el patógeno y proporciona protección a la reinfección por la misma cepa, pero tiende a disminuir de cuatro a seis meses de la infección (Pospischil et al., 2010). Existen varios reportes sobre la enfermedad en el continente; así, se encontraron prevalencias en bovinos de 4.78% enArgentina y 1.42% en Brasil en bovinos. En Perú se reporta más del 20% (202/ 938) de ovinos seropositivos en la SAIS Túpac Amaru (Silva et al., 2009; Sánchez et al., 2018; Rojas et al., 2018).
Para un óptimo diagnóstico, se debe tomar muestras de sangre, tejidos fetales y membranas placentarias), así como una adecuada historia clínica de los casos presentados (Stuen y Longbotton, 2011). La Organización Mundial de Sanidad Animal (OIE) plantea como prueba diagnóstica primaria más sensible a la técnica de ELISA (OIE, 2019); sin embargo, existe la reactividad antigénica cruzada entre C. abortus y C. pecorum (Vretou et al., 2007; Sachse et al., 2009). Ante esto, se considera a la prueba de ELISA como la más específica y de mayor eficacia diagnóstica para C. abortus (Longbottom y Coulter, 2003). Por todo ello, el estudio tuvo como objetivo evaluar la presencia de anticuerpos de C. abortus en el ganado bovino de crianza extensiva.
MATERIALES Y MÉTODOS
La investigación se realizó en los distritos Chumpi (3207 msnm), Coracora (3178 msnm) y Pullo (2996 msnm) de la provincia de Parinacochas, ubicada al sur del departamento de Ayacucho, Perú, donde la crianza de ganado vivo se lleva a cabo bajo un sistema de tipo extensivo y bajo monta natural con un número de bovinos de forma muy irregular por ganadero, desde 10 a 200 animales aproximadamente.
El cálculo del tamaño de muestra se realizó según la fórmula de tamaño de muestra para poblaciones finitas (Wayne, 2012). La población bovina total era de 49 275, distribuidos en 27 063 cabezas en Parinacochas, 13 988 en Coracora, 7736 en Pullo y 5339 en Chumpi. Se consideró una prevalencia de 4.78% reportada por Rojas et al. (2018) en Argentina, un nivel de confianza de 95% y un error de 5%. El tamaño de muestra resultante fue de 62 bovinos, las cuales correspondieron a 12 para Chumpi, 32 para Coracora y 18 para Pullo. No obstante, el número de muestras se incrementó a 184 bovinos procedentes de 12 hatos ganaderos a fin de minimizar el error de muestreo y por disponibilidad de materiales.
La selección de muestras fue aleatoria. Se escogieron animales mayores de 4 meses, indistintamente del sexo de cada establecimiento. La sangre fue colectada por punción de la vena yugular en tubos al vacío de 10 ml. Las muestras fueron llevadas al laboratorio del Centro de Salud de la ciudad de Coracora, centrifugadas a 1600 g durante 5 minutos y el suero resultante fue congelado a 20 ºC hasta su análisis en el laboratorio de Microbiología y Microscopía Veterinaria de la Universidad Científica del Sur, Lima, para confirmar la presencia de anticuerpos de C. abortus mediante la técnica de ELISA indirecto con el kit comercial IDEXX Chlamydiosis Total Ab Test.
La seroprevalencia se expresó en porcentaje. Asimismo, se determinó la seroprevalencia corregida mediante la fórmula de Thrusfield (1990) tomando en cuenta la sensibilidad (99.7%) y especificidad (100%) del kit diagnóstico, con sus respectivos intervalos de confianza (IC) al 95%. Además, se evaluó la asociación entre la presencia de anticuerpos contra C. abortus con la edad, sexo y procedencia de los bovinos mediante la prueba de Chi cuadrado.
RESULTADOS
El 40.34 ± 7.06% (74/184) de los animales resultó positivo a anticuerpos contra C. abortus (Cuadro 1). A nivel de los distritos, Pullo presentó la mayor prevalencia (56.05 ± 7.15%; p<0.05). De otra parte, no se encontró asociación significativa con las demás variables (sexo, categoría zootécnica y raza). En la variable estado reproductivo, si bien hubo una gran diferencia numérica, el pequeño número de vacas preñadas muestreadas no permitió definir la asociación con la prevalencia del patógeno.
El diagrama de caja y bigotes en la Figura 1 muestra la dispersión de los valores de las edades de los bovinos evaluados en el estudio. La mediana fue de 5 años, pudiéndose determinar una simetría de edades para ambos resultados. Simetría similar fue observada entre el número de partos y los resultados a la prueba diagnóstica, donde el rango de animales tanto negativos como positivos a la prueba varió entre 1 y 6 partos, con una mediana de tres partos.
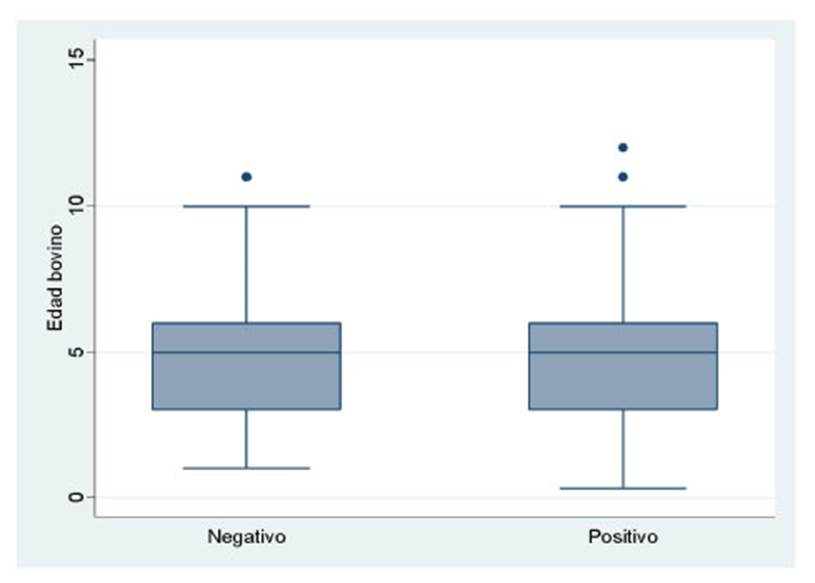
Figura 1 Diagrama de caja de bigotes de la edad de los bovinos evaluados según resultado a la prueba diagnóstica de Chlamydophilia abortus
Cuadro 1 Seroprevalencia de Chlamydophila abortus (n=184) en bovinos de crianza extensiva de los distritos de Coracora, Chumpi, y Pullo de la provincia de Parinacochas, Ayacucho (2018)
| Variable1 | Total (n) | Positivo (n) | Prevalencia (%) ± IC | Prevalencia corregida (%) ±IC | |
| Sexo | Macho Hembra | 20 164 | 7 67 | 35.00 ± 6.87 40.85 ± 4.47 | 35.11 ± 6.87 40.97 ± 7.08 |
| Categoría | Ternero Vaquilla Torete Vaca Toro Vaquillona | 1 13 13 144 6 7 | 1 7 3 57 3 3 | 100.00 ± 4.32 53.85 ± 7.18 23.08 ± 6.07 39.58 ± 7.04 50.00 ± 7.20 42.87 ± 7.13 | 100.30 ± 4.33 54.01 ± 7.18 23.15 ± 6.07 39.70 ± 7.05 50.15 ± 7.20 42.99 ± 7.13 |
| Raza | Criollo Holstein Bown Swiss Simmental | 103 4 44 33 | 42 2 22 8 | 40.78 ± 7.08 50.00 ± 7.20 50.00 ± 7.20 24.24 ± 6.17 | 40.90 ± 7.08 50.15 ± 7.20 50.15 ± 7.20 24.31 ± 6.18 |
| Procedencia | Chumpi Coracora Pullo | 33 117 34 | 8 47 19 | 24.24 ± 6.17 40.17 ± 7.06 55.88 ± 7.15 | 24.31 ± 6.18 40.29 ± 7.06 56.05 ± 7.15 |
| Estado reproductivo | Vacía Preñada | 140 4 | 54 3 | 38.57 ± 7.01 75.00 ± 6.24 | 38.69 ± 7.01 75.23 ± 6.22 |
| Total | 184 | 74 | 40.22 ± 7.06 | 40.34 ± 7.06 |
1 Solo la variable procedencia presentó asociación significativa (p<0.05) frente a anticuerpos de C. abortus
DISCUSIÓN
La prevalencia corregida de anticuerpos contra C. abortus fue de 40.34 ± 7.06% (74/184), siendo posiblemente el primer reporte de esta enfermedad en el área de influencia del trabajo. Estudios a nivel mundial reportan tasas de prevalencia entre 4.78 y 71% de seropositividad (Wang et al., 2001; Rojas et al., 2018), mostrando que la enfermedad tiene un comportamiento muy variable, potencialmente influenciado por factores como la especie de rumiante, el número de animales por área en sistemas de crianza intensiva, el contacto con otros rumiantes domésticos o silvestres, la modalidad de infección (alimentos contaminados, ingestión de tejidos placentarios, inhalación de aerosoles) (Nietfeld, 2001; Wang et al., 2001; Ndengu et al., 2018; Rojas et al., 2018; Bhandi et al., 2019).
C. abortus es reconocida como el patógeno más común causante de abortos infecciosos y de pérdidas reproductivas en el ganado bovino, ovino y caprino (Longbottom y Coulter, 2003; Edmondson et al., 2012; Sánchez et al., 2018). Solomon Bhandi et al. (2019) indicaron la relación de la seropositividad de C. abortus en cabras y el contagio con cabras de vida silvestre en Zimbabwe, en tanto que Ndengu et al. (2018) presentaron asociaciones similares entre bovinos y rumiantes de vida silvestre como búfalos (47.7%) e impalas (43.8%). El hacinamiento en el presente estudio no fue un factor de importancia, toda vez que los animales se encontraban bajo condiciones de crianza extensiva, por lo que el contagio podría deberse a pastos contaminados y aerosoles de animales infectados (Kauffold et al., 2014). Sin embargo, a pesar de que la crianza es extensiva, los animales en la región de estudio son movilizados continuamente por callejones, puntos de toma de agua y áreas de descanso, que son compartidos por el ganado de diferentes propietarios favoreciendo la transmisión de esta enfermedad.
La procedencia de los animales mostró una asociación significativa (p<0.05) con el diagnóstico positivo. La localidad de Pullo fue la más afectada, con una prevalencia corregida de 56.05% ± 7.15% mientras la localidad de Coracora fue la menos afectada (40.29 ± 7.06% (Cuadro 1). Esta asociación puede deberse a una mayor densidad animal por ganadero (Al-Qudah et al., 2004) y a las condiciones medio ambientales más adversas encontradas en el distrito de Pullo (Longbottom y Coulter, 2003).
CONCLUSIONES
La prevalencia corregida de anticuerpos contra Chlamydophila abortus en tres distritos de la provincia de Parinacochas (Ayacucho, Perú) fue de 40.34 + 7.06% (74/184).
La variable de procedencia (distrito) presentó asociación significativa (p<0.05) con la seropositividad a la infección por C. abortus












 uBio
uBio 

