INTRODUCCIÓN
En Chile, la salmonicultura se ha con- vertido en uno de los sectores más exitosos de la economía nacional (Bravo y Midtlyng, 2007; SalmonChile, 2017), siendo el segundo productor mundial de salmónidos de cultivo después de Noruega (Buschmann et al., 2009; SERNAPESCA, 2016). No obstante, las enfermedades infecciosas constituyen un serio problema para esta industria, siendo el mayor impacto en la fase de engorde, efec- tuada en el agua de mar, generando pérdidas que exceden los 100 millones de dólares anua- les (Bravo y Midtlyng, 2007; Ramírez et al., 2015). Los patógenos de mayor importancia son la bacteria Piscirickettsia salmonis y el ectoparásito Caligus spp. Según Cortés (2015), infecciones con P. salmonis son la principal causa de muerte de salmónidos en Chile, generando grandes mortalidades al fi- nal del ciclo del cultivo del salmón que dura prácticamente dos años (Rozas y Enríquez, 2014).
La piscirickettsiosis no se ha podido controlar debido a la escasa información acer- ca de varios aspectos del ciclo de vida de la bacteria como la virulencia y los mecanis- mos reguladores de patogenia (Segovia et al., 2018), así como los medios de transmisión y excreción del agente. Este patógeno también afecta diversos salmónidos como trucha arcoíris (Oncorhynchus mykiss), salmón coho (O. kisutch), salmón del Atlántico (Sal- mo salar), salmón chinook (O. tshawytscha), salmón japonés (O. masou) y salmón rosado (O. gorbuscha) (Leal y Woywood, 2007). Se sospecha que el salmón coho es la especie más vulnerable (OIE, 2019). P. salmonis es una bacteria intracelular facultativa, aeróbica, gram nega- tiva, inmóvil, acapsulada, pleomórfica y difí- cil de cultivar (OIE, 2019; Gómez et al., 2009). Vera et al., (2012) desarrollaron un nuevo medio de cultivo líquido para P. salmonis. La temperatura óptima de multi- plicación se encuentra entre 15 y 18 ºC, dis- minuyendo significativamente su replicación bajo los 10 ºC y sobre los 20 ºC (Fryer et al., 1992).
La bacteria infecta y sobrevive en su célula huésped mediante un proceso de viru- lencia regulado por una respuesta adaptativa durante la infección del huésped (Zúñiga et al., 2020). Asimismo, se describe la presencia de genes relacionados con la adquisición de hierro que codificarían posibles factores de virulencia (Pulgar et al., 2015; Yáñez et al., 2019). La piscirickettsiosis, denominada también como «Síndrome de Huito», «Síndro- me del salmón coho», «Septicemia rickettsial del salmón (SRS)»» (Leal y Woywood, 2007) es una enfermedad que se desarrolla en am- bientes con agua de mar, aunque se han re- portado casos en agua dulce (Bravo, 1994; Gaggero et al., 1995).
La enfermedad se presente entre abril y agosto, 6 a 12 semanas después que los «smolts» son transferidos a la fase marina del ciclo productivo (Cvitanich et al., 1990; SERNAPESCA, 2015), y se presenta en pe- ces de todas las edades, incluyendo tamaños comerciales (Corbeil y Crane, 2009). El agen- te se elimina por heces, orina y bilis de indivi- duos afectados, pudiendo penetrar piel y branquias intactas (Smith et al., 1999). Se desconoce si existen vectores marinos en la transmisión, pero la bacteria ha sido reporta- da en parásitos (Correal, 1995), moluscos, crustáceos, además de una diversidad de pe- ces (Arkush et al. (2006).
Los peces infectados presentan despla- zamiento errático, lento y en tirabuzón (Larenas et al., 1995, 2000; Rozas y Enriquez, 2014), letargia y anorexia (Larenas et al., 2000; Smith et al., 2011). La piel presenta úlceras hemorrágicas de diverso tamaño (Figura 1) (Branson y Nieto, 1991), con hemo- rragias perioculares (Larenas et al., 2000). El hematocrito se encuentra disminuido (Fryer y Hedrick, 2003). Internamente hay inflamación y necrosis en riñón, hígado, bazo, intestino, tejido hematopoyético, vejiga natatoria y musculatura esquelética (Alvarado et al., 1990; Almendras et al., 2000; Fryer y Hedrick, 2003; Monasterio, 2008).
La confirmación del patógeno en los tejidos es por aislamiento de líneas celulares (Mauel et al., 2008). P. salmonis en cultivo celular puede hacerse por la prueba de inmunofluorescencia indirecta (IFI) o la prue ba de la reacción en cadena de polimerasa (PCR) (SERNAPESCA, 2019). La prueba de inmunofluorescencia indirecta IFI desa- rrollada por Lannan y Fryer (1991) es la más utilizada por ser simple, de bajo costo, rápida y de adecuada sensibilidad para detectar la bacteria. En el microscopio de fluorescencia se le observa de color verde manzana y mor- fología cocoide, destacándose su contorno de forma de anillo (Larenas et al., 1996). La prueba IFI incorpora como primer anticuer- po inmunoglobulina IgG de ratón anti P. salmonis y como segundo anticuerpo un IgG comercial anti-ratón conjugado con isotiocianato de fluoresceína (FITC), aunque esta técnica fue modificada por Larenas et al. (1996) mediante el uso de microondas, lo cual disminuye el tiempo para la incubación del primer y segundo anticuerpo.
El objetivo de la presente investigación fue diagnosticar la presencia, así como la aso- ciación de Piscirickettsia salmonis en mues- tras de frotis renal, hígado, bazo y contenido intestinal de salmones coho provenientes de centros de cultivo, que presentaban brotes de piscirickettsiosis.
MATERIALES Y MÉTODOS
Ubicación del Estudio y Animales
El trabajo se realizó en el Laboratorio Nacional de Patología Animal de la Facultad de Ciencias Veterinarias y Pecuarias de la Universidad de Chile en 2015 con 19 salmones coho (Oncorhynchus kisutch), adultos moribundos o muertos, con signos clínicos de piscirickettsiosis. Los especímenes provinie- ron de jaulas de crianza de salmones de la Región de los Lagos, Chile, zona endémica, cuyo diagnóstico fue realizado por la empre- sa salmonera, según protocolos y normativa del SERNAPESCA (2018).
Necropsia y Frotis
Se procedió a la eutanasia de los peces con un golpe en la cabeza. La necropsia se realizó según Acuña et al. (2014). Se hizo un corte abdominal ventral con bisturí, del opér- culo hasta el ano, un segundo corte de la zona anal hasta el extremo superior del opérculo y un tercer corte uniendo los dos cortes pre- vios a finde facilitar la toma de muestras y evitar la contaminación cruzada. Se hicieron frotis de tejido renal, hígado, bazo y conteni- do fecal. En el caso de órganos, se hizo un corte y se introdujo un hisopo en la zona de la incisión, mientras que para las heces, se hizo el corte longitudinal en el intestino. El trans- porte de las muestras desde el centro de cul- tivo al laboratorio se hizo en un contenedor con bolsas de hielo.
Análisis de las Muestras
Para el análisis de las muestras se em- pleó la técnica IFI establecido por Lannan et al. (1991). Se utilizó el kit comercial SRS-Fluoro Test Indirecto del laboratorio BiosChile para detectar P. salmonis. El procesamiento de las muestras se realizó utilizando el proto- colo del kit.
Como controles positivos se usaron frotis de una alícuota de cultivo celular CHSE- 214 infectada con P. salmonis (100% de efec- to citopático). Para confirmar la presencia del agente se realizaron pruebas de tinción Giemsa, Gram, además de las pruebas de diagnóstico IFI y PCR. Los controles negati- vos utilizados fueron frotis de tejidos de ri- ñón, hígado, bazo y contenido intestinal de tru- chas arcoíris, clínicamente sanas, de la Re- gión de Valparaíso, Chile, lugar donde nunca hubo se ha registrado brotes de pisciric- kettsiosis. Se comprobó el estatus de estos controles mediante pruebas de Gram, IFI y PCR. Asimismo, como control negativo se utilizó frotis de cultivos celulares libres de la bacteria. Tanto los controles positivos como los negativos procedieron del laboratorio de Patología de la Facultad de Medicina Veteri- naria de la Universidad de Chile.
Para observar al patógeno se usó el microscopio de epifluorescencia Nikon, Optiphot-2, Tokio Japón, con longitud de onda de 494 nm. En cada muestra se observaron 10 campos con un aumento de 1000X, según lo descrito por Smith et al. (1999). Las mues- tras se clasificaron como negativas (-) o po sitivas (+) si se detectó al menos una bacte- ria dentro de los 10 campos visuales.
Cuadro 2 Detección de Piscirickettsia salmonis en frotis de riñón, hígado, bazo y heces de 19 individuos salmón coho (Oncorhynchus kisutch), procedentes de la Región de los Lagos, Chile
| Pez | Órganos | Órganos positivos (n) | |||
| Riñón | Hígado | Bazo | Heces | ||
| 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 | - + + - + - - + + + - - - - + - + + + | - - + + + - - + + + + + + - + + + + - | + + - - - - - - - - - - + - - + - - - | - + - - + + + - - - + - - + - + + - + | 1 3 2 1 3 1 1 2 2 2 2 1 2 1 2 3 3 2 2 |
| Total positivos | 10 | 13 | 4 | 9 | |
| Total negativos | 9 | 6 | 15 | 10 | |
| Positivos (%) | 52.6 | 68.4 | 21.1 | 47.4 | |
Análisis Estadístico
Se utilizó la prueba Q de Cochran y de McNemar en la distribución de Chi cua drado para comparar la presencia de P. salmonis en órganos y heces. Los resulta- dos se ordenaron en filas y columnas, donde los resultados (+) se asignó el 1 y a los (-) el 0. La hipótesis nula (Ho) indicó la probabili- dad de respuesta (+) para cada una de las cuatro muestras y la hipótesis alterna (Ha) indicó la probabilidad de registrar una res- puesta (+) para cada una de las cuatro mues- tras es diferente. Se utilizó la fórmula de Siegel (1956): ×2Q = ((K-1) [K « Gn2 - (« Gn)2]) / K « Lc - « Lc2, donde X2 : Estadígrafo Chi cua- drado de la prueba Q de Cochran; K: N° de tratamientos; Gn: N° de respuestas de cam- bio (+) de cada tratamiento en la columna; Lc: N° de respuestas de cambio (+) por indi- viduo de la muestra.
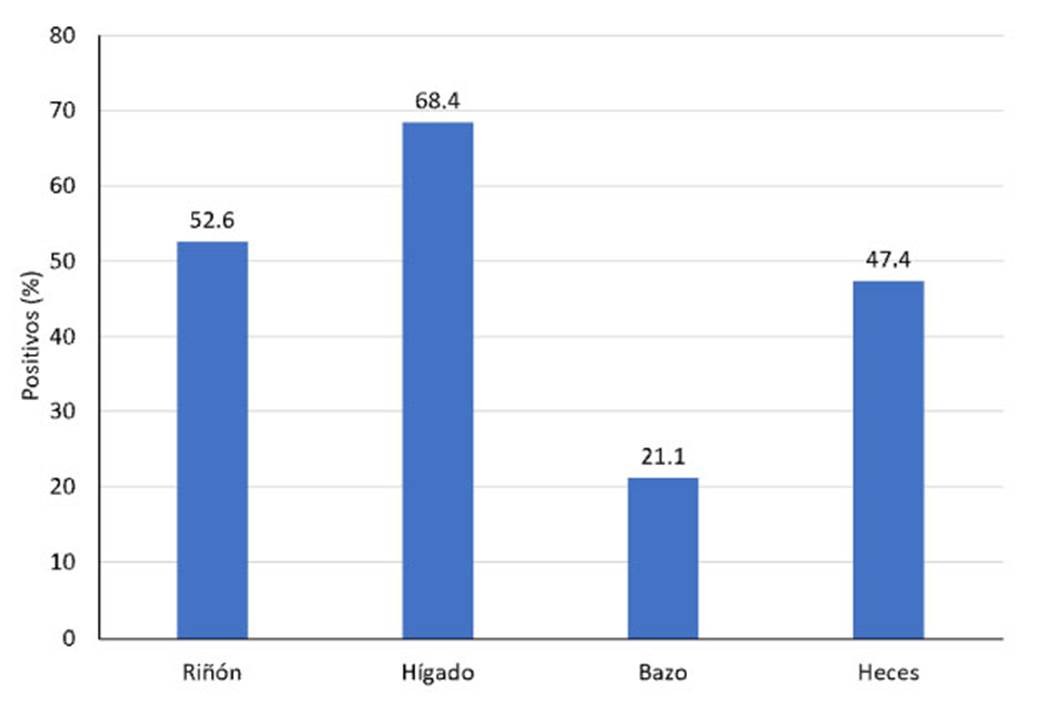
Figura 2 Porcentaje de positividad de Piscirickettsia salmonis en frotis de órganos y heces observados al microscopio de epifluorescencia de 19 especímenes de salmón coho (Oncorhynchus kisutch), procedentes de la Región de los Lagos, Chile
Para determinar la asociación estadísti- ca de P. salmonis en órganos y heces, se utilizó el método McNemar (X2) (Dawson- Saunders y Trapp, 1997; Martin et al., 1997), permitiendo evaluar con á = 0.05 la concor- dancia entre dos tratamientos en un mismo grupo de individuos. Se usó una tabla de con- tingencia agrupados en pares, según lo seña- lado por Martin et al. (1997) (Cuadro 1). La fórmula empleada fue × 2 = (|b-c| - 1)2 / b+c, donde a: Los órganos detectados como (+) por la prueba IFI y que son verdaderamente positivos; b: Los órganos de individuos falsos (+). IFI los define como (+), pero en realidad son (-); c: Los órganos de individuos falsos (-). IFI los define como (-), pero en realidad son (+); d: Órganos de individuos detectados como (-) por IFI y que son verdaderamente (-); a+c: Total de órganos verdaderamente positivos; b+d: Total de órganos verdadera- mente negativos.
RESULTADOS
Se confirmó la presencia de lesiones macroscópicas correspondientes a pisciric- kettsiosis en todos los especímenes. Se ob- servaron úlceras prominentes en la piel, pali- dez hepática y hemorragias en órganos ab- dominales. Los resultados de la prueba de IFI se muestran en el Cuadro 2 y la Figura 2). En el Cuadro 2 se puede observar que todos los peces resultaron positivo a la pre- sencia de P. salmonis, pues se logró detectar la presencia del agente en al menos una mues- tra de órganos o en heces.
Cuadro 3 Resumen de la asociación encontrada entre órganos y heces de 19 especímenes de salmón coho (Oncorhynchus kisutch), procedentes de la Región de los Lagos, Chile salmón coho, afectados positivos a Piscirickettsia salmonis
| Hígado | Bazo | Heces | |
| Riñón | Existe asociación significativa (X²= 0.333) | Existe asociación significativa (X²= 2.083) | Existe asociación significativa (X²= 0.307) |
| Hígado | No existe asociación significativa (X²= 4.923) | Existe asociación significativa (X²= 0.642) | |
| Bazo | Existe asociación significativa (X²= 1.777) |
Grado de asociación entre órganos y heces en forma conjunta
Empleando la tabla de contingencia del Cuadro 1 y la prueba Q de Cochram con un á=5% con la distribución de Chi cuadrado y grados de libertad K-1=3 se obtiene la sumatoria de calores positivos por cada ór- gano y heces; es decir, 10, 13, 4 y 9 respecti- vamente, lo que resulta en un valor de Q= 7.636, el cual indica que los datos obtenidos difieren significativamente al ser analizados en forma conjunta.
Asociación entre órganos y heces
El Cuadro 3 muestras el resultado de las asociaciones estadísticas entre órganos y heces de salmón coho usando la ecuación de McNemar (X2).
DISCUSIÓN
Se analizaron muestras de 19 salmones coho con la prueba IFI para detectar P. salmonis, comprobando mayor positividad al patógeno en las muestras de hígado (68.4%), seguido de riñón (52.6%), heces (47.4%) y bazo (21.1%) (Figura 2), demostrando que ningún órgano en forma independiente es capaz de detectar el 100% de los animales con piscirickettsiosis. Al asociar los resulta- dos de los órganos en pares y de a tres se pudo establecer la mejor asociación capaz de detectar el 100% de los animales infectados (Figura 3).
Según la Figura 3, la asociación de ri- ñón solo detecta el 78.9% de peces positivos a P. salmonis, mientras que la asociación de hígado, bazo y heces detectó el 100% de in- fectados. Esto no concuerda con el OIE, que indica que los mejores órganos para diagnos- ticar la piscirickettsiosis son el riñón e hígado (Evensen, 2016).
Según la OIE (2006) se menciona que los órganos de diagnóstico para piscirickettsiosis son solo el riñón y el hígado. No obstante, en el presente trabajo se inclu- yeron muestras de bazo, debido a que Cvitanich et al. (1990) describe que rickettsias como P. salmonis afectan princi palmente al bazo y riñón. De otra parte, se decidió incluir muestras de heces porque Smith et al. (1999) describieron que el agen- te es eliminado por vía fecal.
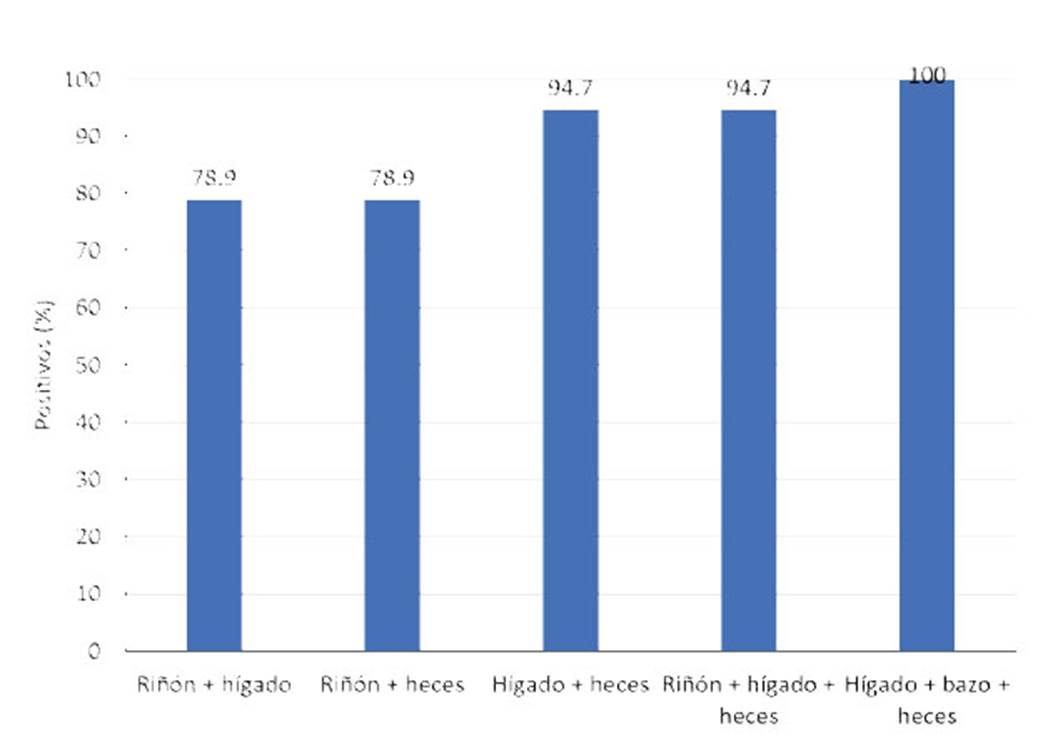
Figura 3 Porcentaje de detección de piscirickettsiosis (Piscirickettsia salmonis) por asocia- ción de +órganos-heces de 19 especímenes de salmón coho (Oncorhynchus kisutch), procedentes de la Región de los Lagos, Chile
En el presente estudio se encontró que la lesión macroscópica más prominente eran las úlceras, aunque hasta la fecha no se ha demostrado que las úlceras sea otra vía de eliminación del agente. Salinas et al. (1998) demostró que las vías de eliminación de P. salmonis en peces con signología de piscirickettsiosis era la orina y la bilis. Asi- mismo, se ha demostrado la eliminación de P. salmonis por vía fecal al medio marino (Sali- nas et al., 1998; Larenas et al., 2005; Peirano, 2015), pero se debe establecer si el patógeno es viable y logra afectar a otras especies sus- ceptibles. En el presente estudio se demostró que los peces excretan P. salmonis vía fecal en condiciones de cultivo en agua de mar.
Según Allen y Hopeb (2014), hay bac- terias que afectan a salmónidos y no salmónidos, capaces de sobrevivir en el estó- mago para luego crecer y multiplicarse en el intestino, como el Vibrio anguillarum, agente causal de la vibriosis en salmónidos. Este so- porta el pH y las enzimas del estómago, lue- go se desarrolla en el intestino y se elimina vía fecal; no obstante, no hay estudios que indiquen que P. salmonis sea capaz de infec- tar por esta vía a otros peces. Salinas et al. (1998) y Larenas et al. (2005) demostraron la presencia de la bacteria en riñón, heces, orina y bilis en truchas arcoíris, previamente infectadas y cultivadas en agua dulce. Según esto, la bacteria podría ingresar al intestino y ser eliminada vía fecal por medio de la bilis. En el presente estudio se halló positividad al agente en el riñón, estimándose que la bacte- ria podría ser eliminada en la orina, vía riñón, tal y como fue reportado por Henríquez et al. (2016), por lo que sería oportuno estudiar el riñón y orina de salmónidos cultivados en agua de mar y hallar la asociación del agente y la posible eliminación vía renal y establecer si los salmones clínicamente sanos logran eli- minar P. salmonis vía fecal.
Los resultados sobre presencia del P. salmonis en hígado, bazo y heces aquí halla- dos, muestran importante avance y ayuda, dando mayor precisión diagnóstica de la in- fección. Los resultados confirman la elimi- nación de P. salmonis por las heces en sal- mones coho cultivado en agua de mar, lo cual solo se había observado de forma experimen- tal (Larenas et al., 2005). Se podría conside- rar que la bacteria es viable y, por lo tanto, existiría el riesgo de transmisión horizontal hacia otras especies susceptibles. Además, la excreción del agente vía fecal puede re- presentar un medio de detección temprana, antes que aparezca un brote de piscirickettsiosis que afecte a los centros de cultivo en Chile.
CONCLUSIONES
Se detectó Piscirickettsia salmonis mediante la prueba de inmunofluores- cencia indirecta (IFI) en hígado, riñón bazo y heces del salmón coho (Oncorhynchus kisutch), cultivados en agua de mar.
Se encontró mayor frecuencia del agente en el hígado (68.4%) seguido del ri- ñón (52.6%), indicando que ninguno de los dos órganos fue suficiente para de- tectar el total de peces positivos a P. salmonis.
La asociación de los resultados de frotis de muestras de hígado, bazo y heces permite detectar el 100% de los peces infectados con la bacteria.
P. salmonis se encontró por primera vez en heces de salmón coho provenientes de un cultivo en agua de mar












 uBio
uBio 


