INTRODUCCIÓN
En el Perú, la crianza de ovinos esta difundida en las tres regiones naturales, Costa, Sierra y Selva, debido a su capacidad de adaptación a diferentes climas, siendo de mayor importancia en la zona altoandina entre los 3000 y 4200 msnm (Aliaga, 2012). Esta práctica genera ingresos y empleo a más de un millón de familias campesinas, quienes la integran con otros tipos de crianzas como la de vacunos y camélidos (Díaz, 2007; Aliaga, 2012; Ramírez, 2012).
La crianza de los ovinos en el país es considerada como un sistema con inversión cero o nula y de bajos rendimientos, que solo resulta rentable en explotaciones pecuarias mega-dimensionadas. Esta situación se vio influida por la disminución del precio internacional de la lana gruesa y media, falta de dinamismo de la industria para adaptarse a los cambios de mercado, falta de innovación en sistemas productivos, y depredación de las pasturas naturales y mal manejo de los recursos hídricos (Vivanco, 2012; Ramírez, 2012).
La nematodiasis gastrointestinal (gastroenteritis verminosa) es una parasitosis de gran repercusión en la rentabilidad de las explotaciones pecuarias, siendo una de las principales causas de pérdidas económicas en la producción ovina (Lacasta et al., 2008). Afecta el crecimiento de los animales, pérdida de peso, baja digestibilidad y anemia, conllevando a una baja eficiencia productiva (Radostis et al., 1999; Bikila et al., 2013; Muluneh et al., 2014). Asimismo, el uso inapropiado de antiparasitarios ocasiona fallas en la eficacia de los antihelmínticos y conlleva al desarrollo de resistencia (Soulsby, 1987; Kassai, 2002; Steffan et al., 2012).
El parasitismo gastrointestinal se encuentra distribuido a nivel mundial afectando la economía de los ganaderos y de las familias campesinas. Así, estudios realizados en Brasil reportaron prevalencias de nemátodos gastrointestinales del 50.3% (Da Silva et al., 2010) y en Venezuela de 43.6% de infecciones por estróngilos (Quijada et al., 2006). En Colombia, Bolivia, y México se han reportado prevalencias de 97.7% (Ensuncho-Hoyos, 2014), 90% (Rodríguez, 2004) y 77.6% (Rojas et al., 2007), respectivamente. Estudios en el país sobre gastroenteritis verminosa en ovinos indican prevalencias de 35 a 83% en la Región Tacna (Condori et al., 2017) y 75% en la SAIS Túpac Amaru Región, Junín (Cabello, 2007).
El objetivo del presente estudio fue determinar la frecuencia de nematodos gastrointestinales presentes en ovinos de tres distritos de la región de Ancash; así como, evaluar su asociación con las variables edad, sexo y procedencia. Además, establecer el promedio de carga parasitaria e identificar los géneros y/o especies de nematodos presentes.
MATERIALES Y MÉTODOS
Lugar de Estudio
El estudio se desarrolló entre agosto y setiembre de 2017 en los distritos de Yungay (2458 msnm), Caraz (2285 msnm) y Pampas (3180 msnm), pertenecientes a las provincias de Yungay, Huaylas y Pallasca, respectivamente, departamento de Ancash, Perú. La temperatura máxima/mínima y las precipitaciones esporádicas fueron de 24/4 °C y 8 mm en Caraz, 25/8.4 °C y 14 mm en Pampas y 23/10 °C con 10 mm en Yungay (SENAMHI, 2017). Los distritos fueron seleccionados por las facilidades y preocupación de los municipios de establecer planes de control contra el parasitismo gastrointestinal.
Población y Muestra
La población de ovinos en el departamento de Ancash era de 24 653 animales según el IV Censo Nacional Agropecuario (INEI, 2012). Para determinar el número de ovejas a ser muestreadas, se utilizó la fórmula de poblaciones finitas (Daniel, 2007). Se consideró una prevalencia esperada de 75.29% (Condori et al., 2017), con un nivel de confianza del 95% y un error del 5%, obteniéndose una cantidad mínima a muestrear de 286 animales.
Se empleó la fórmula de estratificación (Pérez, 2000) para determinar el número de muestras por comunidad, utilizando la población de ovinos en Yungay (7727), Caraz (3497) y Pampas (13 429) (INEI, 2012), correspondiendo 90, 40 y 156 animales por distrito, respectivamente. Sin embargo, con el apoyo voluntario de los pastores residentes de la zona de estudio y el apoyo de los municipios, se pudo recolectar 130, 120 y 290 muestras procedentes de Yungay, Caraz y Pampas, respectivamente, dando un total de 540 ovinos.
Se muestrearon de manera aleatoria animales de ambos sexos y de crianza extensiva pertenecientes a diferentes caseríos. Como criterio de inclusión, los ovinos no debieron recibir tratamiento antihelmíntico en los tres meses previos al estudio y como criterio de exclusión no se muestrearon hembras en los últimos meses de gestación, ni animales menores de seis meses.
Las muestras fecales (10 g) se tomaron directamente del recto y fueron almacenadas en recipientes térmicos con geles refrigerantes para su trasladado al Laboratorio de Parasitología de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos, Lima, para su procesamiento, dentro de los cinco días de su colección.
Análisis Coproparasitológico
Se utilizó la técnica de flotación de Sheather para determinar, de manera cualitativa, la presencia de huevos de nematodos. Asimismo, para cuantificar la carga parasitaria o la cantidad de huevos de nematodos por gramo de heces (hpg) se empleó el método de McMaster Modificado (Rojas, 2004; Vignau et al., 2005; Benavides, 2013).
Para la identificación de las especies de nematodos se realizó un coprocultivo con las muestras fecales que presentaron huevos tipo Strongylus, obteniéndose las larvas de tercer estadio mediante los métodos de Corticelli y Lai Modificado; Baermann (Niec, 1968, Benavides. 2013). La identificación se basó en claves internacionales en función a características larvarias como presencia o ausencia de vaina de la segunda muda, aspecto de la cavidad oral o esófago, número de células intestinales, forma y tamaño según la medición del largo total de la larva y el largo de la cola de la cubierta (Niec, 1968; Vignau et al., 2005; Zajac y Conboy, 2012) a través de la captura digital y procesamiento de imágenes utilizando el programa Leica Application Suite v. 4.0.
Análisis Estadístico
Se calculó la frecuencia total de nematodos y la media geométrica de los hpgsegún las variables edad (<1 año, >1 año), sexo y procedencia (distritos); con sus respectivos intervalos de confianza al 95%. Se realizó la prueba de Chi cuadrado para evaluar la asociación (p<0.05) entre la frecuencia de nematodos y las tres variables (Daniel, 2007). Asimismo, se halló la frecuencia de cada tipo de huevo de nematodo con sus respectivos intervalos de confianza al 95% y se evaluó su asociación con las tres variables mediante la prueba de Chi cuadrado (p<0.05).
La relación entre la carga parasitaria con las variables sexo y edad fue determinada mediante la prueba no paramétrica de Mann Whitney para la variable procedencia por la prueba de Kruskal Wallis (Daniel, 2007). Además, se determinó la frecuencia de géneros y/o especies de larvas infectivas (L3) según los distritos de procedencia. Todos los análisis se realizaron empleando el programa Stata/IC 15.0 (Stata Corp, College Station, TX).
RESULTADOS
El 79.1% de los ovinos evaluados en los tres distritos de Áncash resultaron positivos a una o más especies de nematodos. La prueba de Chi cuadrado no encontró diferencia significativa entre las variables evaluadas (edad, sexo y procedencia) con la frecuencia de nematodos (Cuadro 1). Las frecuencias de huevos de nematodos tipo Strongylus y Nematodirus spp fueron de 79.1 y 25.1%, respectivamente. Solo se encontró asociación (p=0.009) entre la presencia de huevos de Nematodirus spp y la variable procedencia (Cuadro 2).
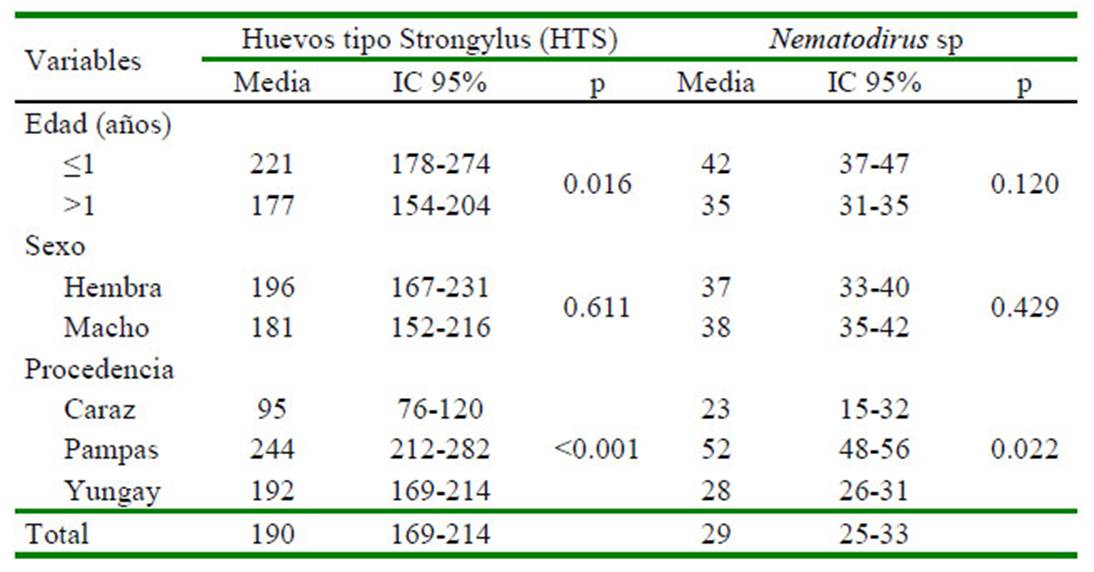
La media geométrica de las cargas parasitarias de ovinos positivos a huevos tipo Strongylus (HTS) y Nematodirus spp fue de 190 y 29 hpg, respectivamente. Se halló asociación significativa (p=0.016) entre la variable edad y la carga parasitaria de huevos tipo Strongylus, así como entre la variable procedencia con la carga de huevos tipo Strongylus (p<0.001) y con la carga de huevos de Nematodirus spp (p=0.022) (Cuadro 3).
En el cultivo de larvas de se encontró 80.4, 11.4 y 8.2% de larvas infectivas (L3) correspondientes a Trichostrongylus sp, Haemonchus contortus y Oesophagostomum sp, respectivamente (Figura 1). La frecuencia por distrito se presenta en el Cuadro 4.
DISCUSIÓN
Las alteraciones generadas por nematodos conllevan a una disminución de la producción en los animales afectados; siendo considerada como una de las enfermedades que genera mayores pérdidas económicas en la producción de rumiantes menores (Rojas, 2004; Lacasta et al., 2008). En el presente estudio, se halló una alta frecuencia 879.1%) de nemátodos gastrointestinales en ovinos criados de forma extensiva en tres distritos de Ancash, resultado concordante a los reportados en otros países de América (Rodríguez et al., 2004; Rojas et al., 2004; Ensuncho-Hoyos, 2014) y del país (Cabello, 2007, Condori et al., 2017).
Cuadro 1 Frecuencia de nemátodos en ovinos, según edad, sexo y procedencia de tres distritos de Áncash, Perú (2017)
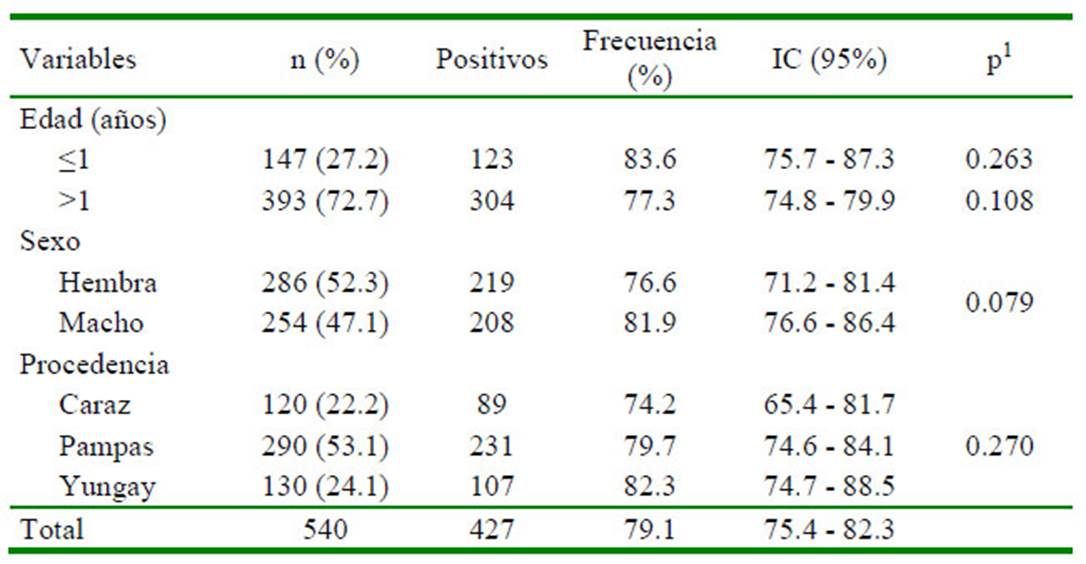
1 Prueba de Chi cuadrado
Cuadro 2 Frecuencia de tipos de huevos de nemátodos en ovinos (n=540) de tres distritos del Áncash, Perú (2017)
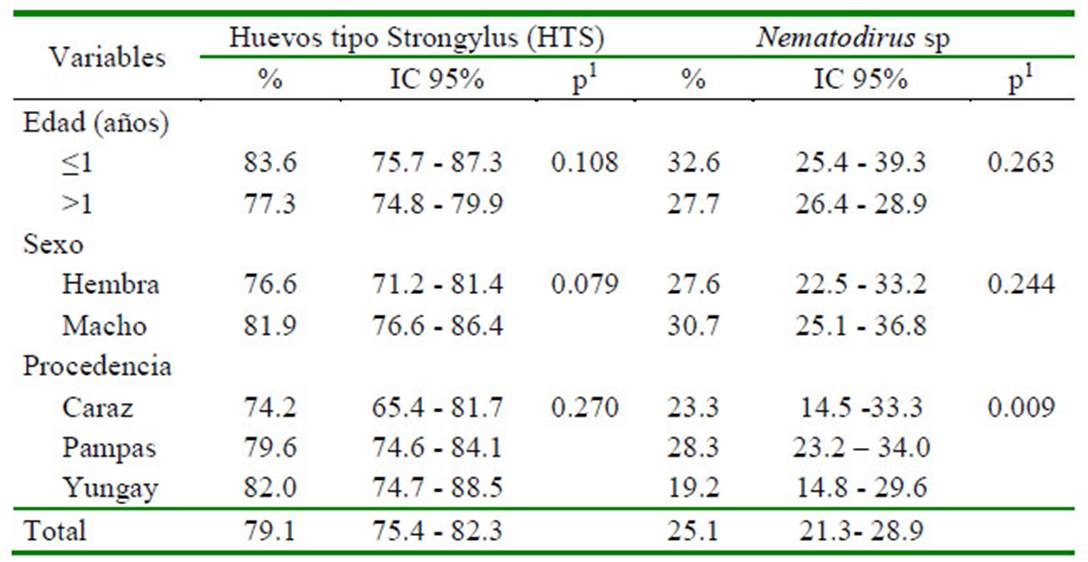
1 Prueba de Chi cuadrado
Cuadro 3 Media geométrica de la carga parasitaria de ovinos positivos a huevos tipo Strongylus (HTS) y Nematodirus sp, de tres distritos del Áncash, Perú (2017)
Cuadro 4 Porcentaje de distribución de los géneros y/o especie de larvas infectivas (L3) en muestras de heces de ovinos de tres distritos del Áncash, Perú, con altas cargas de huevos tipo Strongylus
| Especie de larva infectiva (L3) | Procedencia (%) | Total (%) | ||
| Caraz | Pampas | Yungay | ||
| Haemonchus contortus Oesophagostomum sp Trichostrongylus sp | 14 7 79 | 28 30 42 | 14 8 78 | 11.4 8.2 80.4 |
El estudio de Ames (1967) en la provincia ancashina de Recuay reportó una prevalencia de 96.26% en ovinos mediante el recuento diferencial de parásitos post mortem. Estudios adicionales en la zona no han sido reportados según conocimiento de los autores. Si bien los resultados de dicho estudio no pueden ser contrastados con los del presente estudio, dadas las metodologías empleadas para determinar la prevalencia, los valores obtenidos indicarían que la presencia de los parásitos gastrointestinales en ovinos de Ancash continúa siendo elevada.
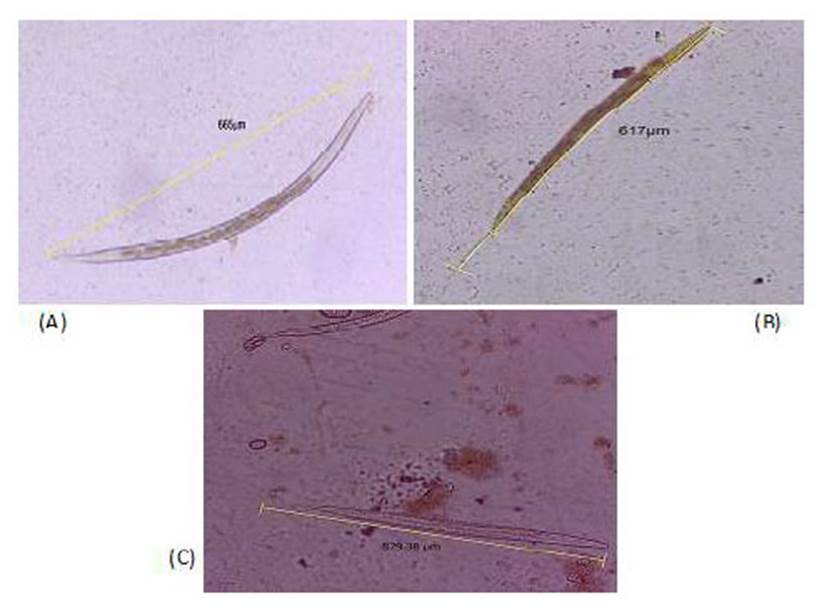
Figura 1 (A) Larva L3 infectiva de Trichostrongylus sp. Región posterior con vaina corta y achatada; (B) Larva L3 infectiva de Haemonchus contortus. Región posterior, vaina mediana y termina en prolongación filamentosa; (C) Larva L3 infectiva de Oesophagostomum sp. Región posterior, vaina muy larga y filamentosa
Diversos estudios reportan que la infección por nemátodos en ovinos estaría influenciada por múltiples factores relacionados al hospedero, parásito y medio ambiente, tales como la edad, tipo de manejo, potencial biótico y diferencias climáticas, entre otros (Rojas, 2004; Roeber et al., 2013; Taylor et al., 2016). En el presente estudio no se encontró una asociación significativa entre la frecuencia de nematodiasis con las variables edad, sexo y procedencia; no obstante, se reconoce que animales menores de un año son más susceptibles a la parasitosis gastrointestinal debido a su sistema inmune inmaduro (Radostis, 1999; Taylor et al., 2016), sucediendo de igual manera en hembras adultas gestantes por la depresión inmune periparto (Cordero del Campillo y RojoVázquez, 1999; Da Silva et al., 2010). En este estudio no se hallaron estas diferencias, probablemente, porque no se trabajó con ovinos menores de seis meses ni con hembras gestantes, debido al rechazo de los criadores para muestrear estos animales por temor a causarles daño en la toma de muestra.
La ausencia de asociación significativa entre la frecuencia de parásitos gastrointestinales con el distrito de procedencia se debió, probablemente, a la similitud en el manejo y tipo de crianza extensiva llevado a cabo por los criadores de la zona, quienes pastorean en forma conjunta, tanto animales jóvenes como adultos, contribuyendo a la transmisión en los jóvenes libres de infecciones (Taylor et al., 2016). Factores adicionales para las altas cargas parasitarias encontradas se debería a que el ovino corta el pasto cerca del suelo posibilitando una mayor ingesta de estadios larvarios infectivos (Kanyari et al., 2009) y a las condiciones de malnutrición debido a la mala calidad de pasturas (Dos Santos, 2008; Pala, 2011).
La mayor frecuencia de huevos tipo Strongylus (79.1%) que Nematodirus spp (25.1%) podría deberse a las condiciones climáticas de la zona, la hipobiosis y la capacidad biótica relacionado al factor parásito (Taylor et al., 2016). La temperatura ambiental de la zona (18-24 °C) con precipitaciones pluviales esporádicas, que fueron incrementando debido a que el muestreo se dio durante la transición de época seca a lluviosa (SENAMHI, 2017), favorece la actividad metabólica de los nemátodos con huevos tipo Strongylus (HTS), generando el desarrollo de las forma infectiva (L3), debido a que este proceso requiere de temperaturas en promedio mayores a 15 °C (Rojas, 2004, Ghalsasi et al., 2015). Estas larvas, luego de ser ingeridas por los rumiantes inician su fase actividad parásita ya sea en el abomaso (Haemonchus contortus), intestino delgado (Trichostrongylus sp) o grueso (Oesophagostomum sp).
Asimismo, las hembras de los nematodos encontrados presentan un alto potencial biótico. Así, Trichostrongylus sp con 100200 huevo/día, Oesophagostomum sp con 3000 huevos/día y Haemonchus contortus con 5000-10000 huevos por día (Ueno y Gonçalves, 1998), mientras que Nematodirus sp presenta un menor potencial biótico (50100 huevos por día) y necesitan un mayor tiempo para el desarrollo de las larvas infectivas dentro del huevo. Además, algunas especies de Nematodirus sp requieren cambios bruscos de temperaturas (noches frías seguidos de días cálidos) para facilitar la eclosión de los huevos, por lo que su número generalmente suele ser mayor en la época seca (Rojas, 2004).
Las condiciones medioambientales y el potencial biótico indicado explicarían la baja carga parasitaria encontrada (Ueno y Gonçalves, 1998; Maichomo et al., 2004), habiéndose encontrado promedios geométricos de 190 y 29 hpg para el tipo Strongylus y Nematodirus sp, respectivamente. Estos resultados son concordantes con los hallados por Lupaca (2017) y Condori et al., (2017) en Tacna (754 hpg y 133 hpg tipo Strongylus, respectivamente) en comparación con cargas de 178 hpg y 133 hpg de Nematodirus spp, respectivamente. Las diferencias significativas observadas entre la media geométrica de la carga parasitaria, respecto a la edad y procedencia, no representarían diferencias biológicas de importancia, dado que las cargas halladas fueron bajas. De otra parte, la mayor carga parasitaria en los ovinos de Pampas podría deberse al mayor número de animales muestreados en ese distrito en comparación los otros dos distritos.
La alta frecuencia de larvas L3 de Trichostrongylus spp (80.4%), seguido de una menor frecuencia de Haemonchus contortus (11.4%) y Oesophagostomum spp (8.2%), fueron relativamente similares a los resultados obtenidos por Ames (1967) en el distrito de Recuay, Áncash (Trichostrongylus sp: 51.4% y Oesophagostomum sp: 27.3%), aunque no reportaron H. contortus, debido a que ese distrito presenta un clima muy frío (5 °C) y seco, no ideal para el desarrollo de este nematodo (O’Connor et al., 2006). Del mismo modo, la baja frecuencia de Oesophagostomum sp en el presente estudio podría explicarse por la época de muestreo, ya que agosto es un mes muy frío, con temperaturas promedio de 5 °C y en el mes de septiembre recién se inicia el incremento de la temperatura en la zona del estudio, entendiéndose que este nematodo requiere temperaturas mayores (20-22 °C) (O’Connor et al., 2006).
CONCLUSIONES
La frecuencia de nemátodos gastrointestinales en ovinos de tres distritos del departamento de Áncash fue de 79.1% con un intervalo de confianza al 95% de 75.4 82.3%, sin encontrar asociación significativa con las variables procedencia, sexo y edad.
Se hallaron huevos tipo Strongylus y Nematodirus sp con frecuencias de 79.1% (IC 95%: 75.4-82.3%) y 25.1% (IC al 95%: 21.3-28.9%), respectivamente, y con medias geométricas de cargas parasitarias bajas de 190 hpg (169-214 hpg) y 29 hpg (25-33 hpg), respectivamente.
Se identificaron larvas infectantes L3 de Haemonchus contortus (11.4%), Oesophagostomum sp (8.2%). y Trichostrongylus sp (80.4%).












 uBio
uBio 

