INTRODUCCIÓN
Los microplásticos (MP) son partículas sólidas sintéticas o de matriz polimérica, de forma regular o irregular, menores a 5 mm e insolubles en agua (Frias y Nash, 2019). Estas partículas resultan de la liberación directa de plásticos, de pellets de diferentes tamaños utilizados para diversos fines en productos de cuidado personal, agentes de limpieza, cosméticos, etc. (Barboza et al., 2019; Bucol et al., 2020). Los MP pueden ser productos de un proceso de fragmentación lenta generado por energías mecánicas y radiación solar que ocurren en el ambiente (Auta et al., 2017; Pozo et al., 2019). Durante la degradación del MP, se pueden liberar sustancias químicas que generan un impacto negativo en los organismos y ecosistemas al cual están expuestos (Royer et al., 2018; Bucol et al., 2020).
La presencia de MP en diferentes ecosistemas del planeta son de preocupación mundial debido a la contaminación que generan al medio ambiente, especialmente al ambiente marino (GESAMP, 2016), dado que se encuentran desde las aguas superficiales hasta el lecho marino y desde zonas costeras hasta los polos (Bergmann et al., 2017; Cincinelli et al., 2017; Maes et al., 2017; Mu et al., 2019; Savoca et al., 2019). Dichas partículas por su pequeño tamaño y densidad relativamente baja contribuyen a su transporte (Cózar et al., 2017; Barboza et al., 2019) y distribución mundial (Cózar et al., 2014; Suaria et al., 2016; Auta et al., 2017), pudiendo permanecer durante muchos años en el ambiente (Strungaru et al., 2018; Barboza et al., 2019) posibilitando la contaminación de una amplia variedad de organismos acuáticos, incluidas especies utilizadas comúnmente en la dieta humana (Gallo et al., 2018; Barboza et al., 2018).
El conocimiento de los posibles efectos de los MP sobre la biota marina se ha incrementado durante la ultima década (Cole et al., 2011; Barboza et al., 2019). La presencia de estas partículas de MP puede afectar a los seres vivos de diversas formas, principalmente: a) al ser ingeridos, b) transferirse a lo largo de la cadena trófica e c) interaccionar en la incorporación de otros contaminantes (Codina-García et al., 2013). La ingestión de desechos plásticos puede causar lesiones internas y bloqueo del tracto gastrointestinal (Lönnstedt y Eklöv, 2016), además de interferir con la mecánica de alimentación (Wang et al., 2019, 2020a). Los riesgos toxicológicos a través de la transferencia de la cadena alimentaria y la bioacumulación puede representar un peligro para los seres humanos (Bucol et al., 2020).
Un amplio espectro de organismos marinos, tales como los corales, moluscos, peces, aves, tortugas e incluso cetáceos, pueden ingerir MP, o bien incorporarlos mediante la ingesta de presas (Anderson et al., 2016; Bucol et al., 2020). McGoran et al. (2017) mencionan que la cantidad de MP encontrados en el tracto digestivo de peces de ambientes acuáticos es elevada; sin embargo, Davison y Asch (2011) encontraron en una incidencia de 9.2% de MP en el tracto digestivo de 114 peces mesopelagicos; por lo que se deduce que la ingestión de MP por peces se encuentra influenciada por diversos factores, incluido el nivel de contaminación de MP local, la estrategia de alimentación de cada especie de pez y otros factores ambientales (Romeo et al., 2015; Battaglia et al., 2016; Bucol et al., 2020; Wang et al., 2020a,b).
En el Perú se tiene pocos estudios de MP relacionado al ambiente marino. Por ejemplo, en bivalvos (De-la-Torre et al., 2019b, Valencia-Velasco et al., 2020), arena de playas marinas (Purca y Henostroza, 2017; Iannacone et al., 2019; De-la-Torre et al., 2020) y en peces (Ory et al., 2018; De-laTorre, 2019a).
El objetivo de este estudio fue evaluar los MP en peces marinos, Sciaena deliciosa (Tschudi, 1846) (Sciaenidae) «lorna», Isacia conceptionis (Cuvier, 1830) (Haemulidae) «cabinza», Scartichthys gigas (Steindachner, 1876) (Blenniidae) «borrachito», Mugil cephalus (Linnaeus, 1758) (Mugilidae) «lisa» y Scomber japonicus (Houttuyn, 1782) (Scombridae) «caballa» de importancia económica en Lima, Perú.
MATERIALES Y MÉTODOS
Área de Estudio y Peces
Los peces fueron adquiridos semanalmente entre enero y febrero de 2019 de tres vendedores por fecha del terminal pesquero de Villa María del Triunfo (Lima), Perú. Se consiguieron 100 ejemplares de peces marinos de importancia económica, distribuidos en 20 individuos por especie: S. deliciosa «lorna», I. conceptionis «cabinza», S. gigas «borrachito», M. cephalus «lisa» y S. japonicus «caballa». Los especímenes fueron transportados al laboratorio en contenedores con geles de refrigeración (-20 °C) para su evaluación. Los peces fueron calificados según su hábitat, rol trófico y profundidad en armonía con la información disponible (Stergiou y Karpouzi, 2002; Hayden et al., 2019; Froese y Pauly, 2020).
Extracción de Órganos
Se obtuvieron medidas morfométricas de cada uno de los peces, tales como talla en base a la longitud total LT (cm) y el peso (g). Se extrajo el tracto digestivo y las branquias. El tracto digestivo se cortó longitudinalmente en secciones de 2 cm y se vertió en viales rotulados para su almacenamiento en refrigeración a -20 °C y posterior procesamiento para la obtención de MP (Bucol et al., 2020).
Microplásticos
Se siguió el protocolo establecido por Lusher y Hernandez-Milian (2018) con modificaciones, en el proceso de filtración. El área de trabajo fue limpiada con etanol al 70% filtrado con un papel filtro de 2.5 µm de porosidad (Whatman grado 42). Se utilizaron guantes de nitrilo y se emplearon materiales de vidrio o metal para evitar la contaminación de MP. El agua utilizada para el lavado de las muestras y preparación de reactivos fue filtrada con papel filtro de 2.5 µm de porosidad.
Para la digestión de las muestras se utilizó una solución de KOH al 10%, previamente filtrada (2.5 µm), en una proporción de 4:1 (KOH: muestra). Las muestras fueron incubadas a 60 °C durante 24 h con agitación continua a 45 rpm. Terminada la digestión se procedió a filtrar con una bomba de vacío usando un filtro de porosidad de 6 µm WhatmanTM N.° 3. Finalmente, el filtro fue secado a 60 °C.
Para la caracterización visual de MP se siguió los criterios de Lusher et al. (2013, 2016). Se tomaron registros numéricos de abundancia de la forma (fibra «plástico delgado o fibroso, y recto», fragmento «partícula de plástico duro e irregular», film «plástico endeble plano y delgado» o pellet «partícula de plástico duro y redondeado») (Sruthy y Ramasamy, 2017) y color (azul, fucsia, verde, negro y blanco). Se utilizó un estereoscopio y microscopio para inspeccionar visualmente cada papel filtro, y se tomó registro fotográfico de lo encontrado.
Análisis Estadístico
Se determinó el grado de asociación mediante el coeficiente de correlación de Pearson (r s) y Spearman (rp ) entre la LT y peso del pez vs el número de ítems de MP por especie de pez evaluado. Previamente se verificó la normalidad con las pruebas de Shapiro-Wilk (n<50) y la prueba de Homogeneidad de Varianzas de Levene; seleccionando asi, la correlación de tipo paramétrica (Pearson, rp ) o no paramétrica (Spearman, rs ) adecuada. Para determinar si hay diferencias entre las especies estudiadas con relación a la cantidad de MP en el tracto digestivo y en las branquias, la LT y el peso, fue empleada la prueba de Kruskall-Wallis (H) con su estadístico Tukey, el cual determinó el nivel de diferencias entre las cinco especies de peces marinos. Fue utilizada la prueba de t de Student para comparar el número de ítems de MP de tracto digestivo, branquias, LT y peso con relación al sexo por cada especie de pez. Para todo el proceso de datos se empleó el paquete estadístico Statistical Package for the Social Sciences (SPSS) v. 22 para Windows 10. Se calculó para todos los casos un valor de significancia de alfa de 0.05.
RESULTADOS
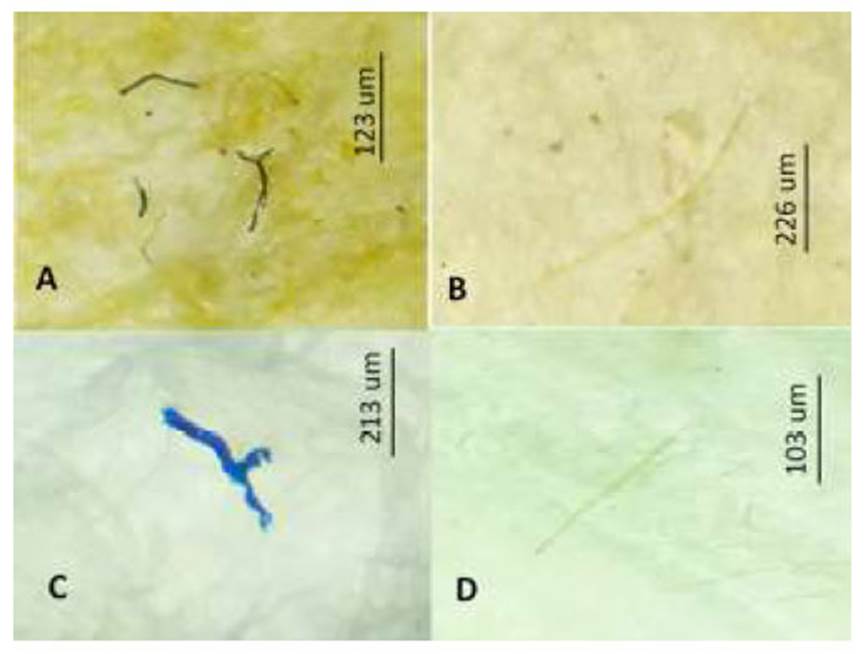
Los datos biométricos de los peces y la cantidad total de MP encontrados en el tracto digesivo y branquias por especie se muestran en el Cuadro 1. Se notó la presencia de MP en el 100% de los peces. Se observaron diferencias entre las medidas biométricas de los peces, siendo la LT y el peso de S. japonicus y M. cephalus mayores que las otras tres especies ícticas. Con relación a los MP encontrados en el tracto digestivo, S. gigas presentó valores mayores que I. conceptionis y M. cephalus, y estos a su vez fueron diferentes a S. deliciosa y S. japonicus. No se observaron diferencias en la cantidad de MP registrados en las branquias entre especies (Cuadro 1).
El Cuadro 2 muestra una correlacion positiva entre la talla de I. conceptionis y MP de tracto digestivo/pez. De igual manera se vio una asociación positiva entre el peso p s de M. cephalus y los MP del tracto digestivo/pez. Para el resto de las peces no se vio asociación entre la talla y el peso, y los MP del tracto digestivo/pez. Tampoco se vio asociación entre la talla y el peso y MP de las branquias/pez. Asimismo, tampoco hubo diferencia significativa al comparar los peces por sexo dentro de especie entre las partículas de MP por tracto digestivo y branquias, LT y peso (Cuadro 3).
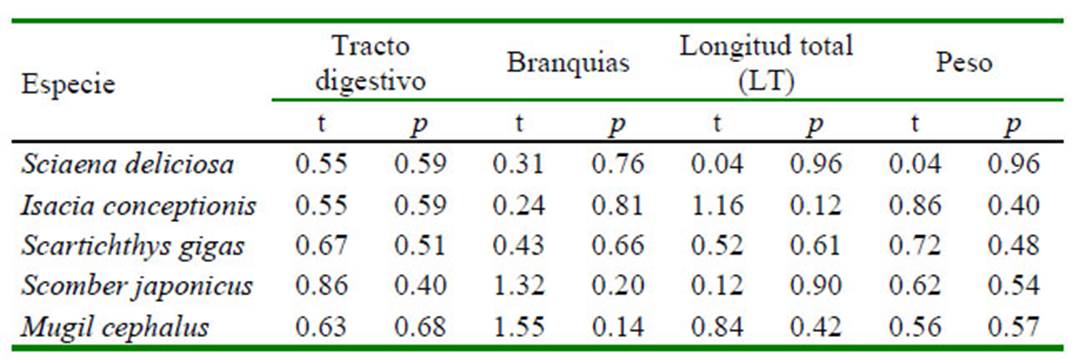
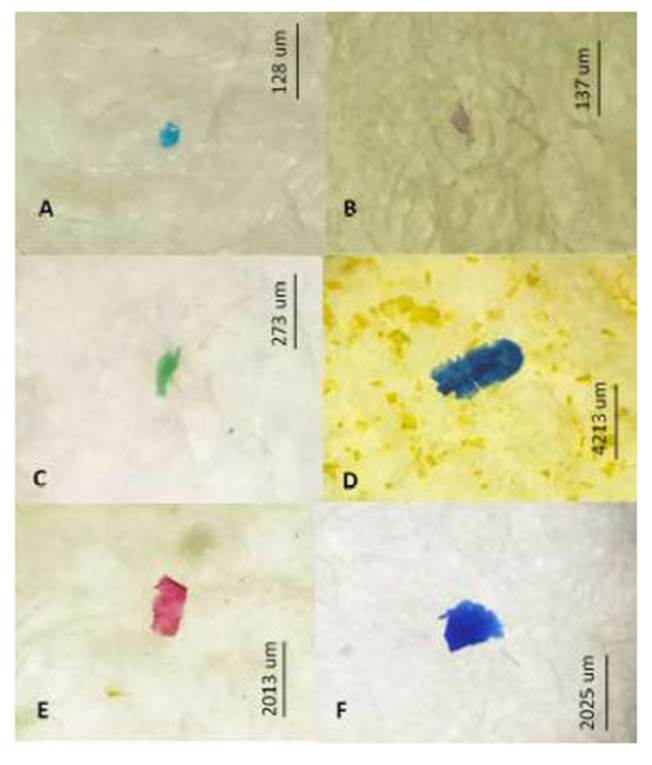
El Cuadro 4 señala que a nivel del tracto digestivo, el MP azul, negro y blanco fueron los tres colores dominantes en las cinco especies de peces marinos. De igual forma, los MP azul, negro y fucsia en las branquias fueron los colores más abundantes en las cinco especies ícticas. En el Cuadro 5 se observa una mayor abundancia de fibra, seguida de fragmento, film y pellet por especie de pez a nivel del tracto digestivo. En el caso de las branquias el único tipo de MP presente fue la fibra. Fotografías representativas de los colores de MP por forma fibra, fragmento y film son mostrados en las Figura 1 , Figura 2, Figura 3
Cuadro 1 Datos ecológicos, biométricos y cantidad de microplástico (MP) en peces marinos de importancia económica en Lima, Perú
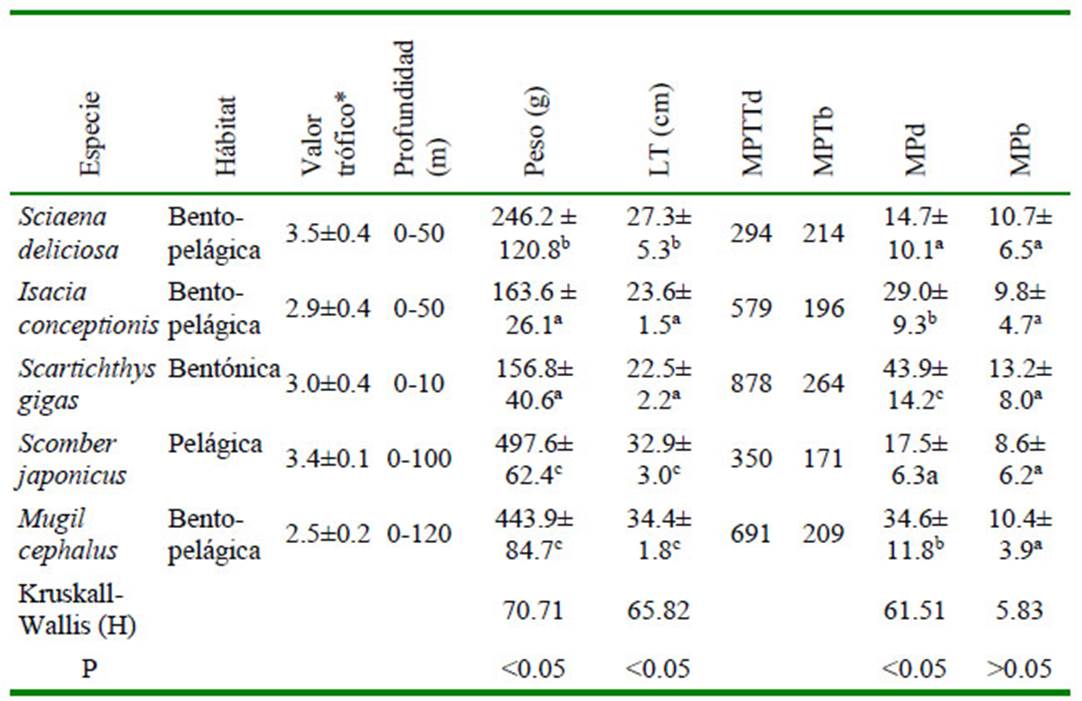
(± DE): Desviación estándar, LT: Longitud total del pez, MPTtd: Microplástico total de tracto digesivo, MPTb: Microplástico total de branquias, MPd: Promedio de MP de tracto digestivo,
MPb: Promedio de MP de branquias
p=significancia. *=valor trofico según lo señalado por Froese y Pauly (2020) en base a lo propuesto por Stergiou y Karpuzi (2002) y Hayden et al. (2019)
Los valores del valor trófico entre >2.1 y <2.9 indican que es una especie onmívora con preferencias por material vegetal y entre >2.9 y <3.7 señalan que es una especie onmívora con preferencias por material animal
Cuadro 2 Correlación de Pearson (r) entre cantidad de microplásticos (MP) vs longitud total (LT) y peso en peces marinos de importancia económica en Lima, Perú
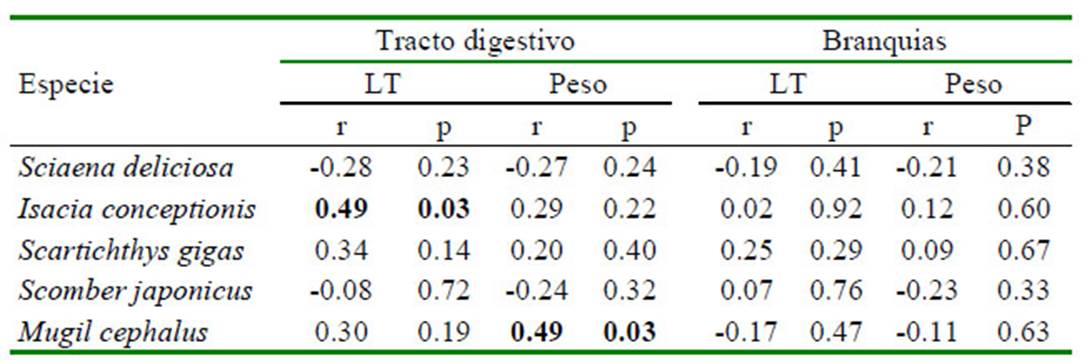
p=significancia. Valores en negrita señalan asociación entre las variables (p<0.05)
DISCUSIÓN
Todos los peces, independientemente de sus hábitos de alimentación, presentaron MP en el tracto digestivo y en las branquias. De las cinco especies ícticas, S. gigas fue la que presentó más partículas de MP en el tracto digestivo, seguido por M. cephalus, I. conceptionis, S. japonicus y S. deliciosa. Para explicar las cantidades de MP halladas en los tractos digestivos debe considerarse como factores importantes parámetros bioecológicos como el hábitat, el rol trófico en los peces evaluados y la profundidad en el medio marino (Cheung et al., 2018; De-la-Torre et al., 2019a; Bucol et al., 2020; Pereira et al., 2020; Weis, 2020). El valor trófico según Froese y Pauly (2020) con base a lo señalado por Stergiou y Karpuzi (2002) y Hayden et al. (2019) no mostró un patrón claro con relación a la cantidad de MP observada. Así, S. gigas e I. conceptionis consideradas onmívoras con preferencias por material animal y M. cephalus como una especie onmívora con preferencias por material vegetal fueron las que presentaron mayores cantidades de MP/pez. En el caso de S. gigas, el hábitat bentónico rocoso y una preferencia a ambientes de menor profundidad (0-10 m) y cercanos al ambiente urbano de la ciudad de Lima parecen explicar la presencia de una mayor cantidad de MP/pez.
La mayoría de las especies de peces de este estudio tienen un habitat arenoso-rocoso poco profundo y cercanos a las playas al ser bentónicas y bentopelágicas, a excepción de S. japonicus que es pelágica (Froese y Pauly, 2020). Se podría deducir entonces que la cantidad de partículas de MP presentes en el tracto digestivo y branquias pudiera estar relacionada con la proximidad a las zonas urbanas del ecosistema marino (Peters y Bratton, 2016; Murphy et al., 2017; Halstead et al., 2018).
La variación en las tasas de ingestión parece estar altamente relacionada con la disponibilidad de MP en el medio ambiente, que se ve afectada por factores como la profundidad, distancia a la costa o urbanización del área (De-la-Torre et al., 2019ab; Bermúdez-Guzmán et al., 2020). Bråte et al. (2016) concluyen que los peces que tienen hábitos lejanos a las zonas rocosas o playas presentan menor cantidad de MP en comparación con los que se encuentran cercanos al ambiente rocoso. Esto podría explicar que la especie pelágica S. japonicus haya presentado la menor cantidad de MP/pez. De otra parte, Lusher et al. (2013, 2016) evidencian que el número de MP por individuo va de 0 a 21 en los peces marinos examinados, resultados menores a los del presente estudio donde el número de MP encontradas en el tracto digestivo varia entre 14.70 a 43.90 MP/pez.
La relación de peso y LT de los peces con la cantidad de MP en el tracto digestivo no resultó ser significativa para la mayoría de las especies. Solo se observó una correlacion positiva entre la LT de I. conceptionis y los MP del tracto digestivo/ pez. De igual manera, se vio una asociación positiva entre el peso de M. cephalus y MP del tracto digestivo/pez. Estos resultados concuerdan con otros estudios (Phillips y Bonner, 2015; Calderón y Hansen, 2018), en los cuales no se encontró una correlación significativa entre estas variables con la presencia de MP. Pazos et al. (2017), de otra parte, obtuvieron asociación entre estas dos variables con los MP en tracto digestivo.
La relación entre LT y peso de los peces con la cantidad de MP en branquias no fue significativa. Algunos autores señalan que una mayor cantidad de MP en branquias en peces de menor tamaño podría explicarse porque estos realizan una mayor tasa de respiración (Au et al., 2017) y, en consecuencia, una mayor filtración de agua potencialmente contaminada con MP, lo que aumentaría la probabilidad de acumulación de MP (Weis, 2020). Sin embargo, las especies evaluadas en el presente estudio no mostraron una relación entre las medidas biométricas con el número de partículas de MP/branquia. Tampoco se observó diferencias entre hembras y machos, resultado similar al obtenido por Parton et al. (2020).
McNeish et al. (2018) mencionan que la estrategia de alimentación de los peces está relacionada con la transferencia trófica de las partículas de plástico, por lo que estas especies podrían presentar un riesgo para otros organismos de diferentes niveles tróficos, peces de mayor tamaño, aves y mamíferos que se alimentan de otros peces, como S. deliciosa que se alimenta de la anchoveta (Parton et al., 2020; Weis, 2020). Calderón y Hansen (2018) mencionan que probablemente los peces omnívoros con preferencia a alimentos animales tengan una mayor abundancia de partículas MP, lo que coincidiría con este estudio, ya que S. gigas presentó 43.9/pez de MP.
En cuanto a los colores de MP, el más abundante fue el azul, seguido de negro y blanco, fucsia y verde. Algunos autores mencionan que el color de MP estaría relacionado con su composición química o absorción de tóxicos en el mar (Parton et al., 2020; Weis, 2020). Worm et al. (2017) han demostrado que los MP liberan sustancias tóxicas, que incluyen monómeros residuales, plastificantes y agentes colorantes, entre otros aditivos, que pueden ingerirse y producir bioacumulación. Dado que los peces tienen un método de alimentación selectivo, Rummel et al. (2016) y Lusher et al. (2016) sugieren que los MP se pueden asimilar a través de la ingesta de presas contaminadas o al ingerirlos accidentalmente cuando se confunden con alimento (Bucol et al., 2020; Weis, 2020).
El tipo de MP más abundante en las cinco especies, tanto en tracto digestivo como en las branquias, fueron las fibras, lo que se registra en la mayoría de los estudios (Bellas et al., 2016; Neves et al., 2015; Phuong et al., 2016; Pazos et al., 2017; Chan et al., 2019; Parton et al., 2020). Song et al. (2015) sugieren identificar debidamente los MP ya que algunas fibras parecen plásticas, pero en realidad son de algodón.
Cuadro 4 Cantidad de partículas de microplásticos (MP) por colores en peces marinos de importancia económica en Lima, Perú
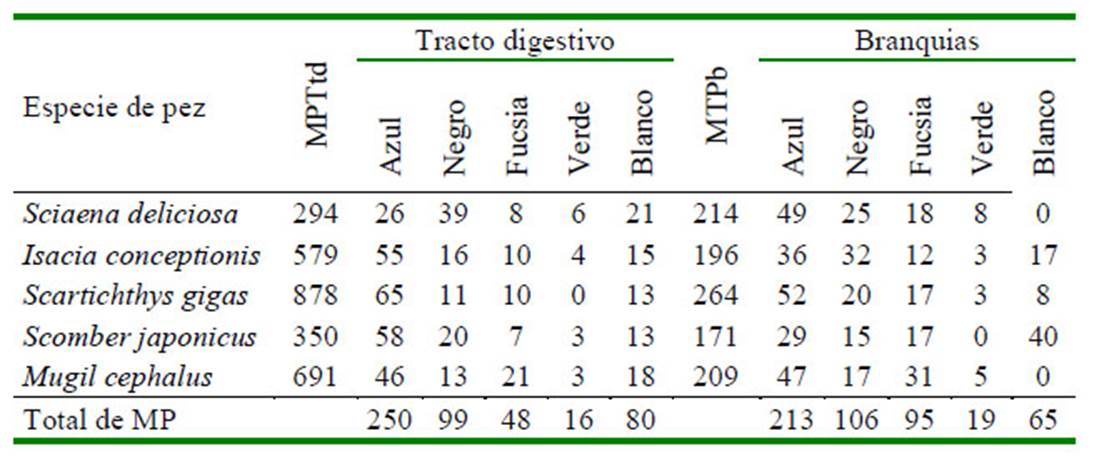
MPTtd: Microplástico total de tracto digesivo, MPTb: Microplástico total de branquias
Cuadro 5 Cantidad de partículas de microplásticos (MP) por forma en peces marinos de importancia económica en Lima, Perú
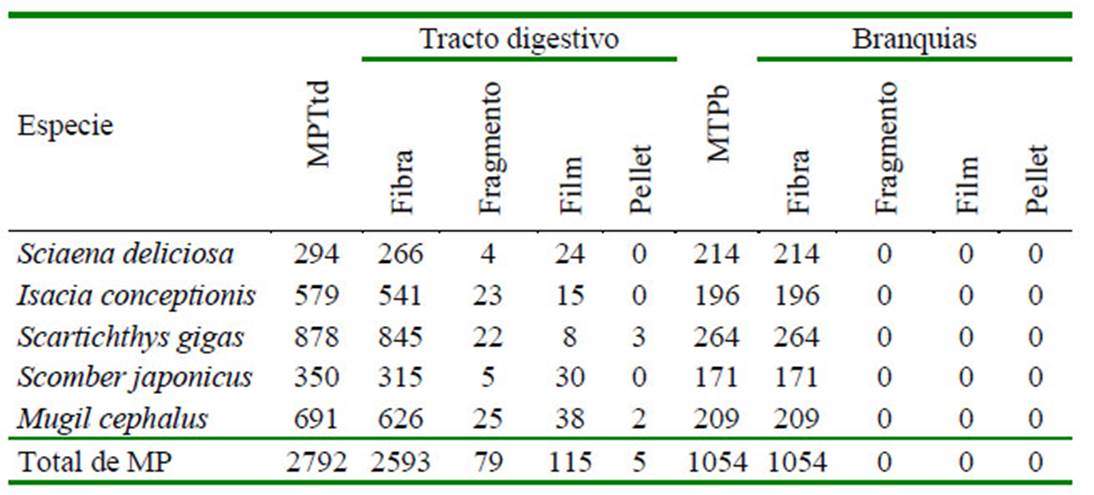
MPTtd: Microplástico total de tracto digesivo, MPTb: Microplástico total de branquias
Las piezas de artes de pesca son una de las fuentes de MP. Los principales artes de pesca que se emplean en Perú para la captura son el boliche (malla de 38 mm) y la cortina (malla de 65 mm) (IMARPE, 2000) que, por acción de fuerza mecánica, rayos solares, fricción, etc., se podrían fragmentar y, así de manera directa, llegar al mar mezclándose con el alimento de los peces (Auta et al., 2017; Pozo et al., 2019; Parton et al., 2020; Wang et al., 2020a).
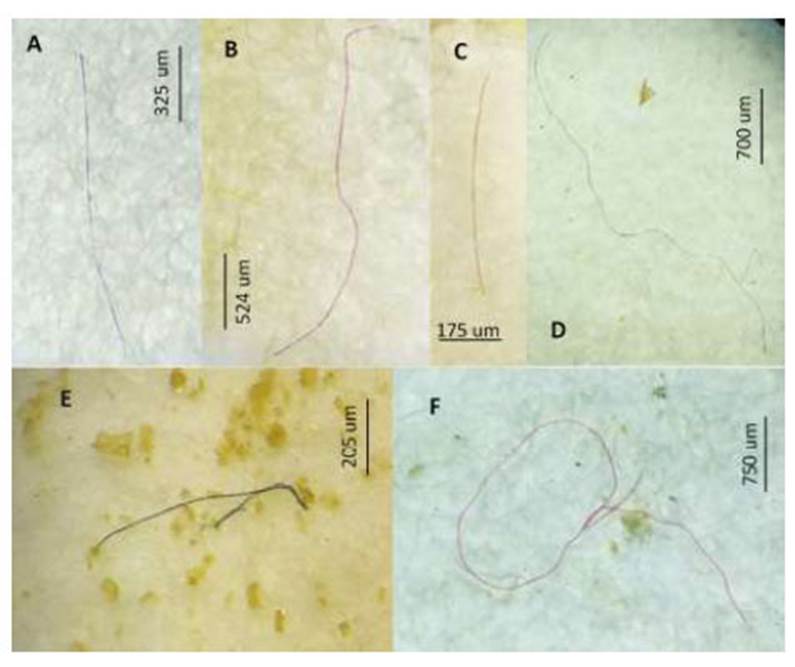
Figura 1 Microplástico de tipo fibra según el color. A: azul, B y F: fucsia, C: Verde, D: blanco, E: negro
Galloway y Lewis (2016) comprobaron que las células y tejidos humanos absorben y filtran los contaminantes químicos relacionados a la ingesta de pescados y mariscos con MP, pero debido a la falta de datos y conocimientos científicos es difícil evaluar el nivel de riesgo para la salud humana. Correia-Prata (2018) ha demostrado que las particulas de MP en el aire generan disnea (dificultad para respirar por inflamación de fosas nasales), algunas personas pueden ser mas sensibles de otras, pudiéndose desarrollar enfermedades respiratorias, anque consideran que la concentración de MP en el ambiente aun son bajos.
CONCLUSIONES
Se observó la presencia de microplásticos (MP) en todos los peces de las cinco especies estudiadas de importancia económica en Lima, Perú (S. deliciosa, I. conceptionis, S. gigas, M. cephalus y S. japonicus).
Los MP se encuentran tanto en el tracto digestivo por el consumo de alimento, como en las branquias por filtración del agua.
Los MP encontrados en el tracto digestivo de S. gigas presentaron valores mayores que I. conceptionis y M. cephalus.
No se observaron diferencias en la cantidad de MP registrados en las branquias para las cinco especies de peces.
Se observó una correlacion positiva entre la longitud de I. conceptionis y MP de tracto digestivo/pez, y entre el peso de M. cephalus y MP del tracto digestivo/pez.
El azul, negro y blanco fueron los tres colores dominantes de los MP en el tracto digestivo y el azul, negro y fucsia fueron los más abundantes en las branquias.
A nivel del tracto digestivo, según el tipo de MP, se encontró una mayor proporción fibra, seguido de fragmentos y film, mientras que en branquias solo se encontraron fibras












 uBio
uBio