INTRODUCCIÓN
La grelina es un péptido acilado liberado principalmente en el estómago de los mamíferos y en el proventrículo del pollo (Kaiya et al., 2008); además, es un ligando endógeno del receptor del secretagogo de la hormona del crecimiento 1a (GHS-R1a) (Kojima et al., 1999). Las células productoras de grelina y la expresión de ARNm del secretagogo R1 de la hormona del crecimiento también han sido detectadas en el cerebro (Kaiya et al., 2008). La grelina actúa sobre el sistema nervioso central (SNC) para regular varias funciones, incluida la actividad del metabolismo y las respuestas al estrés y retención de memoria (Carlini et al., 2004; Kaiya et al., 2008; Spencer et al., 2015).
Diversos estudios demuestran que los efectos de la grelina también podrían involucrar la activación del eje hipotalámico pituitario adrenal (HPA). En los mamíferos, la grelina aumenta los niveles de hormona adrenocorticotrópica (ACTH) y glucocorticoides mediante la activación indirecta de neuronas hipofisiotrópicas de la hormona liberadora de corticotropina (CRH) (Wren et al., 2002; Cabral et al., 2012). Este efecto parece estar relacionado con las respuestas al estrés inducidas por el péptido, pero no con la ingesta de alimentos inducida por grelina (Cabral et al., 2016). En contraste con su efecto estimulante sobre el apetito en los mamíferos, la grelina disminuye la alimentación de los pollitos (Furuse et al., 2001; Gastón et al., 2015, 2017; Oclon y Pietras, 2011), pero no a través de los sistemas GABA-A o NPY (Gastón et al., 2015; Jonaidi et al., 2012; Saito et al., 2005). Debido a que la astressina (un antagonista del receptor de CRH) atenúa el aumento de los niveles plasmáticos de corticosterona inducida por la administración de grelina intracerebroventricular (gcv) (Saito et al., 2005), el sistema de CRH podría mediar la anorexia inducida por grelina en pollos dentro de la primera semana de vida.
En los mamíferos, las redes que controlan la alimentación no solo incluyen el hipotálamo, sino que también pueden estar asociadas con circuitos extrahipotalámicos relacionados con funciones cerebrales superiores (Waterson y Horvath, 2015; Shojaei et al., 2020). En las aves, el hipotálamo tiene un papel central en la regulación de la alimentación (Tachibana y Tsuitui, 2016), aunque hay poca evidencia de que otras áreas del cerebro o posibles circuitos estén involucradas (Singletary et al., 2006). El mesopalio medio e intermedio (MMI) se ha identificado como un sitio cerebral de formación de memoria en pollos (Gibbs, 2008). En la actualidad, esta área del prosencéfalo se considera homóloga a la neocorteza de los mamíferos, y constituye un importante centro de integración que relaciona el sistema sensorial y motor y recibe aferencias de varias regiones cerebrales asociadas a los aspectos motivacionales de la conducta (Bradley et al., 1985; Jarvis et al., 2005; Atoji y Karim, 2014). De hecho, la memoria y la emoción juegan un papel importante en el control de la ingesta de alimentos, con evidencias que indican que una red entre el prosencéfalo e hipotalámico estaría mediando la alimentación (Petrovich, 2011; Sweeney y Yang, 2017). El presente grupo de investigación describió, por primera vez, una disminución de la ingesta de alimento cuando se administra grelina en el área de MMI (grelina intra-MMI) de pollos de 4-6 días de edad (Gastón et al., 2015). Posteriormente, sugirieron que un circuito neural entre el área del prosencéfalo y el eje HPA podría mediar la respuesta al estrés inducida por la grelina intra-MMI (Gastón et al., 2017).
Debido que la grelina central afecta la retención de la memoria, así como la ingesta de alimentos en pollitos dentro de la primera semana de vida (Carvajal et al., 2009; Gastón et al., 2015) y el MMI constituye un posible blanco del SNC para la acción de la grelina, en el presente estudio se analiza si el efecto anorexígeno de la grelina intra-MMI estará involucrando la activación del eje HPA a través del estudio de los niveles plasmáticos de dos hormonas (ACTH y corticosterona) secretadas a distintos niveles de la activación del circuito del HPA. Asimismo, se analiza la relación entre la ingesta de alimentos y los niveles plasmáticos de estas hormonas.
MATERIALES Y MÉTODOS
Animales
Pollos parrilleros (Cobb) (Gallus gallus domesticus) de un día de edad, de ambos sexos (INDACOR, Córdoba, Argentina) se alojaron en una caja de cría de madera (90x40x60 cm), iluminada cenitalmente con una lámpara incandescente dentro de una habitación con temperatura controlada (3032 °C) con ciclos de luz-oscuridad de 12-12h. Los pollitos tuvieron libre disponibilidad de agua y comida con reposición diaria de alimentos (Cargill, parrilleros BB, 20% de proteína cruda mínima y 12.34 MJ/kg), condiciones que se mantuvieron hasta el inicio de los experimentos.
Todos los procedimientos se realizaron de acuerdo con la Guía del National Institute of Health (NIH), EEUU, para el Cuidado y Uso de Animales de Laboratorio y con el Marco Ético de Referencia para las Investigaciones Biomédicas en Animales de Laboratorio, de Granja y Obtenidos de la Naturaleza (CONICET Res. D N° 1047/2005), según lo aprobado por el Comité de Uso y Cuidado Animal (CICUAL) de la Facultad de Ciencias Exactas, Físicas y Naturales, Universidad Nacional de Córdoba. El sufrimiento de los animales y el número de animales fueron minimizados y reducidos al máximo por los investigadores.
Administración del Péptido
La grelina (acil-grelina de rata, Innovagen) fue administrada como se reportó en Gastón et al. (2015). Brevemente, el péptido se disolvió en la solución control compuesta por solución fisiológica 0.85% que contenía el colorante Evans-Blue 0.1%. Se inyectó bilateralmente en el MMI (intra-MMI) a una dosis hipofágica de 30 pmol (Carvajal et al., 2009; Gastón et al., 2015). Las inyecciones intra-MMI se realizaron a 2-3 mm hacia la izquierda y derecha de la línea media y a 3-4 mm desde la sutura entre el prosencéfalo y el cerebelo en un volumen de 3 µl por hemisferio, según el método descrito por Davis et al. (1979). La profundidad de inyección (2.5 mm) se controló mediante un tubo de plástico en la aguja de calibre 27 (Kuenzel y Masson, 1988). Se utilizó un dispositivo de acero para sujetar la cabeza del pollito, con una placa acrílica con orificios bilaterales sobre la cabeza para adaptar la aguja. El estrés que sufre el pollito por este método de inyección es mínimo (Gastón et al., 2017).
Diseño Experimental
Los pollitos de 4-6 días de edad con peso aproximado de 100 g se alojaron la noche previa en una caja individual sin acceso a alimento y con agua ad libitum. En el día de la prueba, cada pollito se colocó en una caja y se llevó a una habitación separada donde se le inyectó intra-MMI con una solución salina (n = 6, grupo control) o con 30 pmol de grelina (n = 6). Inmediatamente después, los pollitos de ambos grupos experimentales fueron expuestos a la prueba de ingesta de alimentos. Otro grupo de pollitos (grupo intacto, n = 6) fue capturado directamente de la caja de cría (sin ser administrado con salina o grelina ni expuesto a la prueba de ingesta) e inmediatamente decapitado. Se recogió la sangre troncal para determinar posteriormente los niveles basales de ACTH y corticosterona.
Ingesta de Alimentos
Cada pollito se colocó en una caja con comida y agua ad libitum. La ingesta de alimentos se midió 30 min inmediatamente después de la inyección de grelina o de la solución salina. El alimento se pesó antes y después de la prueba utilizando una balanza digital (0.01 g). El alimento derramado fuera del comedero fue incluido en los cálculos finales como parte del alimento no ingerido. Al término de la prueba, todos los pollitos fueron decapitados y se extrajo la sangre troncal.
A fin de verificar el sitio de inyección correcto, los prosencéfalos fueron extraídos y fijados en una solución de formaldehído al 4%. Se realizaron cortes coronales usando un micrótomo y se observaron en un microscopio óptico. La marca del sitio de la inyección dejada por el colorante azul de Evans en los cortes coronales sirvió como guía en la verificación. Los pollos que no fueron correctamente inyectados fueron descartados del análisis (Gastón et al., 2015).
Cuantificación Hormonal
Las muestras de sangre se tomaron entre las 09:00 y las 12:00 h para evitar la variabilidad inespecífica relacionada con las fluctuaciones diurnas en los niveles hormonales circulantes. La sangre troncal se recogió en tubos con 50 ml de EDTA. Las muestras de sangre fueron centrifugadas a 1000 × g durante 20 min a 4 ºC. El plasma resultante se recolectó en tubos de 1.5 ml que fueron almacenados a -20 °C. Las determinaciones hormonales se realizaron según Gastón et al. (2017) y siguiendo las instrucciones de los fabricantes con algunas modificaciones para el ensayo de corticosterona (Washburn et al., 2002). La concentración plasmática de ACTH se midió a través de un inmunoensayo quimioluminiscente secuencial de dos sitios (IMMULITE2000, Siemens), con el límite de detección del ensayo de 5 pg/ml y coeficientes de variación intrae inter-ensayo menor al 10%. Las concentraciones plasmáticas de corticosterona se determinaron mediante un kit de radioinmunoensayo de corticosterona (Corticosterone DoubleAntibody-125I RIA Kit, MP Biomedicals), siendo el límite de detección del ensayo de 5 ng/ml. Los coeficientes de variación intrae inter-ensayo fueron menores al 10%. Este ensayo mostró ser apropiado para la medición de la respuesta adrenocortical en aves (Gastón et al., 2017; Glucs et al., 2018; Washburn et al., 2002). Todas las mediciones se realizaron por triplicado (Gastón et al., 2017).
Análisis Estadísticos
Los datos de la ingesta de alimentos mostraron una distribución normal con homocedasticidad y se analizaron estadísticamente mediante la prueba t de Student. Estos datos se expresan como la media aritmética ± DE. Los datos de ACTH y corticosterona se transformaron logarítmicamente para alcanzar los supuestos de normalidad y homocedasticidad, y posteriormente se analizaron usando un análisis de varianza (ANOVA) de una vía. Cuando el ANOVA indicó efectos significativos, se llevó a cabo un análisis a posteriori entre las medias individuales de Newman Keuls para comparar los efectos de la grelina sobre los niveles de hormonas plasmáticas. Los datos se expresaron como la media aritmética ± DE y en algunos casos, como la mediana y cuartiles.
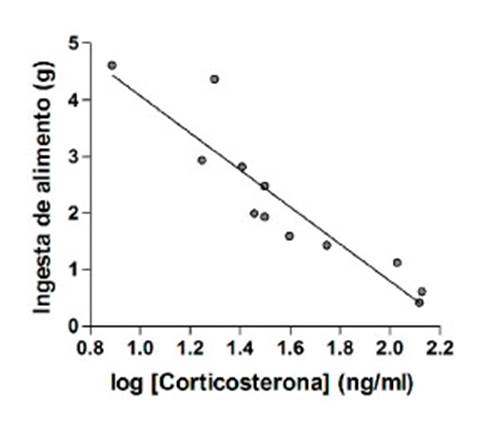
Se utilizó una correlación de Pearson para examinar la relación entre la ingesta de alimentos y las concentraciones log-transformadas de las hormonas. Cuando se observó una fuerte correlación entre estas dos variables, se llevó a cabo una regresión lineal utilizando la ingesta de alimentos como variable dependiente y la concentración hormonal como variable independiente. Un valor de p<0.05 fue considerado una diferencia significativa.
RESULTADOS
Los resultados corroboraron que 30 pmol de grelina intra-MMI inhibieron significativamente la ingesta de alimentos 30 min después de su administración (salina = 2.96 ± 1.28 g, grelina = 1.40 ± 0.89 g, t = 2.44, p<0.05). Se encontró un efecto significativo de los tratamientos sobre las concentraciones plasmáticas de ACTH (ANOVA F = 7.90; p<0.01). El análisis de NewmanKeuls reveló un aumento significativo en las concentraciones plasmáticas de ACTH en los grupos expuestos a la prueba de ingesta de alimentos en comparación con el grupo intacto (intacto = 10.64 ± 4.82 pg/ml, solución salina = 274.35 ± 315.05 pg/ml, grelina =138.66 ± 212.27 pg/ml, p<0.05). Sin embargo, si bien se puede observar una ligera disminución de la concentración de ACTH ocasionada por la administración central de grelina, la diferencia no fue significativa (Figura 1A).
Se encontró un efecto significativo de los tratamientos sobre las concentraciones plasmáticas de corticosterona (ANOVA F2,17 = 23.79, p<0.0001). El análisis de NewmanKeuls mostró un aumento significativo (p<0.05) de los niveles plasmáticos de corticosterona en los grupos expuestos a la ingesta de alimento (salina = 27.02 ± 16.71 ng/ml, grelina = 78.46 ± 51.80 ng/ml) comparados con los no expuestos (intactos = 5.92 ± 1.38 ng/ml). Además, este análisis mostró un aumento significativo en los niveles de corticosterona entre los pollitos inyectados con grelina intra-MMI en comparación con los inyectados con solución salina (p<0.05; Figura 1B).
Las concentraciones plasmáticas totales de ACTH no se correlacionaron con la ingesta total del alimento (r = 0.14, p=0.65, datos no mostrados). Sin embargo, las concentraciones plasmáticas totales de corticosterona evidenciaron una correlación con el consumo total de alimentos (r = 0.92, p<0.0001). La regresión lineal mostró una relación negativa significativa (R2 = 0.85, p<0.001) entre la ingesta de alimentos y los niveles plasmáticos de corticosterona (Figura 2).
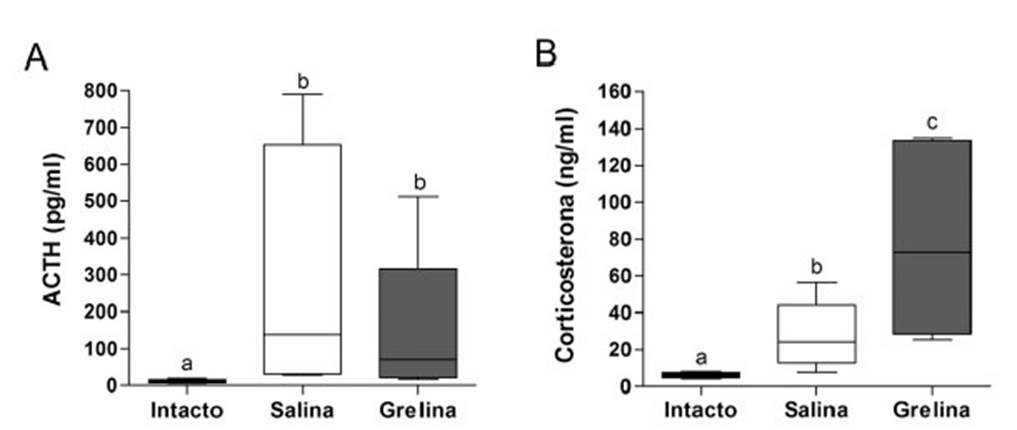
Figura 1 Efecto de la grelina intra-MMI (mesopalio medio e intermedio) sobre las concentraciones plasmáticas de ACTH (A) y corticosterona (B) durante una tarea de ingesta de alimento de pollos de 4-6 días de edad. El cuadro representa los cuartiles 25-75, la línea horizontal dentro del cuadro representa la mediana y las barras indican los valores mínimo y máximo (n=6 por grupo). Letras diferentes indican diferencias significativas (p<0.05)
DISCUSIÓN
Se demostró que la anorexia inducida por 30 pmol de grelina intra-MMI estuvo relacionado con la activación adrenocortical a los 30 min de la inyección. Además, se observó una correlación negativa entre la ingesta de alimentos y los niveles plasmáticos de corticosterona.
Se observó un incremento significativo en las concentraciones plasmáticas de ACTH y corticosterona luego de la prueba de ingesta de alimentos respecto de aquellos no expuestos al alimento (grupo intacto). Ya se había reportado que el método de inyección intraMMI no induce cambios significativos en los niveles basales de ACTH o corticosterona (Gastón et al., 2017); resultados similares fueron publicados para el procedimiento de administración icv de grelina (Furuse et al., 1999). Por lo tanto, el aumento de las concentraciones de ambas hormonas por activación del eje HPA en aves, podría estar asociado al ayuno, al cual podría adicionarse el aislamiento y la neofobia inducidos por las condiciones de prueba de ingesta de alimentos (Jones y Merry, 1988; Salvatierra et al., 2009; Lynn et al., 2010; Krause et al., 2017).
La neofobia, que fuera primariamente descrito en mamíferos, es la inhibición de la alimentación debido a una situación novedosa (novelty) que comprende la inhibición ante un alimento nuevo (neofobia alimentaria) y también la situación no familiar de la prueba comportamental (neofobia del aparato) (Stephens, 1973). La neofobia también ha sido descrita en aves domésticas (Murphy, 1997). Por lo tanto, el contexto social, ambiental y la prueba de ingesta de alimentos per se pueden haber inducido cambios en la reactividad emocional de los pollos, que se evidencia en las diferencias significativas de los niveles de la hormona pituitaria-suprarrenal entre pollitos expuestos y no expuestos (grupo intacto) a la tarea de ingesta de alimentos. Recientemente, Shojaei et al. (2020) expresaron que la regulación de la ingesta de alimentos es un proceso fisiológico complejo que está bajo el control de señales centrales y ambientales.
La grelina intra-MMI indujo una disminución significativa en la ingesta de alimentos y, a la vez, un aumento significativo de las concentraciones plasmáticas de corticosterona respecto al grupo inyectado con salina, sin cambios significativos en los niveles plasmáticos de ACTH. Además, los altos niveles de corticosterona en plasma afectaron negativamente la ingesta de alimentos en los pollitos. Se conoce que el SNC juega un papel fundamental en la regulación de la conducta alimentaria en las aves, siendo el hipotálamo el área central de control (Tachibana y Tsutui, 2016; Wang et al., 2019). En concordancia, se observó que la administración icv de la hormona liberadora de la corticotropina aumentó los niveles de corticosterona plasmática (Furuse et al., 1997) e inhibió la ingesta de alimento en pollos parrilleros y ponedoras adultas hasta 3 h pos-inyección (Denbow et al., 1999).
Por otro lado, Saito et al. (2005) demostraron que la anorexia inducida por grelina se atenúa mediante la administración conjunta de grelina y astressina (antagonista del receptor de CRH de tipo 2) en pollitas ponedoras. Además, la administración icv de ACTH disminuye la ingesta de alimento en los pollos, lo que se asocia con una activación hipotalámica y una disminución en la expresión del ARNm hipotalámico de varios factores orexigénicos, como AgRP, orexina y R-MC1 (Shipp et al., 2015). Las hormonas adrenocorticales no solo están relacionadas con los efectos centrales anorexigénicos de varios péptidos en pollos (Tachibana y Tsutsui, 2016), sino también con una disminución del paso de alimentos por el tracto digestivo superior (Ogino et al., 2014, 2016; Tur et al., 1989). Dado que la activación suprarrenal produce una retroalimentación negativa sobre el hipotálamo y la glándula pituitaria, los resultados del presente estudio sugieren que la grelina puede desencadenar la activación del eje HPA, provocando un efecto anorexigénico en los pollitos.
El MMI es un área de integración sensorial multimodal (equivalente a la corteza aviar) que tiene un papel bien definido en el procesamiento de la memoria en los pollos (Csillag, 1999; Gibbs, 2008). Además, el MMI podría ser un sitio importante de acción de la grelina en respuesta a un estresor agudo con una interacción funcional compleja entre la neurotransmisión GABA-A y el eje HPA (Gastón et al., 2015, 2017). Los circuitos neuronales que controlan la alimentación y los comportamientos emocionales están conectados de manera intrincada y recíproca (Sweeney y Yang, 2017) y la evidencia previa ha indicado que los sistemas serotoninérgico y 5'-adenosine monophosphateactivated protein kinase (AMPK) pueden ser parte de los mecanismos que modulan el efecto anorexigénico de la grelina en las aves (Zhang et al., 2004; Xu et al., 2011; Lei y Lixian, 2012; Zendehdel et al., 2013). Así, se propone que los circuitos neuroendócrinos entre el MMI y el eje HPA podrían estar regulando tanto la acción ansiogénica de la grelina (Gastón et al., 2017) como así también su efecto hipofágico que sugiere una conectividad recíproca entre el control de la alimentación y las conductas emocionales (Sweeney y Yang, 2017).
En conclusión, el eje HPA podría constituir la última etapa del sistema que se inicia en las vías anorexigénicas neuronales superiores involucradas en la acción de la grelina en pollos de pocos días de nacidos. Sin embargo, no se puede descartar que los mecanismos subyacentes implicados en la anorexia inducida por la grelina y el comportamiento de ansiedad puedan actuar, en algunos casos, a través de diferentes vías












 uBio
uBio