INTRODUCCIÓN
La fascioliasis o distomatosis causada por el trematodo Fasciola hepatica, es una zoonosis de gran importancia en el mundo que ocasiona sobre todo patologías hepatobiliares (Espinoza et al., 2010). El parásito tiene de huésped intermediario a los caracoles del género Lymnaea (Familia: Lymnaeidae) y como hospederos definitivos una gran variedad de mamíferos herbívoros, afectando también al humano (Carrada-Bravo, 2007; Pujadas et al., 2015; Vázquez y Sánchez, 2015). Los animales se infectan en el pastoreo o al beber agua contaminada con estados inmaduros del parásito (Carrada-Bravo, 2007; López et al., 2017).
La región de Ayacucho, Perú, es endémica a la Fasciola, encontrándose prevalencias de infección bovina y ovina de 47.6 y 52.1%, respectivamente (Ticona et al., 2010); asimismo, las regiones de Apurímac, Arequipa, y La Libertad presentan prevalencias elevadas de fascioliasis en bovinos, ovinos y equinos (Merino y Valderrama, 2017; Velásquez, 2017; Jara et al., 2018). Prevalencias elevadas igualmente se presentan en otros países de América Latina (Alpízar et al., 2013; Giraldo et al., 2016; Soca-Pérez et al., 2016).
Se reportan grandes pérdidas económicas causadas por la distomatosis, tanto en países africanos (Berthe et al., 2017; Gebeye et al., 2017; Jaja et al., 2017; Liba et al., 2017; Meaza et al., 2017), como en países latinoamericanos como Costa Rica (Rojas y Cartín, 2016) y Cuba (Palacio et al., 2019). En forma similar, los sistemas pecuarios de producción del país se encuentran afectados, con pérdidas que rodean los 50 millones de dólares anuales, siendo la principal causa el decomiso de vísceras como hígados infectados con fasciolas jóvenes o adultas, la reducción de la ganancia de peso, tasas de preñez decrecientes y la producción mermada de leche y carne (Espinoza et al., 2010; López et al., 2017).
Estudios epidemiológicos sobre los hospederos intermediarios de F. hepatica indican prevalencias de infección natural del 12 y 27% en Lymnaea columella y L. viatrix, respectivamente, en Cajamarca, Trujillo, Huánuco, Lima y Ucayali (Larrea et al., 2007). Asimismo, la frecuencia en Cusco asciende al 36 y 46% en caracoles de Pseudosuccinea columella recolectados entre 4200 y 4500 msnm, y 48% en individuos de L. viatrix muestreados entre 4000 y 4200 msnm (Londoñe et al., 2009).
La creciente y persistente presencia de F. hepatica en el territorio peruano, es indicativo de la ausencia de programas eficientes de prevención y control del parásito, los cuales deben estar orientados a mejorar la forma de crianza del ganado, la estratégica aplicación de tratamientos veterinarios y de la buena ejecución de los sistemas de gestión sanitaria en el manejo de las heces, así como de los cuerpos de agua, y a desarrollar una cultura consciente y responsable en las comunidades (Espinoza et al., 2010).
La Gerencia Regional de Salud de Arequipa emitió un informe en 2014 a través del Análisis de Situación de Salud de los casos de distomatosis humana encontrados hasta dicho año, siendo la provincia de Caylloma la localidad más afectada (GERESA, 2014). A la fecha, aún persiste el desconocimiento epidemiológico de esta zoonosis en la zona y, por ello, el objetivo del presente estudio fue determinar la frecuencia de la fascioliasis animal en el ganado, sus factores asociados y la frecuencia de infección por F. hepatica en caracoles Lymnaeidae.
MATERIALES Y MÉTODOS
Área de Estudio
La investigación se realizó entre agosto y setiembre de 2018 en las comunidades de Huanca, San Basilio y Malata, distrito de Huanca, provincia de Caylloma, Arequipa, Perú. El distrito forma parte de la vertiente occidental de los Andes del Sur del Perú y se encuentra a una altitud de 3080 msnm. El clima es semiseco y frío, de baja humedad relativa, temperatura media anual de 15.2 °C y precipitaciones anual entre 300 y 500 mm. El territorio está irrigado por los ríos Quilca, Siguas, Vitor y Chili y cuenta con aguas subterráneas empleadas en la agricultura. Huanca está atravesada por dos afluentes del río Siguas, Lihualla y Pichirijma. Su estructura agraria se compone de pequeñas parcelas de forma irregular, debido al accidentado relieve y las pendientes profundas que representan el 70% del total del suelo. El agua utilizada para el riego proviene del glaciar Ampato, que discurre por gravedad hasta los andenes. La ganadería es de tipo extensiva, en su mayoría bovina, seguida de ovina, equina y escasamente porcina (Trujillo, 2015; Trujillo y Lajo, 2015).
Muestras
El trabajo se realizó en ganaderías extensivas, donde los animales no son marcados ni identificados adecuadamente, de allí que las muestras fecales de bovinos, ovinos y equinos se recolectaron por conveniencia, recorriendo cerca de 20 km entre las áreas pecuarias de las comunidades de Malata, San Basilio y el pueblo de Huanca (comunidad principal del distrito), con la intención de tener encuentros casuales con el ganado y sus propietarios (Otzen y Manterola, 2017). Las muestras fueron colectadas inmediatamente después de la emisión fecal (n=179) según el Manual Veterinario de Toma y Envío de Muestras de PANAFTOSA (2017) modificado. Un puñado de la parte superficial de las bostas fueron levantadas del suelo con una bolsa de polietileno, y luego se fijaron en solución formol al 7%. En forma paralela, se encuestó a los dueños a través de una ficha epidemiológica en función de las siguientes variables: comunidad (Huanca, Malata, San Basilio) especie pecuaria (bovino, equino, ovino), alimento de consumo (alfalfa, pastos naturales, concentrado) y fuente de agua (acequia, río, pozo).

Figura 1 Zonas potenciales para el desarrollo de los caracoles Lymnaeidae como acequias, riachuelos, suelos lodosos y pequeños cuerpos de agua empozados
Para la recolección de caracoles Lymnaeidae, se identificaron las áreas adecuadas para su desarrollo, como la ribera de pequeños ríos, bajo las piedras de los cuerpos de agua, en charcos, agua empozada, acequias, arroyos y fango (Figura 1). Considerando lo anterior, el muestreo se realizó alrededor de las coordenadas de los siguientes puntos: Comunidad de Huanca [P =16° 02’ 16’’ S - 71° 52’ 24’’ W (fango formado cerca de un camino empinado); P =16° 01’ 55’’ S - 71° 52’28’ W (arroyo pedregoso); P =16° 02’ 37’’ S - 71° 52’ 54’’ W (canal de regadío)] y comunidad de Malata [P =16° 02’ 32’’ S - 71° 51’ 43’’ W (fango formado cerca a la entrada de Malata); P =16 02 31 S - 71° 51’ 28’’ W (canal de regadío)]. Se recolectaron manualmente 561 caracoles, considerando las características conquiológicas reconocibles en campo de un lymneido, como la forma oval de la conchilla, suturas profundas, el color pardo y, principalmente, la abertura en posición dextrógira (Carvalho et al., 2014; Vázquez y Sánchez, 2015). Los lymneidos fueron llevados al laboratorio en frascos de plástico de boca ancha conteniendo algodón hidrófilo humedecido con agua de su hábitat (Iturbe y Muñiz, 2012).
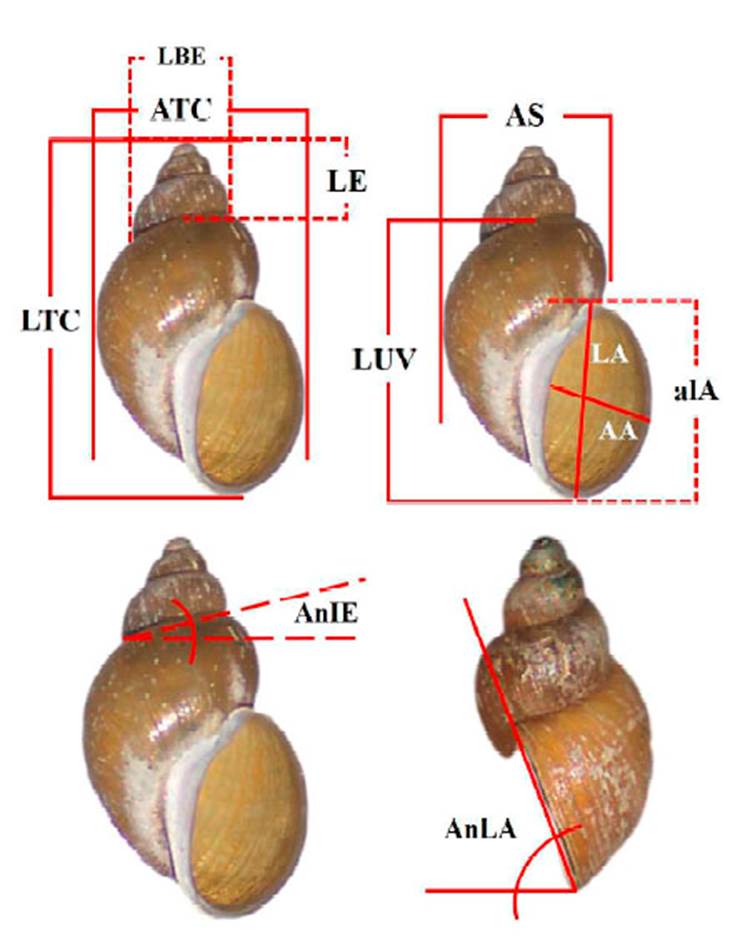
Figura 2 Mediciones consideradas en la morfometría de las conchillas de los caracoles Lymnaeidae. LTC: largo total de la conchilla; ATC: ancho total de la conchilla; LA: largo de la abertura; AA: ancho de la abertura; alA: altura de la abertura; AS: ancho superior; LE: largo de la espira; LBE: longitud de la base de la espira; LUV: longitud de la última vuelta; LTC-alA: largo restante de la conchilla; AnIE: ángulo de inclinación de la espira; AnLA: ángulo lateral de la abertura.
Análisis de Laboratorio
Las muestras fueron evaluadas en el Laboratorio de Entomología y Protección Vegetal de la Escuela de Biología de la Universidad Nacional de San Agustín de Arequipa. Las heces se procesaron mediante la Técnica de Cuatro Tamices de Girão y Ueno (1985) modificada para el presente estudio, utilizando tres tamices de acero inoxidable en vez de cuatro, pero de métrica semejante, con aberturas de malla de 150, 75 y 63 µm. Primeramente, las heces fueron homogenizadas con la solución fijadora, se apilaron los tamices colocando en la parte baja el de 63 µm y en la parte superior el de 150 µm. Se tamizó 50 g de cada muestra moviendo bien los tamices con bastante agua a chorro. Este paso se repitió sin el tamiz de 150 µm y nuevamente quitando el de 75 µm, permaneciendo solo el más fino de 63 µm. El sobrenadante fue eliminado y lo que quedó se transfirió en su totalidad a una placa Petri, a la cual se agregó de 3 a 4 gotas de azul de metileno que sirvió como fondo de contraste. El criterio de positividad de fascioliasis fue por el hallazgo de huevos de F. hepatica con base a las descripciones de Bedoya et al. (2012) y Beltrán et al. (2014).
La evaluación de los caracoles (n=484) fue mediante el aplastamiento individual en láminas portaobjetos con una gota de suero fisiológico. Los preparados fueron triturados mediante el uso de pinzas (Londoñe et al., 2009; Giménez et al., 2014). El criterio de positividad a la infección fue por el hallazgo de redias y cercarias de F. hepatica, según los criterios morfológicos descritos por López et al. (2008).
Para la identificación taxonómica de los moluscos, se procesaron 77 ejemplares según la técnica de Pointier, tomada de Tomassi et al. (2015). Para esto, los caracoles fueron lavados con agua corriente a fin de eliminar las impurezas, luego se sumergieron en agua a 70 °C por 30 s, de allí en agua fría y en solución alcohol a 70° durante 24 h. Posteriormente, con pinzas y agujas se retiró la masa blanda y fue conservada en solución etanol a 70° en viales de 15 ml. En el estudio conquiológico se utilizó el software ZEN v. 2.3 lite y un estereomicroscopio. Se describieron las siguientes características: forma de la conchilla, color de la conchilla, aspecto de las suturas, número de vueltas y posición de la abertura (Carvalho et al., 2014). En la morfometría se midió (Figura 2) el largo total de la conchilla (LTC), ancho total de la conchilla (ATC), largo de la abertura (LA), ancho de la abertura (AA), altura de la abertura (alA), ancho superior (AS), largo de la espira (LE); longitud de la base de la espira (LBE), longitud de la última vuelta (LUV), largo restante de la conchilla (LTC-alA), ángulo de inclinación de la espira (AnIE) y ángulo lateral de la abertura (AnLA). Así mismo, fueron calculadas las proporciones de LUV/LTC, LE/LTC, alA/LTC, alA/LUV, ATC/LTC, AA/LA, AA/ATC, AS/ATC, LBE/ATC y LBE/AS, según lo considerado por Damiani y Álvarez (2005), Núñez (2011), Vázquez y Sánchez (2015), Bargues et al. (2016), Dar et al. (2016), y De Lucía y Gutiérrez (2017).
Análisis Estadístico
Los datos fueron analizados utilizando los softwares estadísticos IBM SPSS Statistics v. 25 y Epidat 4.2. La frecuencia de infección en el ganado y en los caracoles se determinó mediante el cálculo de las proporciones porcentuales de animales y moluscos positivos a huevos y larvas de F. hepatica, respectivamente, acompañados de sus intervalos de confianza (IC). De la merística de las conchillas, se calculó como medida de posición la media aritmética, acompañada de las medidas de dispersión de valor máximo y mínimo, rango, error estándar, desviación estándar y para mostrar la precisión de las medias los IC al 95% (Milton, 2007; Celis de la Rosa, 2014). Para la identificación de los factores asociados a la fascioliasis, se usó la prueba de regresión logística siguiendo una técnica backward (Acuña et al., 2012), a fin de calcular los OR ajustados (ORa). Se usó un nivel de significación del 5% (Cerda et al., 2013; Dagnino, 2014).
RESULTADOS
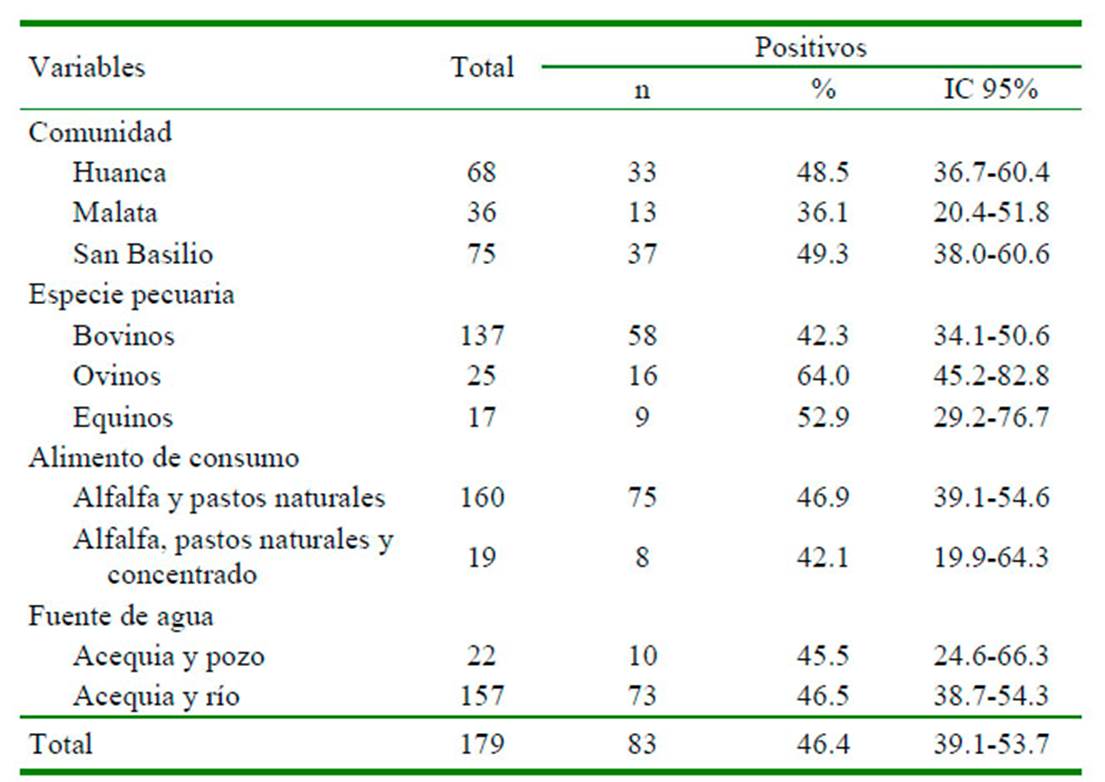
La frecuencia de fascioliasis en el ganado fue de 46.4% (IC=39.1-53.7), siendo mayor en la localidad de San Basilio con 49.3% (IC=38.0-60.6), en los ovinos 64.0% (IC=45.2-82.8), en el ganado que consumía alfalfa y pastos naturales 46.9% (IC=39.154.6), y en los animales que abrevaban agua de las acequias y el río 46.5% (IC=38.7-54.3), según se muestra en el Cuadro 1. La prueba de regresión logística estableció que la variable especie pecuaria (p=0.046<0.05; IC=1.04.2>1) constituyó un factor asociado a la infección por F. hepatica en el ganado del distrito de Huanca, mostrando que los equinos y ovinos tenían 2.1 veces más probabilidad de desarrollar fascioliasis (Cuadro 2).
Los huevos de Fasciola eran ovalados, operculados por un extremo y de típico color amarillo que fácilmente contrastaba con el colorante (Figura 3). La frecuencia de estados larvales de F. hepatica en los caracoles fue de 7.4% (IC=5.1-9.8), siendo mayor en la comunidad de Huanca, alcanzando un 9.8% (IC=5.2-14.3); sin embargo, en San Basilio no se encontró a los moluscos (Cuadro 3). Las redias presentaban una ventosa oral, saco digestivo y proyecciones laterales a lo largo del cuerpo; las cercarias poseían una ventosa oral, acetábulo, abundantes glándulas cistógenas y carecían de manchas oculares (Figura 4).
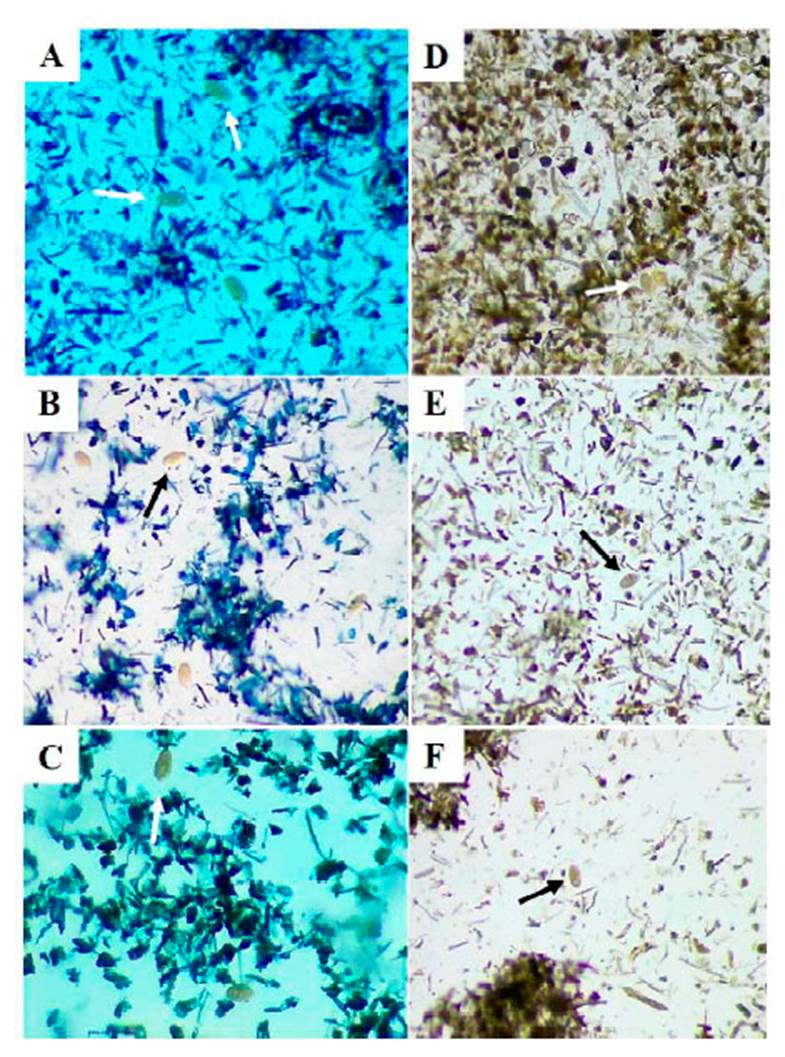
Figura 3 Huevos de Fasciola hepatica hallados en heces del ganado bovino, ovino y equino del distrito de Huanca, provincia de Caylloma, Arequipa (2018) (flechas blancas y negras). A-C: en azul de metileno; D-F: sin tinción. 2x y 4x
Se observaron las siguientes características conquiológicas: conchilla oval elongada, color marrón, algunos blanquecinos y otros mixtos, ápice de la espira obtuso, giros (vueltas) hacia la derecha, suturas marcadas y con 4 o 5 vueltas y media. Abertura dextrógira, ovalada, con pliegue columelar y fino peristoma. El largo total promedio fue 5.21±0.11 mm. Los ejemplares más pequeños midieron 3.09 mm y los de mayor tamaño 7.05 mm. Ancho total promedio de 2.82±0.05 mm, la longitud de la última vuelta representó 3/4 del LTC (78%), la altura de la abertura la mitad del LTC (52%) y un poco más respecto a la LUV, alcanzando casi las 3/4 partes (67%). El ATC medía un poco más de la mitad del LTC (54%), el AA fue de igual forma respecto al LA (54%) y al ATC (53%); sin embargo, el AS representó un poco más de los 3/4 del ATC. La LBE fue proporcional a la mitad del ATC (52%) y un poco más respecto al AS (Cuadro 4). La inclinación de la espira formó un ángulo de 7.41±0.37° y en vista lateral 70.28±0.36°. En base a lo descrito, se determinó que los caracoles pertenecían al género Lymnaea de la Familia Lymneidae (Figura 5).

Figura 4 Estados larvales de Fasciola hepatica, hallados en los caracoles Lymnaeidae del distrito de Huanca, provincia de Caylloma, Arequipa (2018). A-B: Redias; C-D: Cercarias; Flecha negra: Ventosa oral; Flecha verde: Proyección lateral; Flecha roja: Saco digestivo; Flecha azul: Glándulas cistógenas. 2x y 4x
DISCUSIÓN
Se encontró una frecuencia de fascioliasis en el ganado del 46.4%, por lo que se podría considerar al distrito de Huanca como una zona mesoendémica de la fascioliasis animal (Valderrama, 2016); sin embargo, la cifra real fue probablemente mayor, dado que el diagnóstico fue mediante la observación de huevos de F. hepatica obtenidos en el tamizado de muestras fecales, los cuales están presentes únicamente en la fase crónica de la infección (López et al., 2017). Por otra parte, actualmente se dispone de otros métodos o técnicas de diagnóstico de mayor precisión, tales como los inmunológicos ELISA (Alzamora-Gonzales et al., 2016) y Western Blot, que permiten detectar antígenos y anticuerpos coprológicos y serológicos, además de las técnicas moleculares como PCR para identificar presencia de material genético de F. hepatica (Gomez-Puerta et al., 2019). Esto se puede evidenciar en el estudio de Jara et al. (2018), en el que compararon sus resultados de prevalencias por varios métodos de diagnóstico, llegando a obtener una seroprevalencia de 61.8% en ovinos y 86.8% en bovinos con la técnica de Western blot, cifra superior al 42.3 y 62.4% obtenidas mediante las técnicas coprológicas Kato-Katz cualitativo y Ritchie para estas especies.
Cuadro 2 Factores asociados a la fascioliasis en el ganado del distrito de Huanca, provincia de Caylloma, Arequipa (2018)
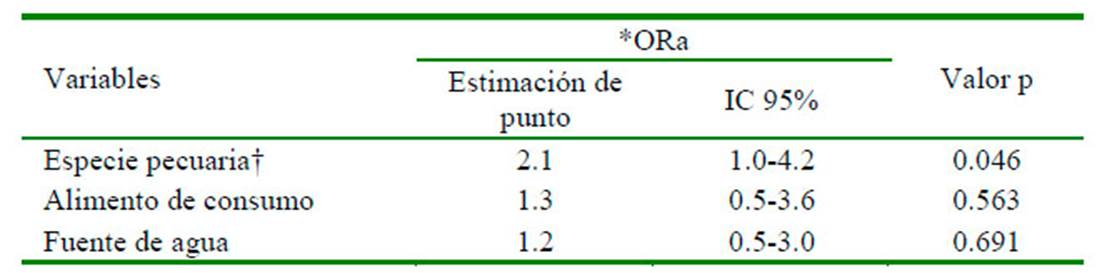
*ORa : Odds ratio ajustado calculado mediante análisis de regresión logística.
† Ovino y equino vs bovino
IC: Intervalo de confianza
Cuadro 3 Frecuencia de Fasciola hepatica en caracoles Lymnaeidae del distrito de Huanca, provincia de Caylloma, Arequipa (2018)
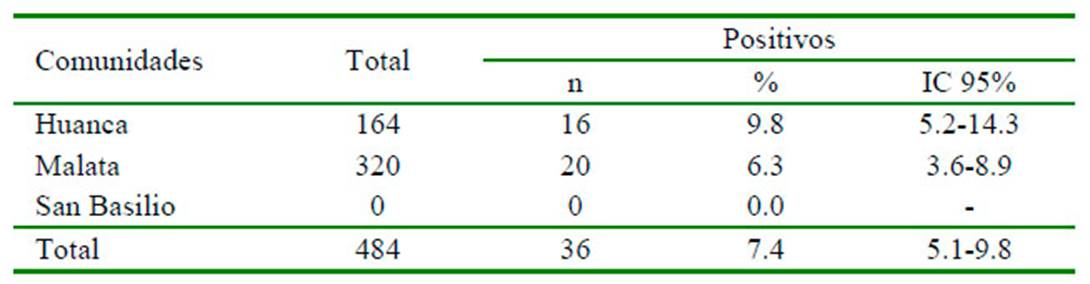
IC: Intervalo de confianza
Cuadro 4 Medidas morfométricas de las conchillas de los caracoles Lymnaeidae colectados en el distrito de Huanca, provincia de Caylloma, Arequipa (2018)
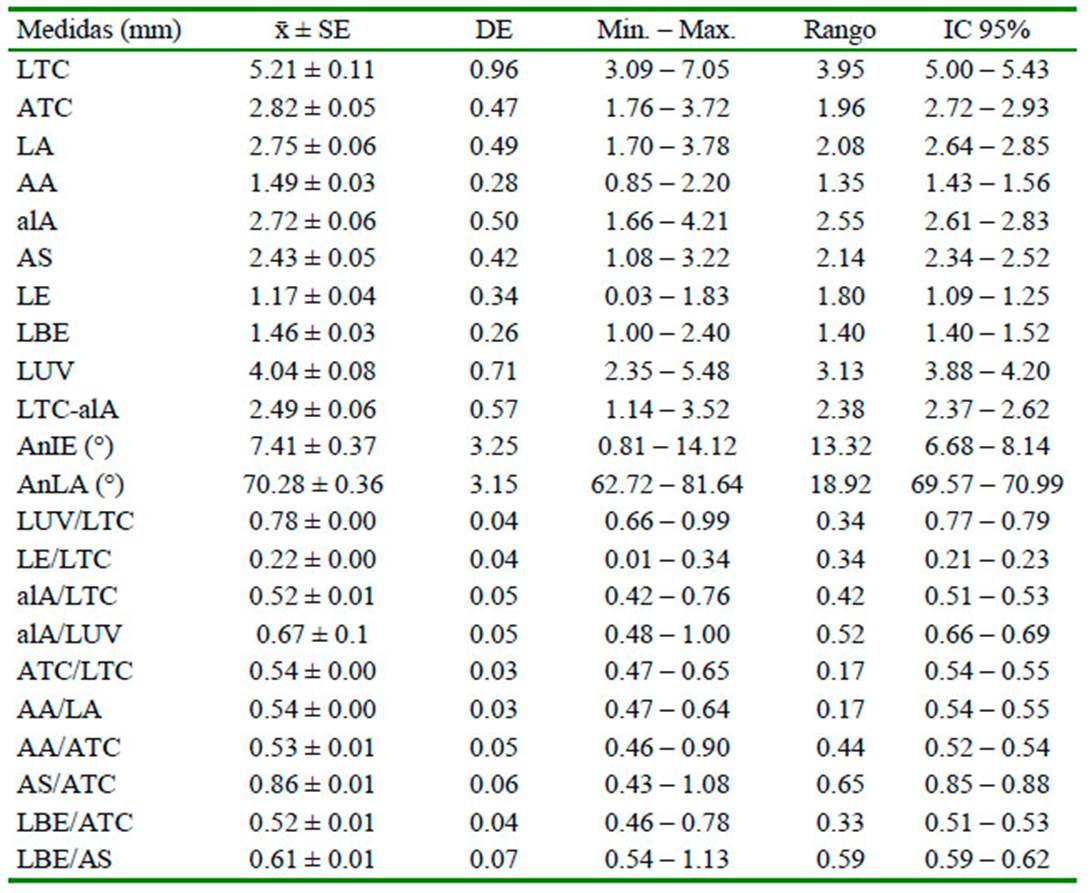
x:̄ Media aritmética. SE: Error estándar. DE: Desviación estándar. Min-Max: Mínimo y máximo.
IC: Intervalo de confianza
LTC: largo total de la conchilla; ATC: ancho total de la conchilla; LA: largo de la abertura; AA: ancho de la abertura; alA: alto de la abertura; AS: ancho superior; LE: largo de la espira; LBE: longitud de la base de la espira; LUV: longitud de la última vuelta; LTC-alA: largo restante de la conchilla; AnIE: ángulo de inclinación de la espira; AnLE: ángulo lateral de la abertura. (°). Grados
Los ovinos y equinos mostraron mayor presencia de fascioliasis, coincidiendo con el análisis de Regresión logística, que estableció a la especie pecuaria como el único factor asociado a la zoonosis, teniendo los equinos y los ovinos 2.1 veces más probabilidad de desarrollar distomatosis hepática. Sin embargo, la literatura menciona otro tipo de resultados; así, Ticona et al. (2010) reportaron prevalencias de 39.1% de fascioliasis en ovinos y de 35.7% en bovinos de Ayacucho, mientras que Jara et al. (2018) estimaron 61.8% para ovinos y 86.8% para bovinos en La Libertad, Perú.

Figura 5 Vista ventral y dorsal de ejemplares Lymnaeidae recolectados en el distrito de Huanca, provincia de Caylloma, Arequipa (2018)
La frecuencia de infección fue semejante en las comunidades de Huanca y San Basilio y un poco menor en Malata. Esta diferencia probablemente se deba a los factores ambientales propios de cada zona, como la calidad del agua en relación con el pH, temperatura, salinidad y oxígeno disuelto, así como la humedad ambiental y el tipo de suelo (Carrada-Bravo y Escamilla, 2005; Carrada-Bravo, 2007). Otras causas podrían ser las posibles prácticas inadecuadas en el control de la parasitosis y la condición económica de los ganaderos, lo cual conllevaría a inadecuados o ausentes tratamientos veterinarios y a una deficiente alimentación del ganado, dado que el estado nutricional influye en el potencial genético e inmunológico de los animales (Cordero del Campillo, 1999; Soca-Pérez et al., 2016).
El ganado alimentado con alfalfa y pastos naturales presentó una frecuencia de fascioliasis semejante a los que consumían estos alimentos más concentrado; de igual forma, la frecuencia fue semejante entre los que abrevaban diferentes fuentes de agua. Las similares proporciones y la ausencia de asociación se debe posiblemente a que el ganado está expuesto a prácticamente las mismas condiciones de alimentación y fuentes de agua, las cuales deben contener cargas parasitarias similares como consecuencia de la acumulación de la materia fecal, todo ello característico del sistema extensivo ganadero (Martín et al., 2001; Martínez et al., 2007).
En el Perú, son muy limitadas las investigaciones sobre prevalencias de F. hepatica en los hospederos intermediarios. Entre ellas, Larrea et al. (2007) reportan frecuencias de 17% en Lymnaea columella y L. viatrix procedentes de Cajamarca, Siancas (2017) en La Libertad encontró una frecuencia de 30.7% en L. viatrix y Londoñe et al. (2009) en Cusco encontraron infecciones en P. columella, que variaron entre 36 y 48%. El presente estudio estimó una baja presencia de Fasciola en los Lymnaeidae del distrito de Huanca; sin embargo, se debe considerar el elevado potencial biótico de estos moluscos y de F. hepatica, dado que cada caracol puede producir 25 000 nuevos individuos en tres meses y de cada miracidio del parásito se pueden generar 250 cercarias, de allí que no se debe subestimar las pequeñas cifras de caracoles infectados (Carrada-Bravo, 2007).
En la comunidad de San Basilio no se encontraron ejemplares Lymnaeidae, posiblemente debido a las condiciones medioambientales que estarían limitando su distribución y abundancia; por ello la importancia de contar con estudios ambientales y su influencia en el ciclo biológico de los caracoles. En este sentido, Pujadas et al. (2015) en Santa Fe, Argentina, describieron en su estudio las características fisicoquímicas de temperatura (20.6-29 °C), conductividad (0.6-2.3 mS/cm) y pH ligeramente alcalino (7.6-8.3). Asimismo, Iturbe y Muñiz (2012) en su trabajo en Cusco, Perú, determinaron la calidad fisicoquímica de las aguas de los biotopos de los caracoles.
Las características conquiológicas de otros Lymnaeidae han sido reportados. Así, especímenes de Galba cubensis procedentes del Delta del Ebro en España, presentaron conchillas con dimensiones levemente mayores (alto: 8.1 mm; ancho: 4.7 mm) pero una altura menor (3.8 mm) (Schniebs et al., 2018); caracoles Galba neotropica de Santa Fe, Argentina, mostraron longitudes de conchillas entre 4.1 y 8.5 mm y ancho entre 2.5 y 5.1 mm (Pujadas et al., 2015); asimismo, especímenes de Lymnaea neotropica y L. viator en Catamarca, Argentina, presentaron medidas superiores, además de tener peristoma delgado y ápice de la espira obtuso (Bargues et al., 2016), en tanto que para L. schirazensis se han reportado proporciones similares a las del presente estudio (Bargues et al., 2011). Investigaciones en Perú realizadas por Iturbe y Muñiz (2012) en San Jerónimo, Cusco, han descrito las conchillas de Galba truncatula dimensiones semejantes a los de la Zona del presente estudio (largo: 5.08 mm, ancho: 2.85 mm, ancho: 1.74 mm, largo de la abertura: 2.64 mm) aunque con mayor longitud para el largo de la espira (2.6 mm). Contrariamente, Londoñe et al. (2009) reportaron para Lymnaea viatrix largo y ancho de 4.5 y 1.1 mm, respectivamente, y 0.7 mm de largo de abertura, siendo valores muy inferiores a las de esta investigación.
Respecto a la identificación taxonómica de los Lymnaeidae, algunos estudios enfocados en relacionar los rasgos conquiológicos con su posible dependencia genética, han demostrado que la morfología de las conchillas responde a las condiciones ambientales como consecuencia de su plasticidad fenotípica y no está determinada por la genética de estos caracoles (Wullschleger y Jokela, 2002). También se ha encontrado gran variabilidad en la morfología del aparato reproductor entre especies, pero mostrando incongruencia entre la caracterización conquiológica con los resultados genéticos. No obstante, Samadi et al. (2000) pudieron diferenciar L. cubensis de L. truncatula procedentes del viejo mundo y de países latinoamericanos como Bolivia mediante parámetros anatómicos.
Dadas las posibles confusiones para identificar especies de Lymnaeidae basándose en la descripción conquiológica, se ha utilizado pruebas moleculares para diferenciar especies fenotípicamente similares (Correa et al., 2011), utilizando secuencias de los nucleótidos ITS-2 e ITS-1 del ADN ribosómico (rDNA) y COI del ADN mitocondrial (mtDNA) (Hurtrez-Boussès et al., 2005; Bargues et al., 2007; 2012). No obstante, se considera que la información obtenida mediante la caracterización conquiológica de los Lymnaeidae es de utilidad en la determinación preliminar de la posición taxonómica, fundamental para el reconocimiento de estos especímenes en la etapa de campo y laboratorio.
CONCLUSIONES
La frecuencia de infección de Fasciola hepatica en el ganado del distrito de Huanca de la provincia de Caylloma, Arequipa en 2018, fue del 46.4%.
La variable especie pecuaria se asoció a la fascioliasis en el ganado, siendo los ovinos y equinos, los grupos con mayor probabilidad a desarrollar la enfermedad.
La frecuencia de infección de Fasciola hepatica en caracoles Lymnaeidae fue 7.4%.












 uBio
uBio