INTRODUCCIÓN
Los ectoparásitos que afectan a las aves domésticas están representados por numerosas especies de ácaros y piojos (Roque, 2015). Las parasitosis en infestaciones intensas pueden ocasionar un cuadro debilitante (Torres-Cabra y Lagos-López, 2019), al interferir en la nutrición y descanso de las aves, con las consiguientes mermas en la producción (Quintero et al., 2010; Roque, 2015). Rodríguez et al. (2015) señalan que son frecuentes los casos en que las aves permanecen infestadas hasta el final de su ciclo productivo.
Tradicionalmente se emplean productos químicos para el control de estos artrópodos, especialmente los organofosforados y piretroides (Shane, 2010). Szczypel et al. (2003) indican que la cipermetrina es uno de los insecticidas más usados en Cuba y que con una correcta aplicación, garantiza hasta 98% de efectividad. El empleo de plaguicidas químicos ha permitido una rápida y efectiva forma de solucionar estos problemas; sin embargo, la utilización inadecuada de estos productos conlleva a un desarrollo acelerado de resistencia de los parásitos externos a estos productos e incremento de los costos de producción (Hernández et al., 2007). Lister (2009) recomienda cambiar de principio activo cada cierto periodo de tiempo como medida para atenuar la aparición de resistencia. Shane (2010), de otra parte, refiere que existe un desarrollo de la resistencia a los piretroides y organofosforados sintéticos, en tanto que George et al. (2015) reportan resistencia de ácaros a plaguicidas como carbamatos y piretroides.
Estudios en Cuba se han llevado a cabo para determinar la eficacia de la alfacipermetrina en el control de piojos en gallinas ponedoras (Rodríguez et al., 2018); sin embargo, se desconoce su eficacia para el control de ácaros plumícolas en estas aves. Por todos es conocido que la aplicación del baño implica un estrés para las aves, sumado a que frecuentemente las infestaciones por ectoparásitos se presentan con la intervención de ácaros y piojos, por lo que se impone la necesidad de emplear productos que resulten eficaces para ambos grupos de ectoparásitos. Por tales razones, el objetivo del estudio fue evaluar dosis de alfacipermetrina para el control de ácaros plumícolas en gallinas ponedoras en condiciones de laboratorio.
MATERIALES Y MÉTODOS
El presente experimento se realizó en dos naves experimentales del Laboratorio de Investigación y Diagnóstico Aviar, perteneciente al Instituto de Investigaciones Avícolas, Cuba, durante los meses de junio y julio de 2019. Se emplearon dos naves (divididas en tres cuartones) con capacidad de 63 aves. Cada cuartón posee una fila o batería de siete jaulas, con mallas antipájaros para evitar la entrada de aves silvestres.
Se emplearon 115 gallinas ponedoras White Leghorn de 52 semanas de edad. Las aves fueron alojadas a razón de tres por jaula y la crianza se realizó según lo establecido por el Manual Tecnológico para Ponedoras y sus Reemplazos (Godínez et al., 2013). La alimentación fue a base de pienso ponedora fase II, a razón de 108 g por ave.
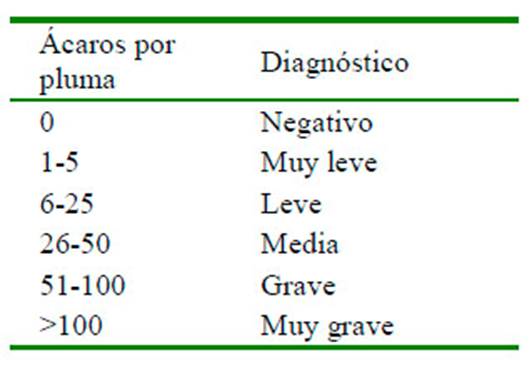
Las aves se identificaron con bandas en las alas. Se realizó un muestreo inicial a todas las gallinas conforme a lo referido por Rodríguez et al. (2018), extrayendo de 3 a 5 plumas de la cabeza, dorso, alas, zona de la cloaca, cara anterior del muslo y zona pectoral. Todas las aves se encontraban infestadas naturalmente por el ácaro Pterolichus obtusus. Para el diagnóstico aracnoentomológico y la clasificación del grado de infestación de los ácaros (Cuadro 1), se tuvo en cuenta los parámetros referidos por Rodríguez et al. (2015).
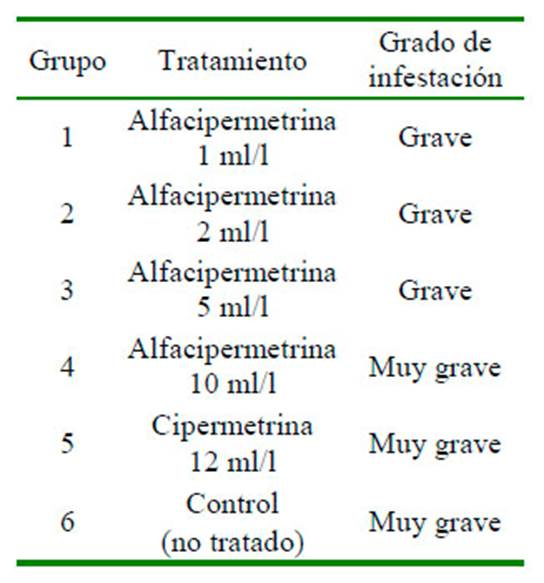
Las aves fueron distribuidas en grupos homogéneos de acuerdo con el grado de infestación inicial de P. obtusus. Cada grupo estuvo compuesto por 20 aves, con excepción del grupo 6 que fue de 15 gallinas (Cuadro 2). Se evaluó un concentrado emulsionable de alfacipermetrina al 10% (gabametrina), producida por Labiofam (Cuba). La dosis recomendada por el fabricante es de 1 ml/l de agua para el control de ácaros en mamíferos; pero se desconoce la dosis efectiva para el control de ácaros en aves.
Cuadro 1 Clasificación del grado de infestación por ácaros Pterolichus obtusus en gallinas según Rodríguez et al. (2015)
Los tratamientos se aplicaron por medio de baños por aspersión empleando una mochila manual con capacidad para 16 L. Se utilizó un volumen de solución de 100 ml por ave. Se efectuaron tres baños con frecuencia semanal, realizándose una evaluación entre las 24 a 48 horas pos-tratamiento, contándose los ectoparásitos. El cálculo de la eficacia se realizó según la fórmula propuesta por la Resolución N° 48 del Mercosur (1997): %E = ((XT-XD) / XT) * 100, donde %E es la eficacia en porcentaje, XT es la media de ectoparásitos del grupo testigo y XD es la media de ectoparásitos de cada grupo desparasitado. La interpretación de la eficacia considera que cuando se logra controlar más del 98% el tratamiento es altamente efectivo, entre 90-98% es efectivo, entre 8089% es moderadamente efectivo y menos del 80% es insuficientemente activo.
Cuadro 2 Distribución de las gallinas por tratamiento según el nivel de infestación inicial por el ácaro Pterolichus obtusus
Los resultados fueron procesados mediante un análisis de varianza simple (ANOVA) para determinar si existen diferencias significativas entre los valores promedios de ácaros vivos con relación a los tratamientos aplicados y un test de rangos múltiples por Duncan para determinar diferencias entre tratamientos, con un nivel de confianza de 95%. Para este análisis se utilizó el paquete estadístico Statgraphics Plus v. 5.1.
RESULTADOS Y DISCUSIÓN
El ácaro presente en las gallinas del estudio era P. obtusus (Figura 1). Según Rodríguez (2017), P. obtusus y Megninia ginglymura son las especies de ácaros plumícolas más extendidas en Cuba. Las aves del estudio se encontraban parasitadas con niveles de infestación de hasta grave y muy grave. Estos valores coinciden con lo referido por Hernández et al. (2007) y Rodríguez et al. (2015) quienes explican que, en Cuba, las infestaciones por ácaros plumícolas en gallinas son muy abundantes con valores de positividad que oscilan entre 93.5 y 98.3%; y muchas veces se presentan en forma grave.
El confinamiento en jaulas limita las posibilidades de acicalamiento, favoreciendo de esta manera la multiplicación y dispersión de los parásitos externos en los galpones de producción y el aumento de los efectos negativos del parasitismo sobre las aves (Sánchez, 2004). Estos artrópodos, en infestaciones graves ocasionan intenso prurito, irritación, destrucción del plumaje y estados alérgicos generales, con una caída acentuada en la producción de huevos (Hernández et al., 2007; Rodríguez et al., 2018).
En el Cuadro 3 se presentan los resultados de los tratamientos antiparasitarios. Se evidenció que el número de ácaros vivos en tratamientos de los grupos 3, 4 y 5 fueron similares, pero significativamente menores que en los grupos 1 y 2.
Teniendo en cuenta los resultados, se recomienda seleccionar el tratamiento donde se utilizó menos producto porque resulta más económico e implica menor contaminación ambiental. Rodríguez (2019) explica que otro elemento a favor de la aplicación de tratamiento a partir del diagnóstico de infestaciones medias en adelante, es el factor económico. Sin embargo, estos resultados no son definitorios hasta tanto no se evalúe el producto en condiciones de producción, donde es muy posible, que la dosis realmente efectiva sea a razón de 10 ml/l, o incluso superiores, si tenemos en cuenta, las experiencias obtenidas en el país con el empleo de los piretroides en la avicultura. En Cuba, la dosis efectiva de cipermetrina para el control de ectoparásitos en gallinas ponedoras es entre 10 y 15 ml/l (Szczypel et al., 2003; Hernández et al., 2007; Rodríguez et al., 2013).
Cuadro 3 Valores promedios de ácaros Pterolichus obtusus vivos en los tratamientos con las soluciones de antiparasitarios en gallinas ponedoras
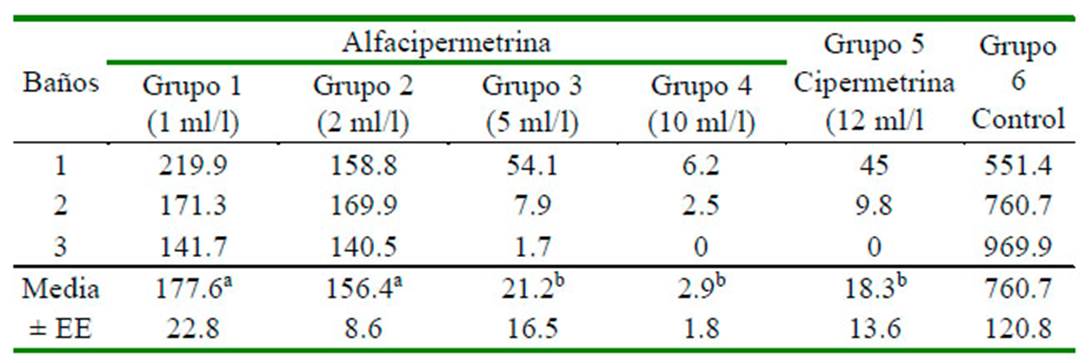
a,b Medias con letras desiguales en una misma fila difieren significativamente (p<0.05)
Según Rodríguez (2019), la intención del tratamiento mediante aspersión no es erradicar los ectoparásitos, sino mantener bajas las poblaciones de los ácaros, a fin de que no se afecte su desempeño productivo. El uso de antiparasitarios debe quedar restringido a los casos necesarios con el fin de evitar el surgimiento de la resistencia de estos fármacos (Anziani et al., 2000). El antiparasitario es un recurso necesario, pero no renovable. La experiencia de más de cinco décadas ha demostrado que no existe antiparasitario «resistente» a la resistencia (Nari y Eddi 2002).
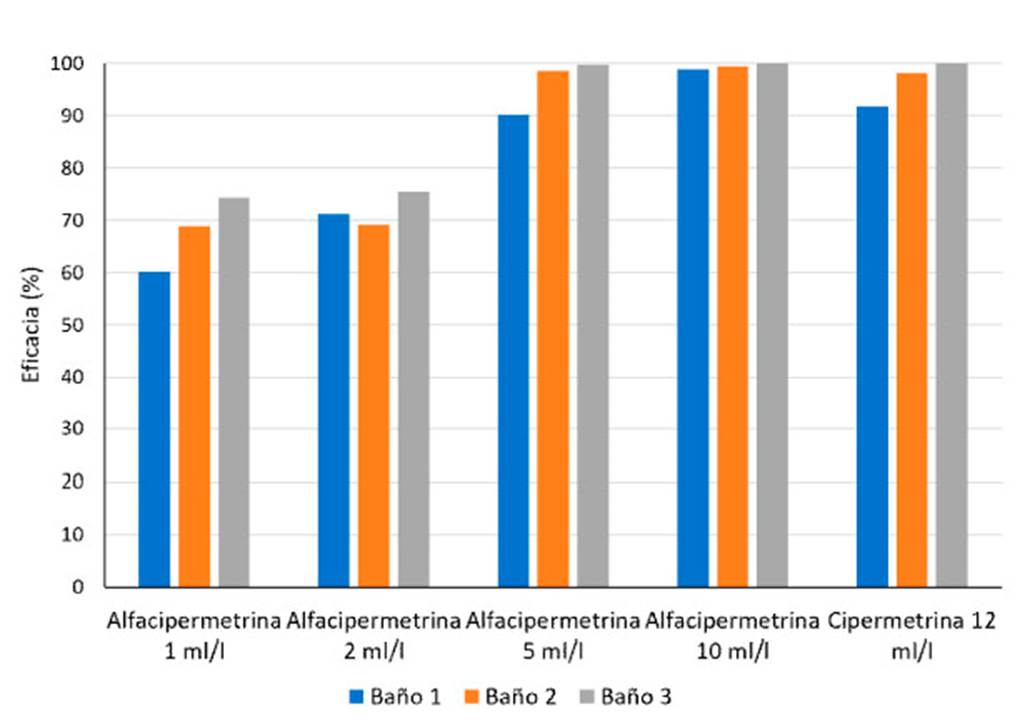
La alfacipermetrina en dosis de 1 y 2 ml resultó insuficientemente activa para el control del ácaro, pues la eficacia fue inferior al 80%., mientras que la dosis de 5 ml resultó altamente efectiva a partir del segundo baño y la dosis de 10 ml resultó altamente efectiva desde el primer baño (Figura 2). Los resultados evidencian que el producto ensayado debe emplearse en dosis entre 5 y 10 ml. Por otro lado, la cipermetrina en dosis de 12 ml resultó altamente efectiva a partir del segundo baño; resultado interesante pues demuestra que a pesar del prolongado tiempo que se ha utilizado en Cuba, aún existen poblaciones de ácaros sensibles a este producto.
CONCLUSIONES
La alfacipermetrina en dosis de 1 y 2 ml/l no resultó efectiva para el control del ácaro Pterolichus obtusus en condiciones de laboratorio, pero fue altamente efectiva en dosis de 5 y 10 ml/l.
La cipermetrina en dosis de 12 ml/L resultó altamente efectiva a partir del segundo tratamiento












 uBio
uBio