INTRODUCCIÓN
El sector ganadero en Perú, según el censo agropecuario del 2012 del Instituto Nacional de Estadística e Informática (INEI) es de 5 156 044 de cabezas de ganado (INEI, 2012), correspondiendo el 78% de la población bovina a la sierra, mayormente en manos de comunidades campesinas y en explotaciones extensivas privadas (Rosemberg, 2018). La población bovina en la región Ayacucho es de 414 066 bovinos, y en la provincia de Parinacochas es de 49 275. En esta provincia, los pobladores tienen como principal actividad económica a la ganadería (Aronés et al., 2003; INEI, 2012).
Debido a la importancia económica que genera el ganado bovino es fundamental mantener un buen estado de salud de los animales, lo cual dependerá principalmente de las condiciones medioambientales y de crianza, así como de la presencia de patógenos. Por tal motivo, el Organismo Mundial de Sanidad Animal (OIE) (OIE, 2021) y el Servicio Nacional de Sanidad Agraria (SENASA) establecen una lista de enfermedades notificables en el territorio nacional, dentro de las cuales se hace mención a la diarrea viral bovina (DVB) (SENASA, 2015). En el país se reportado prevalencias no menores de 35% en Lima y hasta de 96% en los valles de Huancayo; y de 85% en la provincia de Parinacochas (Rivera et al., 2001; Ståhl et al., 2002; Aguilar et al., 2006).
La DVB es una enfermedad infectocontagiosa con amplia distribución mundial. El agente causal presenta un genoma en base de ácido ribonucleico (ARN), y pertenece al género Pestivirus de la familia Flaviviridae (Arauco y Lozano, 2018; Ricci et al., 2019).
Se conocen dos biotipos del virus, el biotipo citopático (CP) origina vacuolización citoplasmática y destrucción de la monocapa celular dentro de pocos días de la infección y surge por mutación de virus no citopático (NCP) y el biotipo no citopático (NCP) que no causa daños visibles, es a su vez el más importante del pestivirus, esto debido a que es el único que atraviesa la placenta, invade el feto configurándose la infección persistente y siendo esta la principal causa de propagación del virus (Nettleton y Entrican, 1995; Fulton et al., 2003; Bolin y Grooms, 2004; Araínga et al., 2010). En cuanto a genotipos, hay diferencias a nivel molecular que han permitido agrupar las cepas como VDVB-1 y VDVB-2. El VDVB-1 cuenta con 11 subgenotipos y es el más difundido entre las poblaciones bovinas, siendo sus cepas empleadas en la elaboración de vacunas; mientras que del VDVB-2 se conocen dos subgenotipos (Araínga et al., 2010; Yesilbalg et al., 2017; Neill et al., 2019); además el genotipo identificado en el país es el VDVB1 (Araínga et al., 2010).
La vía de infección más frecuente de la DVB son los animales persistentemente infectados (PI), los cuales eliminan el virus durante toda su vida por medio de fluidos corporales como la saliva, semen, orina, heces y leche. Los animales con infección aguda también corresponden a una fuente de infección, aunque menos relevante, ya que eliminan el virus en menos cantidad y solo por el tiempo que dure la infección (Lértora, 2003; Brodersen, 2014; Lanyon et al., 2014). La transmisión, por lo tanto, es de tipo vertical u horizontal (Vilcek et al., 2005).
Las infecciones agudas se dan con más frecuencia en animales jóvenes y dependen de la cepa que le infecte, siendo más común la NCP. El periodo de incubación es entre 5 y 7 días (Lanyon et al, 2014). El virus se replica en las células epiteliales de la mucosa oronasal y tonsilas, y se disemina por las vías sanguínea y linfática (Lértora, 2003; Brodersen, 2014). La infección por el VDVB origina inmunosupresión sistémica, potenciando infecciones secundarias ya sean de otros virus o bacterias como: Parainfluenza tipo 3, virus de la Rinotraqueitis Infecciosa Bovina (IBR), Mannheimia haemolytica, Pasteurella multocida, y Mycoplasma bovis, entre otras (Fulton et al., 2002; Lértora, 2003).
El diagnóstico del VDVB consta de signos y lesiones inespecíficas, por lo que es necesario emplear técnicas de laboratorio, ya sea para detectar al virus, anticuerpos o componentes virales. Para la detección de compuestos virales existen diversos métodos serológicos, inmunohistoquímicos y moleculares (Lanyon et al., 2014), siendo el ensayo por ELISA para la detección de anticuerpos uno de los métodos diagnósticos más utilizados por facilitar el análisis de un amplio número de muestras (Stahl et al., 2002; Sandvik, 2005).
El presente estudio tuvo por objetivo determinar la seroprevalencia de anticuerpos contra el VDVB en tres distritos de la región de Ayacucho en 2018.
MATERIALES Y MÉTODOS
El presente trabajo se llevó a cabo en los distritos Chumpi, Coracora y Pullo de la provincia de Parinacochas, ubicada al sur de Ayacucho, Perú. Estos distritos se encuentran a altitudes entre 3000 y 3200 msnm (Aronés et al., 2003). El procesamiento de las muestras se realizó en el Laboratorio de Microbiología de la Universidad Científica del Sur, en Lima. El muestreo de tipo aleatorio fue realizado durante los meses de febrero y marzo de 2018, participando animales mayores a cuatro meses de edad.
El cálculo del tamaño de muestra se realizó según la fórmula de tamaño de muestra para poblaciones finitas (Wayne, 2012). La población total evaluada fue de 27 063 bovinos, siendo de 5339 en Chumpi, 13 988 en Coracora y 7736 en Pullo, tomando como referencia el estudio de Rivera et al. (2001) en el área de estudio con una prevalencia de 85.3%, un nivel de confianza de 95% y un error de 5%, obteniéndose un tamaño mínimo de muestra de 193 animales. Al estratificar las muestras requeridas para cada distrito según su población referencial, se obtuvo 38 animales para Chumpi, 100 para Coracora y 55 para Pullo; sin embargo, se incrementó el muestreo debido a la disponibilidad de reactivos, materiales y factibilidad al momento del muestreo, desarrollándose el estudio con 460 muestras.
Las muestras de sangre fueron colectadas mediante punción en la vena yugular con agujas N.º 18 y tubos Vacutainer de 10 ml. Las muestras fueron llevadas al laboratorio del hospital de la ciudad de Coracora para ser centrifugadas a 1600 g durante 5 minutos. El suero sanguíneo resultante fue mantenido a -20 ºC hasta su análisis.
Se determinó la seroprevalencia de animales positivos a anticuerpos contra Diarrea Viral Bovina, con su respectivo intervalo de confianza al 95% (Wayne, 2012). Así también, se determinó la prevalencia corregida tomando en cuenta los índices de sensibilidad (96%) y especificidad (97%) de la prueba de ELISA utilizando el kit comercial IDEXX BVDV Total Ab®, con sus respectivos intervalos de confianza al 95% (Thursfield, 1990; IDEXX, 2013). Se evaluó la asociación entre la presencia de anticuerpos contra DVB frente a sexo, categoría zootécnica, raza, procedencia y estado reproductivo mediante la prueba de Chi cuadrado (Martínez, 2009).
RESULTADOS
El 79.78 ± 3.64% (367/460) de las muestras presentaron anticuerpos contra el VDVB evidenciando una prevalencia corregida de 82.56 ± 3.44 % (Cuadro 1). A nivel distrital, Pullo presentó la mayor frecuencia de animales positivos (89.74% ± 2.75%, 83/96). En relación a la categoría animal, las vacas presentaron la mayor frecuencia de anticuerpos contra el VDVB (91.96 ± 2.46%, 293/331), mientras que los terneros fueron los menos afectados (46.40 ± 4.52%, 6/13).
En cuanto a la raza, el ganado criollo obtuvo la mayor frecuencia de positivos (85.16 ± 3.22%, 217/264). No se encontraron diferencias significativas con relación al estado reproductivo y la presencia de anticuerpos contra el VDVB.
El diagrama de caja y bigotes muestra una mayor dispersión de edades en los bovinos positivos a Ac-DVB que en bovinos negativos (Figura 1). El rango de edades de animales negativos a la prueba varió entre 4 meses y 8 años, especialmente en edades entre 2 y 4 años. En el caso de los animales positivos al VDVB, la edad varió entre 5 meses y 12 años, siendo la mayoría de 3 a 7 años, con una mediana de 5 años. Para el número de partos, se aprecia valores atípicos para los animales positivos a la prueba diagnóstica. La mayoría de los animales negativos tenía entre 1 y 3 partos.
DISCUSIÓN
La seroprevalencia de anticuerpos frente al VDVB en el presente estudio fue de 79.78 ± 3.64% (367/460) con una prevalencia corregida de 82.56 ± 3.44%, similar a la reportada en un estudio previo en la provincia de Parinacochas de 85.3% (Rivera et al., 2001). Otros estudios en el país presentan un rango variado de prevalencias de la enfermedad; así, 96 y 64.7% en el Valle del Mantaro, Junín (Ståhl et al., 2002 y Arauco y Lozano, 2018, respectivamente), 565 en Lima (Aguilar et al., 2006), 98.04% en la Irrigación de Majes, Arequipa (Huamán et al., 2007), 48.7% en Melgar, Puno (Quispe et al., 2008) 56.2% en Espinar, Cusco (Cárdenas et al., 2011); 27.1% en San Pablo, Cajamarca (Herrera et al., 2011); 75.3% en Ayacucho (Bautista, 2011) y 60.4% en Paucarcolla, Puno (Choquenaira, 2018). Estos estudios demuestran la alta difusión de la enfermedad en el país en las dos últimas décadas, posiblemente debido al rol que cumplen los animales PI en los hatos (Morales et al., 2002), así como por las deficientes prácticas de manejo y ausencia de medidas de prevención y control.
El sexo (hembra) y la categoría zootécnica (vaca) mostraron asociaciones significativas con los niveles de anticuerpos contra el VDVB, pudiendo deberse a una mayor predisposición a eventos de inmunodepresión por el parto y la gestación, lo que facilita la coinfección con otros agentes virales (Betancur et al., 2007; Corro et al., 2017). Por otra parte, se reporta que los animales mayores de dos años presentan mayor frecuencia de presencia de anticuerpos contra el virus, posiblemente debido a una mayor exposición al virus y oportunidad de infección (Aguilar et al., 2006; Quispe et al., 2008; Nava et al., 2013).
Cuadro 1 Seroprevalencia de anticuerpos contra el virus de Diarrea Viral Bovina (n=460) en bovinos de crianza extensiva de los distritos de Pullo, Chumpi y Coracora, Ayacucho (Perú, 2018)
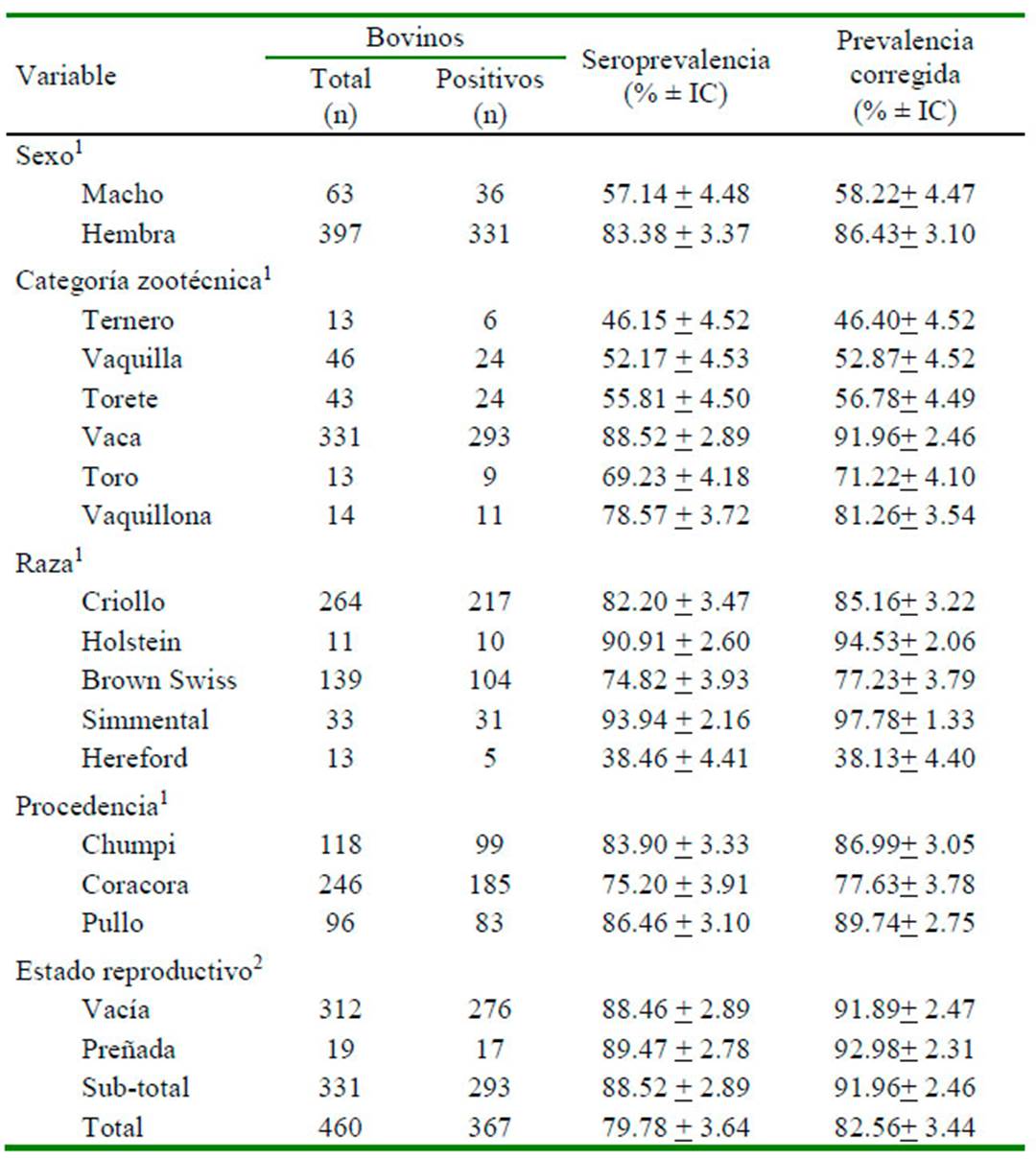
1 La variable sexo, categoría zootécnica, raza y procedencia presentan asociación significativa (p<0.05) frente a anticuerpos al VDVB
2 La variable estado reproductivo no presentó asociación significativa frente a anticuerpos al VDVB
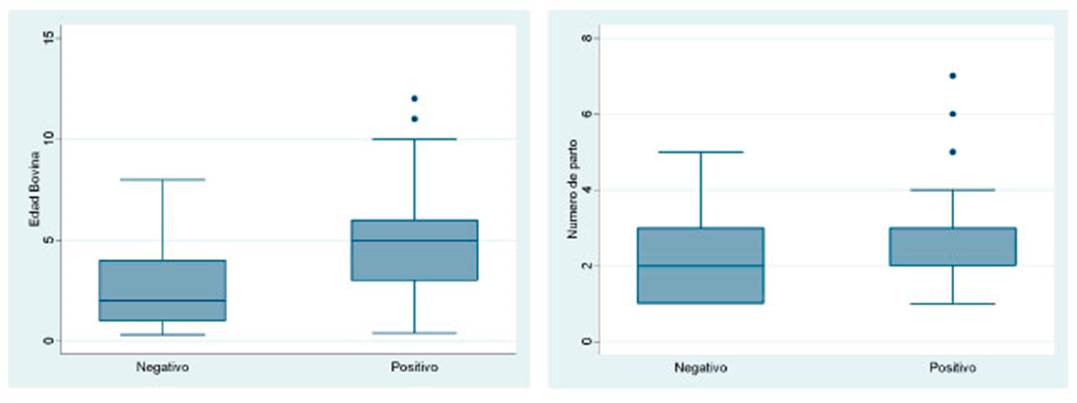
Figura 1 Diagrama de caja y bigotes de bovinos de tres distritos de la provincia de Parinacochas, Ayacucho, según resultado a la prueba diagnóstica de anticuerpos contra el VDVB. Izquierda: Según la edad; Derecha: Según el número de partos
Los bovinos Simmental presentaron una prevalencia corregida de 97.78 ± 1.33% y los Holstein de 94.53 ± 2.06%, siendo estas razas las más afectadas. Sin embargo, esto no guarda relación con estudios previos en los que se establece que los bovinos criollos son más susceptibles a la enfermedad, debido a condiciones de estrés, deficiencias nutricionales e infecciones secundarias (Rivera et al., 2001; Quispe et al., 2008).
La mayor prevalencia corregida frente al VDVB de 89.74 ± 2.75% en el distrito de Pullo (p<0.05), puede deberse a las condiciones de crianza en ese distrito, donde las áreas de pastoreo no presentan delimitaciones entre hatos, además de la falta de conocimiento por parte de los ganaderos acerca de la enfermedad, lo que conlleva a introducir bovinos sin diagnóstico previo (Huamán et al., 2007; Gonzales, 2016).
El presente estudio muestra la difusión del VDVB en el departamento de Ayacucho, la cual se mantiene según evidencias de estudios anteriores (Rivera et al., 2001; Bautista, 2011). La infección por el VDVB ocasiona grandes pérdidas económicas a los ganaderos, por lo que debería, realizarse medidas de control, prevención y erradicación (Evans et al., 2018; Marschik et al., 2018). Por ello, debe promoverse capacitaciones a los técnicos y ganaderos de la región acerca de la enfermedad, implementar medidas de bioseguridad que comprendan un control del ingreso de nuevos bovinos al hato mediante la realización de cuarentenas, detección de bovinos PI y uso de semen certificado libre de enfermedad, así como establecer calendarios de vacunación y la implementación de pruebas diagnósticas como estrategia de erradicación (Vargas et al., 2009; Rypula et al., 2013; Evans et al., 2018; Moenning y Becher, 2018).
CONCLUSIONES
La prevalencia corregida de anticuerpos contra el VDVB fue de 82.56 ± 3.44% en los distritos de Coracora, Pullo, y Chumpi, provincia de Parinacochas, Ayacucho.
Existe asociación estadística significativa (p<0.05) entre sexo, categorías zootécnicas, raza y procedencia con la positividad a anticuerpos contra el virus de la DVB en los distritos de estudio












 uBio
uBio 


