INTRODUCCIÓN
En la reproducción de la especie porcina existen puntos críticos, como la fertilidad del verraco (Savic et al., 2013), la cual ejerce un alto impacto sobre la eficiencia reproductiva del rebaño. Por tal motivo, el éxito de la técnica de inseminación artificial (IA) implica la identificación de verracos con calidad óptima del semen y con capacidad de adaptarse a los cambios climáticos. En países de clima templado, la eficiencia reproductiva depende en parte del efecto de las variaciones estacionales que enfrentan los verracos (Fuentes et al., 1992; Wisokinska et al., 2009; Savic et al., 2013), además de factores adicionales que influyen en la producción seminal, tales como la raza (Knecht et al., 2014; Caisin y Snitco, 2016; Žaja et al., 2016), nutrición (Murphy et al., 2017), edad (Huang et al., 2016; Banaszewska y Kondracki, 2012), socialización (Dysart, 2015), así como el desarrollo testicular (Ford y Wise, 2010) y los cambios histomorfológicos del tejido testicular (Mažeika et al., 2012).
En los países tropicales, de otra parte, no se tiene grandes variaciones con respecto a la duración de luz durante el día, ni grandes fluctuaciones de temperatura ambiental (TA) durante el año. No obstante, se documenta una disminución del rendimiento reproductivo en algunas épocas del año (Suriyasomboon et al., 2004; Peña et al., 2019), producto del estrés calórico (EC) extendido durante varios meses. En este sentido, el EC es uno de los principales factores a tomar en cuenta en el porcino, debido a que posee pocas glándulas sudoríparas en comparación con otras especies que, utilizan la sudoración como mecanismo de disipación calórica, situación que obliga al cerdo a disipar calor mediante el refrescamiento evaporativo (Bracke y Spoolder, 2011).
La capacidad adaptativa o sensibilidad individua l d e l o s verra c o s a fa c t ore s estacionales puede generar variaciones importantes en los eyaculados (Wisokinska et a l., 20 09). De hecho, la eficiencia reproductiva se ve afectada durante y después de la temporada de calor, ya que el EC genera una producción excesiva de cortisol, lo cual afecta la producción espermática y, por ende, la calidad seminal (Olczak et al., 2 015). No obstante, e l r e n di mi en t o reproductivo del porcino se puede mejorar al manejar eficientemente las condiciones ambientales. Por tal motivo, algunas granjas han incorporado mecanismos de ambiente controlado (AC) de refrigeración por evaporación para manejar y disminuir la excesiva TA y humedad relativa (HR) del ambiente que se observa en zonas tropicales, reduciendo así el EC (Suriyasomboon et al., 2004), mejorando la sensación térmica e incrementando el consumo de alimento.
En la actualidad existe poca información del rendimiento de porcinos alojados en AC bajo condiciones de trópico cálido, hecho que motivó a realizar esta investigación para caracterizar los parámetros seminales convencionales de porcinos alojados en un sistema de AC en trópico cálido con TA anual que sobrepasa los 30ºC en los meses más cálidos.
MATERIALES Y MÉTODOS
Ubicación Geográfica
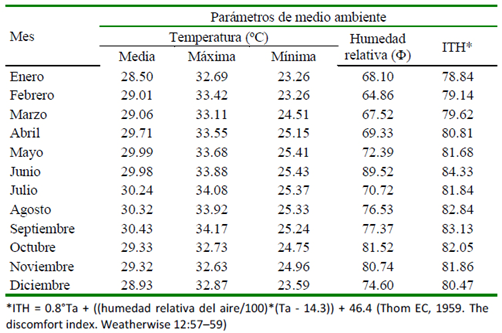
La evaluación se realizó en un sistema de producción de cerdos (PROPORCA C.A.®) ubicado en el municipio San Francisco del Estado Zulia, Venezuela, en una zona caracterizada agroecológicamente como bosque seco tropical cálido con temperatura ambiental, humedad relativa e índice temperatura humedad (ITH) descritos en el Cuadro 1. Los datos climáticos fueron registrados quincenalmente y fueron obtenidos de la estación meteorológica más cercana.
Unidades Experimentales
Se evaluaron 6154 eyaculados provenientes de 95 verracos de la línea comercial Topigs®, con edades comprendidas entre 12 y 36 meses y pesos corporales entre los 180 y 300 kg entre septiembre de 2006 y julio de 2010. Los verracos fueron mantenidos en un área bajo AC de confort higrotérmico (Chore.Time. 2529,676; modelo 8-B1.5); con una dieta diaria (una vez/día) basada en alimento concentrado de exclusividad para verracos (PROPORCA C.A.®), buena disponibilidad de agua, además de un programa sanitario riguroso y estrictas normas de bioseguridad.
Extracción, Colección y Procesamiento del Semen
La extracción se realizó una vez por semana a cada verraco entre las 07:00 y 11:00 h, mediante la técnica de mano enguantada. El eyaculado se colectó en un recipiente plástico de 500 ml con filtro dentro de un termo temperado a 37ºC y debidamente protegido. Previo a la colecta se realizó la eliminación de restos de orina y fluidos de la bolsa prepucial del verraco, acto seguido se obtuvo la fracción rica en espermatozoides. Se trasladó la muestra al laboratorio y se colocó en baño María a 37 ºC para valorar la calidad seminal y procesar las nuestras idóneas. Solo fueron estudiadas las muestras seminales con volumen (V), color, olor y aspecto de acuerdo con los patrones establecidos en la granja: motilidad individual progresiva (MI) >3, número total de espermios por eyaculado (ET)>24x109. Del mismo modo, se descartaron muestras con color y/o apariencia anormal (rojizos, pardos, grises, amarillentos o con presencia de flósculos de pus), o aglutinaciones que denoten contaminación de la muestra seminal.
Características Seminales
El volumen fue determinado en una balanza electrónica, realizando la conversión en mililitros. Se evaluó el color, olor y aspecto del eyaculado. La MI y la concentración (CE) se valoraron con un microscopio óptico (Nikon®). La CE se valoró utilizando una cámara de Neubauer® a 40X; mientras que la MI se determinó con aumento de 10X. La calidad del movimiento de los espermatozoides se realizó bajo una escala de 0 a 5, en el cual: 0 = No se observaron movimientos; 1 = Escaso movimiento, únicamente la cola tiembla ligeramente; 2 = Espermatozoides con desplazamientos en círculos y algunos progresivos; 3 = Movimientos progresivos y sinuosos; 4 = Movimiento progresivo rápido y 5 = Movimientos progresivos muy rápidos. El cálculo de ET y Número de dosis por eyaculado (NDE) se calcularon con fórmulas convencionales.
Cuadro 1 Distribución mensual de la temperatura ambiental (TA), humedad relativa (HR) e índice temperatura humedad (ITH) en el área geográfica bajo estudio durante los años 2006-2010
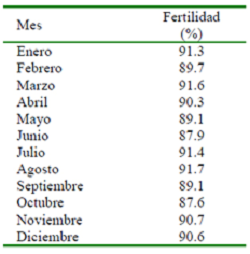
El eyaculado que obtuvo el mínimo de requerimientos establecidos para su uso en IA se procesó con un diluyente comercial (MRA®) y se envasó en botellas plásticas con capacidad para 90 ml con una CE de 4x109 espermatozoides por dosis. Las dosis obtenidas se colocaron a temperatura de laboratorio (22-25ºC) durante 2 h y cubiertas para evitar el exceso de luz. Luego se llevaron a un refrigerador a temperatura de 15-18 °C. El semen fue utilizado a partir de las 18 horas de almacenamiento. La IA se realizó con la técnica tradicional (3 IA/cerda) obteniendo un 90.1% de fertilidad durante el período de evaluación (Cuadro 2).
Análisis Estadístico
Los datos se introdujeron en el programa Microsoft Excel 2008 para Windows, v. 12.0, para luego ser exportados al programa Statistical Analysis System para Windows, v. 9.1.3 (SAS Institute) y ser procesados mediante el Modelo Lineal General (PROC GLM). El mes del año (enero-diciembre) fue evaluado como variable discreta independiente y las variables de calidad seminal: V, MI, CE, ET y NDE) como variables cuantitativas dependiente del efecto mes del año. Las variables líneas genética (maternal y/o terminal de Topigs®) y año de evaluación (2006-2010) se utilizaron como variables discretas independientes para ajustar el modelo estadístico. Cuando se detectaron diferencias significativas, se cuantificaron mediante la prueba de medias mínimas cuadráticas (LSMEANS).
RESULTADOS
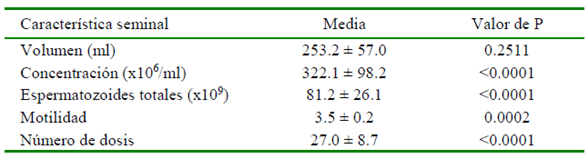
En el Cuadro 3 se presentan los promedios del mes del año sobre MI, CE, ET, y NDE con diferencias altamente significativas entre meses (p<0.01), con excepción del mes del año sobre el V del eyaculado (p=0.2511).
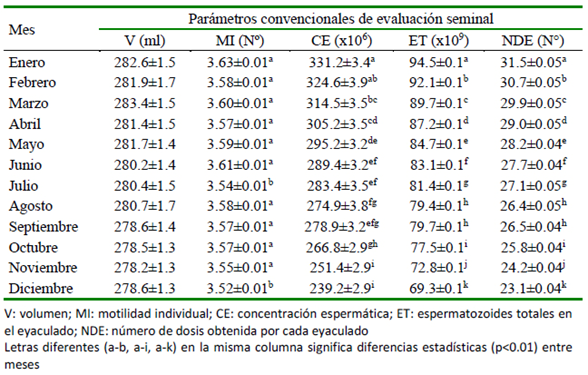
Las características seminales distribuidas por mes del año se pueden observar en el Cuadro 4. No hubo significancia estadística sobre el V, aunque se observó una propensión numérica mayor en los primeros meses del año, especialmente en marzo (283.4 ml). No se observó variación entre los valores de MI en la mayoría de los meses evaluados (enero a junio y septiembre-noviembre); sin embargo, se encontró diferencia significativa (p<0.0001) de estos meses con los valores obtenidos en julio y diciembre, donde se obtuvieron valores inferiores.
Los parámetros CE, ET y NDE presentan rendimientos similares durante todo en el año. No obstante, durante el mes de enero se observaron los mejores valores (331.2x106; 94.5x109 y 31.5, respectivamente), siendo a de más significativamente superiores (p<0.05) a los valores observados en los demás meses. Por otro lado, se distingue una disminución progresiva e importante en los valores promedios para estas características a partir del segundo trimestre del año, para finalmente alcanzar niveles mínimos de 72.8x109 y 69.3x109 para ET, concentraciones de 251.4x106 y 239.2x106/ml, así como NDE de 24.2 y 23.1 en noviembre y diciembre, respectivamente. Así mismo, se puede notar el amplio rango de variación con respecto para estas características dentro y entre los meses evaluados.
DISCUSIÓN
En general, se observaron promedios superiores para volumen, espermatozoides totales e inferiores para concentración y motilidad con respecto a lo reportado por Suriyasomboon et al. (2004) en verracos alojados en ambiente controlado en Tailandia y por Fuentes et al. (1992) en ambiente convencional de trópico venezolano. Además, se pudo observar un amplio rango de variaciones de los eyaculados, lo cual concuerda con lo evidenciado por Wisokiñska et al. (2009), indicando una respuesta adaptativa o de sensibilidad individual de los verracos a determinados ambientes o factores estacionales que pueden generar variaciones importantes en los eyaculados.
Cuadro 3 Efecto del mes del año sobre características seminales y número de dosis por eyaculado de verracos alojados en sistema de ambiente controlado en trópico cálido
Cuadro 4 Características seminales en porcinos alojados en ambiente controlado en trópico cálido según el mes del año
Ahora bien, aunque algunas áreas geográficas tropicales poseen menos variación climática que en otras áreas del mundo, el trópico se caracteriza por poseer diversos microclimas con características diversas entre cada uno de ellos. No obstante, cada microclima posee características agro-climatológicas constantes a lo largo del año, hecho evidenciable en el Cuadro 1 para humedad y temperatura. En este orden de ideas, Ewel et al. (1976) ubican la granja porcina evaluada en una zona de vida caracterizada como bosque seco tropical con presencia de temperaturas altas a lo largo del año, siendo extremas (35 a 40ºC) en ciertas horas del día (10:00 a 16:00) y en algunos meses del año (junio-septiembre).
En este sentido, los valores promedios de las características seminales reportados en esta investigación, exceptuando el volumen, podrían ser explicados por el efecto de alta temperatura y humedad relativa ambiental que afectarían el microclima tanto en los sistemas de alojamiento convencional como en los sistemas de enfriamiento por evaporación de forma controlada; este último descrito en el presente estudio y que concuerda con los reportes en clima tropical en relación a las consecuencias detrimentales de las características seminales de los verracos a pesar de estar en ambientes controlados (Suriyasomboon et al., 2004). Esta situación deriva del hecho que este tipo de ambiente controlado no es capaz de propiciar temperaturas inferiores a los 28ºC cuando la temperatura del medio ambiente supera los 35ºC y humedad relativa elevada. Sin embargo, como esta situación solo ocurre en algunas horas del día, el estrés calórico ocasionado a los reproductores no es permanente, siendo su rendimiento reproductivo adecuado, incluso en los meses de mayor índice humedad-temperatura ambiental.
Otro punto impórtate a destacar, para el mejor entendimiento de los resultados del presente estudio, hace referencia a que, aunque la domesticación puede haber conducido a la pérdida parcial o total de la capacidad de adaptativa a los cambios estacionales en las cerdas y verracos, estos sin embargo, todavía muestran características típicas de su antecesor silvestre en lo referente a mayor actividad de apareamiento durante el periodo de otoño e invierno (Wisokiñska et al., 2009). Bajo esta perspectiva, existe la posibilidad de que el efecto de la estación sea principalmente la consecuencia de las diferencias en el fotoperiodo natural y que la calidad del semen sea mayoritariamente afectada en la época de otoño (Petrocelli et al., 2015). En este orden, otras investigaciones también han demostrado que el fotoperiodo influye en la calidad seminal de los verracos (Yeste et al., 2010; Knecht et al., 2013; Saviæ y Petroviae, 2015). Sin embargo, Gómez (2016) obtuvo menor volumen en el fotoperiodo corto de invierno, pero con incremento de la concentración de manera compensatoria, obteniendo un número uniforme de espermatozoides totales durante todo el año.
Los resultados del presente estudio son en parte similares a otras investigaciones, dado que otros autores confirmaron los efectos de la época en la variabilidad de las características de los eyaculados analizados (Kunowska-slósarz y Makowska, 2011; Pinart y Puigmulé, 2013; Koprianiuk et al., 2014; Zasiadczyk et al., 2015; Fraser et al., 2016). No obstante, estos cambios no son iguales en las diferentes regiones evaluadas (Argenti et al., 2018).
Con respecto al volumen seminal, aunque no se observó efecto del mes sobre esta característica, la concordancia observada con respecto a los demás estudios se deba, posiblemente, a una rápida capacidad adaptativa del cerdo para esta característica (Rivera et al., 2005), y al estar expuesto a menores variaciones diurnas de temperatura ofrecidas por el sistema de alojamiento controlado. De este modo, los valores más altos se obtuvieron entre enero y marzo y los menores valores desde septiembre a diciembre. Este hecho es similar a lo reportado por Fuentes et al. (1992) en Venezuela en ambiente convencional donde el mayor volumen seminal se observó en el primer trimestre; sin embargo, no coincide con los valores de los demás meses.
Por otra parte, la motilidad, es considerada como uno de los parámetros más importantes a medir en los espermatozoides (Kunowska-slósarz y Makowska, 2011), y que en conjunto con la morfología son indicadores sensibles del estrés por calor (Lipenský et al., 2010). En este sentido, se coincide con Fuentes et al. (1992) y con Savic et al. (2013), los cuales demuestran el efecto de la época sobre la motilidad espermática. La concentración siguió un patrón similar a las otras variables estudiadas, con picos superiores en enero y febrero, lo cual contrasta con Fuentes et al. (1992), donde la concentración fue mayor entre mayo y junio. Asimismo, difiere de lo reportado por Peña et al. (2019) en Australia, en el cual el verano tropical (temporada alta de lluvias y calor) entre noviembre y abril, reduce la concentración, además de daños en el ADN de los espermatozoides.
La literatura científica coincide en que la época o, en este caso, el mes del año influye sobre la mayoría de las características seminales; sin embargo, es importante destacar que el clima varía según la localización geográfica (Argenti et al., 2018). Temperaturas más elevadas en determinados momentos del año pueden influir negativamente en el proceso de espermatogénesis en cerdos (Malmgren, 1989), lo cual se ha descrito de manera similar en ratones, con la consecuente disminución de células germinales en los testículos, debido a apoptosis y desregularización de complejos de unión de las células de sertoli (Cai et al., 2011; Li et al., 2013). Así mismo, las diferencias relacionadas con la estacionalidad se ven asociadas al rendimiento metabólico de espermatozoides y actividad de enzimas antioxidantes del tracto reproductivo del verraco (Dziekoñska et al., 2014). Flowers (2015) reporta que la mayoría de los aspectos medioambientales a los que están expuestos los verracos tienen capacidad para influir en la producción y calidad espermática.
CONCLUSIONES
Existe efecto significativo (p<0.05) del mes sobre todas las características seminales con excepción del volumen, siendo la mejor producción seminal para el área geográfica evaluada en los meses de enero y febrero.
El sistema de alojamiento de ambiente controlado no evita la notable variación entre eyaculados dentro y entre los meses evaluados.












 uBio
uBio