INTRODUCCIÓN
El selenio (Se) es considerado como un elemento traza crucial en la nutrición animal (Oropeza-Moe et al., 2015). La función biológica del Se está ligada a las seleno-proteínas, un grupo de proteínas cuyo rol principal es la regulación del estrés oxidativo, fertilidad y función inmune (Labunskyy et al., 2014). La familia de las seleno-proteínas incluye al menos 25 proteínas en eucariotas y al menos 21 seleno-proteínas han sido identificadas en tejidos del cerdo (Liu et al., 2012; Zhao et al., 2015). El Se es requerido para una adecuada función inmune y el insuficiente consumo dietario de Se puede causar severas deficiencias inmunes (McKenzie et al., 1998; Rayman, 2000) y disminuir el rendimiento reproductivo (Surai y Fisinin, 2016). Por lo tanto, una adecuada suplementación de Se puede ayudar a prevenir o aliviar la morbilidad y la mortalidad asociada a desbalances del sistema inmune que pueden conducir a enfermedades inflamatorias (Kalantari et al., 2008; Chen et al., 2014). La suplementación materna con Se provee protección antioxidante esencial a la descendencia (Pappas et al., 2008).
Las cerdas están expuestas a diferentes tipos de estrés, por ejemplo, estrés social, calórico y oxidativo durante el ciclo de producción (Mendl et al., 1992; Tsuma et al., 1995; Munsterhjelm et al., 2008; BerchieriRonchi et al., 2011). El incremento en el estrés oxidativo durante la gestación y lactancia debido a un bajo consumo de compuestos con función antioxidante como el selenio puede afectar negativamente el desarrollo embrionario, el crecimiento y salud fetal, el número de mortinatos y tamaño de la camada, así como el crecimiento de los lechones (Renaudeau y Noblet, 2001; Williams et al., 2013; Zhao et al., 2013). Tamaños pequeños de camadas, incremento en la mortalidad fetal y lechones débiles han sido asociados con deficiencia de Se o vitamina E en cerdas (Wuryastuti et al., 1993). El consumo adecuado de alimento en cerdas de alto rendimiento durante la lactancia es un desafío (Thingnes et al., 2015). La optimización de la composición de la dieta puede mejorar el consumo de alimento de la cerda y mejorar, por lo tanto, la composición del calostro y la leche, conduciendo a un mejor desempeño de la progenie (Krogh et al., 2015).
La composición del calostro y la leche, en cuanto a concentración de Se y de forma, es de notable importancia para los recién nacidos (Rooke y Bland, 2002; Zhan et al., 2011). Un adecuado sistema antioxidante en las cerdas ayuda a prevenir los efectos relacionados con el estrés oxidativo en la descendencia (Luo et al., 2006; Surai y Fisinin, 2016). De manera general, hay dos fuentes de Se que se emplean en la alimentación animal: selenio-orgánico (SeO) (selenio-levadura, selenio-metionina) y selenio-inorgánico (SeI) (selenito de sodio) (National Research Council, 2012). En el selenio-levadura entre el 60 al 70% es selenio-metionina (SeMet) y 10 al 15% es selenio-cisteína (Bierla et al., 2013).
Se ha reportado que fuentes de selenio en la dieta afectan marcadamente las concentraciones de Se en diferentes órganos y tejidos, y que la suplementación de Se orgánico incrementa de manera más efectiva la concentración de Se en calostro y leche en comparación a la forma inorgánica (Dalgaard et al., 2018), aunque también se han reportado resultados contradictorios, lo cual genera incertidumbre en los profesionales dedicados a la nutrición y alimentación de cerdos. El metaanálisis es un método estadístico que resume y cuantifica el conocimiento adquirido a través del análisis de los resultados de investigaciones ya publicados (Sauvant et al., 2008). Este procedimiento permite obtener conclusiones más sólidas y de mayor precisión que aquellas de los trabajos individuales y, por lo tanto, una mayor potencia estadística (Catalá-López y Tobías, 2014). El objetivo de esta investigación fue determinar el efecto de la suplementación de Se (inorgánico/orgánico) sobre el desempeño reproductivo, productivo y estado antioxidante en cerdas y su progenie mediante el uso de metaanálisis.
MATERIALES Y MÉTODOS
Se realizó una búsqueda electrónica de artículos científicos en revistas indexadas con revisión de pares basado en la metodología de Bougouin et al. (2014). Para este efecto se consultaron las bases de datos CAB direct, Elsevier biobase-CABS, Google Scholar, MEDLINE, PubMed, Science Direct, Scopus, Academic Search Complete, CAB Abstract, y el Directory of Open Access Journals, utilizando un conjunto de palabras clave: selenio, Se, dieta, alimento, nutrición, orgánico, inorgánico, cerdas, glutatión peroxidasa, GSH-Px y sus equivalentes en inglés, sin restricción de fecha.
Se revisaron artículos realizados en cerdas en etapa reproductiva en los cuales el selenio fue administrado a través de la dieta y en animales sanos. Los artículos debían incluir información respecto al número de unidades experimentales por tratamiento, no menos de dos tratamientos, con fuentes de selenio, sea inorgánica: selenito de sodio u orgánica: selenio-levadura, suplementación de Se, Zn, Cu, vitamina A y E nutrientes en premezclas comerciales. Solo se incluyeron niveles de 3 ppm o inferiores de selenio suplementados en la dieta para evitar efectos nocivos en el consumo o interacción con otros minerales en la dieta (National Research Council, 2012; PIC, 2016; Rostagno et al., 2017). Adicionalmente, los artículos debían incluir los valores de la media (promedio) y alguna medida de variación de la variable en estudio.
Los datos fueron analizados con el programa MIX 2.0 Pro en Microsoft Excel (Bax, 2016). Se determinó el tamaño del efecto global de la suplementación de selenio sobre el número de lechones nacidos totales, nacidos vivos, nacidos muertos, lechones destetados, peso promedio del lechón al nacimiento, al destete, concentración de Se en sangre (cerda y lechones), calostro y leche, y actividad de la enzima glutatión peroxidasa en suero (cerdas y lechones), calostro y leche; concentración de Se en hígado, músculo y riñón de lechones por diferencia de medias (DM), con intervalos de confianza al 95%.
La heterogeneidad se evaluó por medio del índice de inconsistencia (I2) (Higgins y Thompson 2002). El sesgo de publicación se evaluó mediante la prueba de regresión de Egger (Egger et al., 1997). Se utilizó un modelo de efectos aleatorios según las recomendaciones de Borenstein et al. (2011) y Sauvant et al. (2008). Se ejecutaron 17 metaanálisis que incluyó un total de 204 registros de comparación y un n= 4698, a partir de 12 artículos científicos: Mahan y Kim (1996), Mahan (2000), Kim y Mahan (2001a), ªara et al. (2005), Yoon y McMillan (2006), Quesnel et al. (2008), Svoboda et al. (2008), Hu et al. (2011), Zhan et al. (2011), Ma et al. (2014), Chen et al. (2016a, 2016b).
Para los cálculos correspondientes, el grupo tratamiento consistió en selenio orgánico (selenio-levadura) y el grupo control en selenio inorgánico (selenito de sodio). Las razas involucradas en el metaanálisis fueron Landrace, Large White, Yorkshire e híbridos Yorkshire-Landrace y Duroc-Hampshire x Yorkshire-Landrace. La heterogeneidad entre estudios se determinó mediante meta-regresiones utilizando como covariables: número de unidades experimentales por tratamiento, nivel de suplementación en la dieta de selenio, cobre, zinc, vitaminas A y E. No se consideraron como covariables al número de animales por unidad experimental ni el número de animales muestreados por unidad experimental pues para todos los estudios utilizados el valor fue de 1.
RESULTADOS
La suplementación dietética de selenio orgánico en cerdas presenta una tendencia a mejorar el rendimiento reproductivo (Cuadro 1). Sin embargo, la diferencia no fue significativa: número de lechones nacidos totales (p=0.869), nacidos vivos (p=0.758), nacidos muertos (p=0.426). De otra parte, se aprecia una mejora evidente en el peso promedio del lechón al nacimiento (p=0.031) en cerdas que recibieron selenio inorgánico que en aquellas que recibieron Se orgánico (1.469 vs. 1.455 kg). No hubo diferencia significativa en el peso del lechón al destete (p=0.105), pero los lechones de la fuente orgánica presentaron pesos ligeramente superiores (5.353 kg) frente a los lechones destetados de la fuente inorgánica (5.266 kg). La suplementación de SeO determina una mayor concentración de Se en sangre en las cerdas (p<0.00001) en comparación a la fuente inorgánica; sin embargo, no se encontró diferencia en la actividad de GSH-Px (medida en suero) entre ambas fuentes (p=0.119).
Cuadro 1 Resumen de la variable respuesta y tamaño de efecto en cerdas y su progenie al suplementar selenio orgánico (selenio-levadura) a los grupos tratados y selenio inorgánico (selenito de sodio) a los grupos control en un estudio de metaanálisis
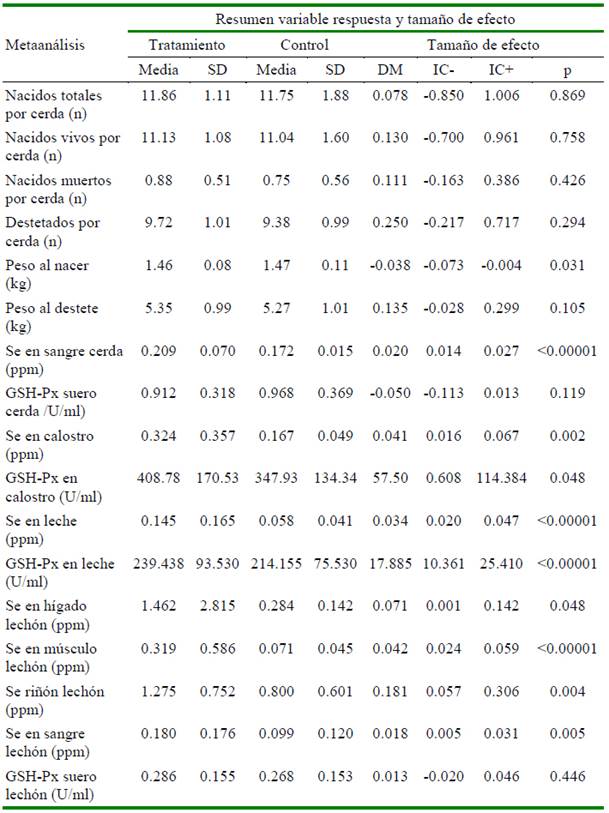
IC= intervalo de confianza al 95%; p= valor de probabilidad
La concentración de Se en calostro fue de aproximadamente el doble (p=0.002) en las cerdas que se alimentaron de SeO (0.324 ppm) en comparación con la fuente inorgánica (0.167 ppm). Una tendencia similar presentó la concentración de Se en leche donde SeO triplicó (p<0.00001) la concentración (0.145 ppm) vs. SeI (0.058 ppm). Respecto a la actividad de GSH-Px, se encontró que el SeO versus SeI provoca un incremento significativo (p<0.05) en la actividad de esta enzima, tanto a nivel de calostro (408.78 vs. 347.93 U/ml) como en la leche (239.43 vs. 214.15 U/ml). Los lechones provenientes de las cerdas que recibieron SeO concentraron en mayor medida (p<0.05) el Se en los diferentes órganos medidos en comparación con el Se I: hígado 1.462 vs. 0.284 ppm; músculo 0.319 vs. 0.071 ppm; riñón 1.275 vs 0.8 ppm y sangre 0.18 vs 0.099 ppm. La actividad de la enzima GSH-Px medida en suero en lechones presentó el mismo comportamiento que en sus madres; esto es, no se encontró diferencia (p=0.446) entre la fuente orgánica (0.286 U/ml) frente a la inorgánica (0.268 U/ml).
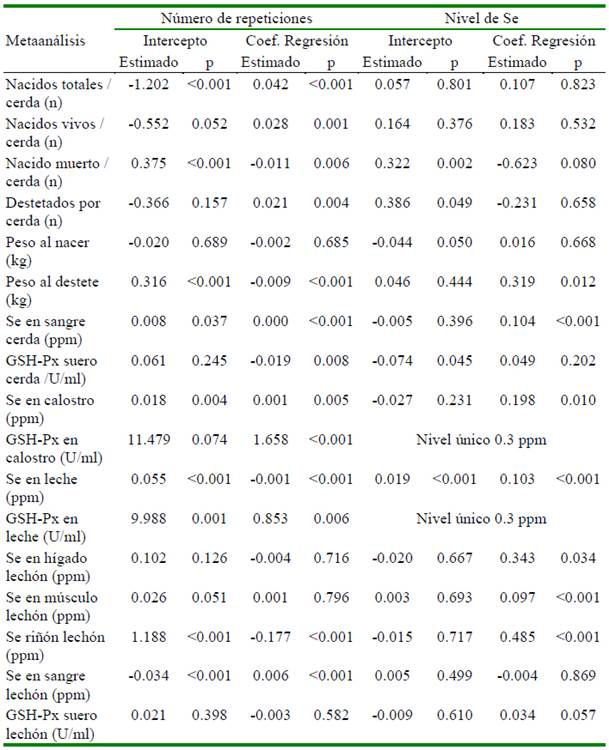
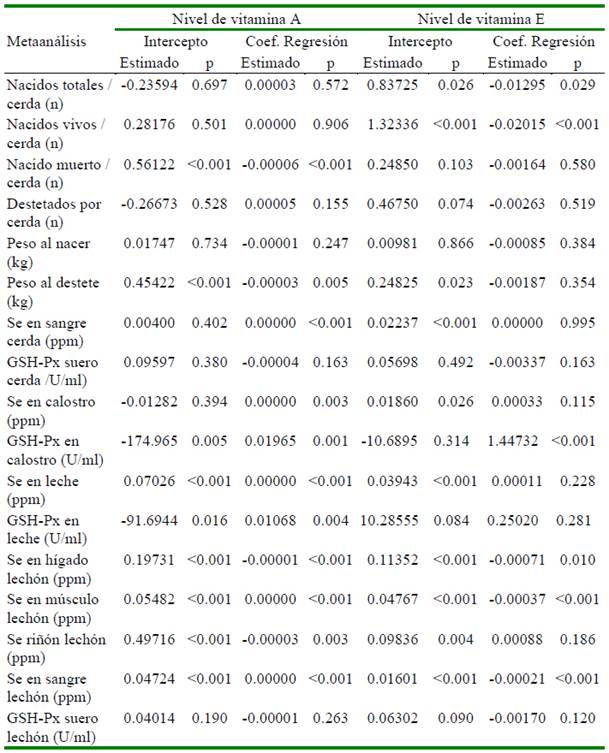
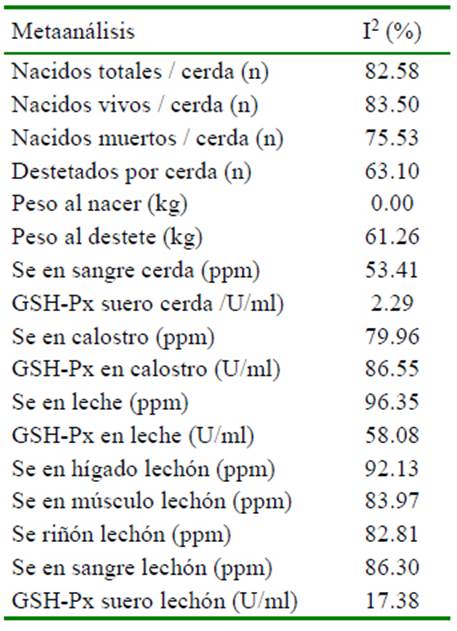
La heterogeneidad de los resultados en las variables en las cerdas y su progenie por efecto de la suplementación con selenio en el metaanálisis se presenta en el Cuadro 2. El análisis de meta-regresión determinó que el número de repeticiones afecta de manera significativa (p<0.05) cada una de las variables evaluadas, excepto al peso promedio del lechón al nacimiento (p=0.6853), concentración de Se en hígado (p=0.716), músculo (p=0.796) y actividad de GSH-Px en suero (p=0.582) medidas en lechón (Cuadro 3). El nivel de selenio suplementando a través de la dieta tiene un efecto significativo sobre peso promedio del lechón al destete, concentración de Se en sangre (cerda), concentración de Se en calostro y leche, concentración de Se en hígado, músculo y riñón en lechones (Cuadro 3). Adicionalmente, se aprecia que los niveles de otros nutrientes como Zn, Cu, vitaminas A y E afectan algunas de las variables evaluadas (Cuadros 4 y 5).
Cuadro 2 Índice de inconsistencia (heterogeneidad) en variables evaluadas en cerdas y su progenie al suplementar selenio orgánico (selenio-levadura) a los grupos tratados y selenio inorgánico (selenito de sodio) a los grupos control en un estudio de metaanálisis
DISCUSIÓN
En el presente trabajo se puede apreciar que no existe diferencia en las variables reproductivas para cualquiera de las fuentes de selenio analizadas, excepto para la variable peso promedio del lechón al nacimiento, que resultó más alta para SeI (p=0.031). Los lechones del grupo SeI pesan 38.39 g más en comparación con los lechones procedentes de cerdas que recibieron SeO. Sin embargo, al destete los lechones SeO presentaron mayor peso en comparación con los lechones SeI, 5.35 vs. 5.27 kg respectivamente. Si bien la diferencia no fue significativa en el peso al destete (p=0.104), los lechones del grupo SeO pesaron 135.26 g adicionales, lo cual está asociado a una mejora en la actividad de las enzimas pancreáticas (amilasa, lipasa y proteasa) y del estado de la glándula tiroides como lo demuestra el trabajo realizado por Zhan et al. (2011). Además, hay un mejor estado inmunitario generado por la forma orgánica (Dalgaard et al., 2018), de esta manera el lechón destina los nutrientes ingeridos a la ganancia de peso y no hacia reacciones catabólicas.
De los metaanálisis realizados en este trabajo de investigación se puede apreciar claramente como la suplementación de selenio orgánico permite concentrar mayor cantidad de este micromineral en el suero de la cerda (DM=0.020; p<0.00001), su calostro (DM=0.041 ppm; p= 0.00161) y leche (DM=0.033 ppm; p<0.00001). Lo anterior está relacionado a que el SeO se absorbe en mayor medida (70-90%) en comparación al SeI (<60%) (Arnér, 2010) y a que en la cerda el SeO forma reservas corporales de Se a nivel muscular en forma de selenio-metionina y selenio-cisteína que son liberados durante etapas de mayor exigencia metabólica como la etapa final de la gestación y la lactancia (Dalgaard et al., 2018), incrementando de esta manera el nivel de Se en calostro y leche. Estudios realizados en vacas lecheras muestran que la suplementación de SeO también incrementa la concentración de Se en leche, principalmente en la proteína en forma de SeMet (Phipps et al., 2008).
En lechones se aprecia que aquellos que se alimentaron del calostro y leche provenientes de cerdas que recibieron SeO, concentraron en mayor medida este mineral traza. Es así que, hígado (DM= 0.071 ppm; p=0.048), músculo (DM= 0.041 ppm; p<0.00001), riñón (DM=0.181 ppm; p=0.004) y sangre (DM= 0.018 ppm; p=0.004) presentaron diferencias significativas frente a los lechones provenientes de cerdas alimentadas con SeI. La mayor concentración de Se encontrada en los órganos en los lechones (SeO) está asociado a que ingieren mayor cantidad de selenio a través del calostro y leche, además de recibirlo en una forma también orgánica selenio-metionina y selenio-cisteína. De otra parte, en los estudios que se midió la concentración de Se, se aprecia que el efecto entre estudios fue inconsistente (I2 >50%) (Cuadro 2). Los análisis de meta-regresión determinaron que el nivel de Se en la dieta tiene efecto significativo sobre la concentración de Se medida en los diferentes tejidos, siendo que a medida que se incrementa el nivel de Se en la dieta aumenta la concentración de Se tisular (Cuadro 3).
La actividad de la enzima GSH-Px medida en el suero de las cerdas fue ligeramente superior en aquellas alimentadas a partir de la forma inorgánica 0.968 U/ml frente a la forma orgánica 0.912 U/ml; sin embargo, esta diferencia no fue significativa (p=0.119). Esta respuesta también se ha observado en cerdos en etapas de crecimiento y engorde en donde aquellos que recibieron selenito de sodio presentaron una mayor actividad de esta enzima (Kim y Mahan, 2001b). De manera similar se encontró que pollos de engorde que recibieron selenito de sodio presentaron mayor producción y actividad de GSH-Px al compararlo frente a SeO (Ahmad et al., 2012). Así se demuestra que no existe una relación entre el nivel de Se en sangre con la actividad de la enzima GSH-Px medida en suero, tal y como lo demuestra el metaanálisis realizado en pollos de engorde por Zoidis et al. (2014). A nivel de calostro y leche se determinó que la suplementación de SeO genera una mayor actividad de la enzima GSHPx vs. la fuente inorgánica (p<0.05); sin embargo, en lechones la actividad de esta enzima presenta valores similares entre aquellos alimentados por cerdas que recibieron SeO y aquellas que recibieron SeI (DM= 0.01299; p=0.445), siendo además un efecto consistente como lo demuestra su baja heterogeneidad (I2=17.38%). De esta manera, también se puede apreciar que a pesar de que los lechones (SeO) que mantenían niveles altos de Se en sangre (p<0.05) frente a los lechones (SeI) no presentaron mayor actividad de la enzima GSH-Px. Esto puede indicar que la medición de GSH-Px no es el mejor indicador del nivel de ingesta de Se a través de la dieta.
Desde el punto de vista económico resulta más barato la inclusión de SeI, por lo que las dietas podrían incluir únicamente la forma inorgánica para las etapas de producción recría, crecimiento y finalización (engorde). Sin embargo, la forma inorgánica de Se tiene algunas desventajas, que se relacionan con una interacción con otros minerales, una toxicidad relativamente alta, una baja eficiencia de transferencia a la leche, huevos y la incapacidad de construir y mantener las reservas de Se en el cuerpo (Surai, 2006; Surai y Fisinin, 2014). En cerdas se recomienda suplementar SeO debido a que el selenio orgánico permite acumular reservas de Se en tejidos, principalmente en músculos, en forma de SeMet que se puede usar en condiciones de estrés para mejorar las defensas antioxidantes (Surai, 2006; Surai y Fisinin 2014, 2015); además, el Se orgánico en forma de SeMet proporciona un transporte efectivo de Se de la cerda al feto y lechón recién nacidos a través de placenta, calostro y leche (Surai 2006; Close et al., 2008). Adicionalmente, en humanos se ha demostrado que la retención de SeMet fue de 363 días comparado frente a los 147 días para el selenito de sodio, indicando una eficiente reutilización de la SeMet (Duntas y Benvenga, 2015). Esto es importante puesto que las reservas de tejido de selenio de la cerda se agotan con el avance de la paridad, las reservas de tejidos no se movilizan fácilmente, y el tejido mamario de las hembras más viejas no puede incorporar ni transferir selenio inorgánico dietético o reservas de Se en tejidos a la leche tan eficazmente como las cerdas jóvenes (Mahan y Peters, 2004).
Otros micro-nutrientes como el Zn, Cu (Collins, 2016; Ighodaro y Akinloye, 2018), vitaminas A (Chew, 1996) y E (Wang et al., 2017) también forman parte del sistema de defensa antioxidante del organismo. En el Cuadro 4 se aprecia que los niveles de Zn y Cu no tienen efecto significativo sobre la actividad de la enzima GSH-Px en ninguno de los tejidos medidos. Por su parte, los niveles de las vitaminas A y E tienen efecto significativo cuando la actividad fue medida en calostro y leche (Cuadro 5). Urso et al. (2015) encontraron que la vitamina E en pollos favorece la producción de GSH-Px; asimismo, en tanto que Aaron y Hays (2004) resaltan la importancia de considerar el número de repeticiones a fin de poder detectar diferencias significativas en caso existan. Precisamente a través del estudio de meta-regresión en este estudio se determinó que el número de repeticiones por tratamiento afectaron de manera significativa (p<0.05) 13 de las 17 variables estudiadas (Cuadro 3). Finalmente, no se encontró sesgo de publicación en 16 de las 17 variables estudiadas, siendo la única variable que presentó sesgo fue el peso promedio del lechón al nacimiento.
Cuadro 4 Meta-regresión del nivel de Zn y Cu sobre la respuesta productiva de cerdos y lechones que recibieron dietas suplementadas con selenio
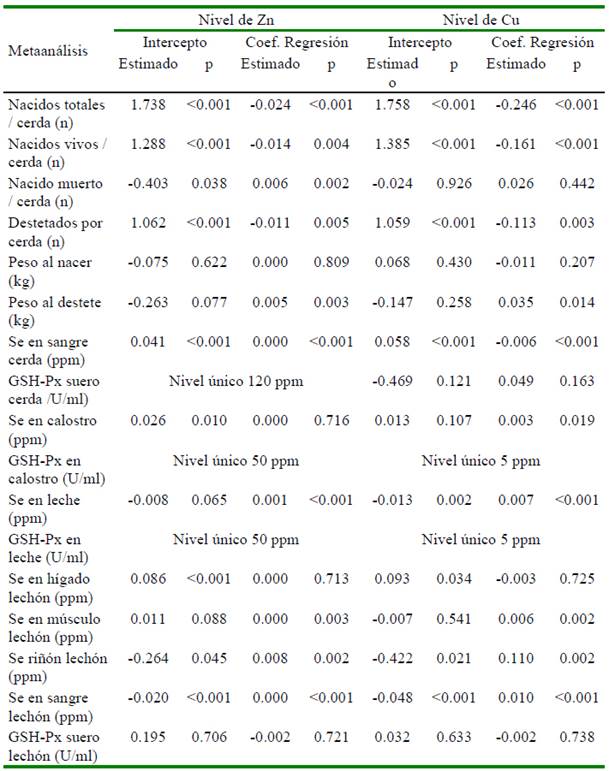
p= valor de probabilidad
CONCLUSIONES
Las variables reproductivas en cerdas no se ven afectadas por la fuente de Se suplementada a través de la dieta (orgánico/inorgánico).
El SeO permite concentrar en mayor medida al Se tanto en la cerda (sangre), calostro, leche y tejidos en su progenie (hígado, músculo, riñón y sangre).
La mayor concentración tisular de Se alcanzado por la fuente orgánica no fue suficiente para incrementar la actividad de la enzima GSH-Px (suero) en cerdas ni en lechones, no así en calostro y leche.












 uBio
uBio