INTRODUCCIÓN
El estudio del semen de los mamíferos como una unidad, con una serie de características de calidad y movilidad definidas como un todo, ha sido reevaluado gracias a diversos estudios que demuestran la gran heterogeneidad que existe entre los espermatozoides, que se atribuyen a diferencias en los estados fisiológicos que transcurren durante la vida de estos (Núñez-Martínez et al., 2006; Maroto-Morales et al., 2012). Esto ha dado paso al estudio de las subpoblaciones espermáticas, que se encargan de clasificar un mismo eyaculado en varias secciones según sus propiedades, con el fin de determinar los espermatozoides más aptos para el proceso de fertilización (Dorado et al., 2010; Bravo et al., 2011). Como resultado de esto, se ha evidenciado que la actividad reproductiva de diversas especies de mamíferos (Dorado et al., 2011, 2013; Maroto-Morales et al., 2012; Vicente-Fiel et al., 2013; Estrada et al. 2017; Luna et al., 2017) se encuentra influenciada por las subpoblaciones espermáticas que presentan sus eyaculados.
El análisis, evaluación y clasificación de las subpoblaciones es un proceso que requiere de un sistema especial que permita obtener gran cantidad de información sobre las características de calidad, movilidad y morfología de una muestra de semen (Bergstein-Galan et al., 2017). El Sistema de Análisis Asistido por Computadora (CASA) constituye uno de los métodos más confiables para realizar dicho estudio, según las investigaciones realizadas en las últimas décadas (Muiño et al., 2008; Luna et al., 2017).
Si bien, cada eyaculado presenta una serie de subpoblaciones con características definidas, existen procesos que pueden afectar su distribución. En particular, durante los procesos de refrigeración de semen, las principales variables que influyen en la distribución de las subpoblaciones son la temperatura, el tiempo y el diluyente utilizado (Rodríguez-Gil et al., 2007; Dorado et al., 2010; Gallego et al., 2017). Estos pueden generar cambios en la calidad del eyaculado, afectando el resultado de la inseminación artificial (Souza et al., 2018). Así mismo, se han estudiado las implicaciones de la congelación y descongelación seminal sobre las subpoblaciones de espermatozoides de varias especies (Flores et al., 2008).
Existen pocos reportes sobre el estudio de las subpoblaciones espermáticas en conejos, mayormente relacionadas con la predicción de la fertilidad del semen y el tamaño de las camadas (Quintero-Moreno et al., 2007). Otro aspecto para considerar sería el posible efecto de la composición de los diluyentes utilizados. En conejos se reporta el uso de una variedad de diluyentes para la refrigeración del semen, entre estos, Tris, ácido cítrico, glucosa, fructosa, HEPES (ácido 4- [2-hidroxietil] -1-piperazina-metanosulfónico) y yema de huevo (Roca et al., 2000; López-Gatius et al., 2005; Aksoy et al., 2010; El-Seadawy et al., 2017). Además, se tienen diluyentes comerciales basados en dextrosa, citrato sódico y acetato potásico (Suárez et al., 2020). Sin embargo, no se disponen de estudios sobre la influencia de la composición de los diluyentes en las subpoblaciones espermáticas de esta especie, así como, sobre la influencia de otros componentes que, como los caseinatos de sodio, han mostrado efectos favorables sobre varios parámetros cinéticos de los espermatozoides (Lagares et al., 2012; Martins et al., 2016). Por lo tanto, el objetivo de esta investigación fue evaluar el efecto de la composición del diluyente de semen sobre las subpoblaciones espermáticas del semen refrigerado de conejo.
MATERIALES Y MÉTODOS
Animales y Muestras Seminales
Se utilizaron 10 conejos (Oryctolagus cuniculus) machos de la raza Californiano, de 6 a 18 meses de edad. Los animales fueron alimentados dos veces al día, con una dieta a base de concentrado y forraje. Los animales tenían actividad reproductiva cada semana y fertilidad comprobada mediante el nacimiento de crías vivas. El semen se colectó con vagina artificial PLQ-135 (Pledge Agro, China), en presencia de una hembra para mejorar el estímulo sexual. Se obtuvieron tres eyaculados de cada macho. Se evaluó la movilidad individual de los espermatozoides mediante microscopía óptica. Solo se procesaron los eyaculados con una movilidad superior al 70% (Mocé et al., 2010). El comité de ética del Politécnico Jaime Isaza Cadavid otorgó el aval en la categoría de riesgo mínimo según Resolución 8430 de 1993 (Aval CEPI 21052018).
Dilución y Refrigeración del Semen
Cada eyaculado se dividió en cuatro alícuotas iguales, las cuales se diluyeron individualmente en uno de cuatro diluyentes (tratamientos), cuya composición básica consistió en T1: leche descremada y azucares (EquiPlus®, Minitube, Alemania); T2: dextrosa, citrato sódico y acetato potásico (MRAbit®, Kubus, España); T3: caseinatos de sodio, fosfatos y azúcares (PoliCryo, European Patent EP3169154B1); y T4: tris-ácido cítrico y yema de huevo (Triladyl®, Minitube). La dilución se realizó a temperatura ambiente (~19 ºC) y el semen se llevó a una concentración final de 80 x 106 espermatozoides/ml. Una vez diluido, el semen se sometió a refrigeración a 16 ºC durante 72 horas (Roca et al., 2000; López-Gatius et al., 2005).
Evaluación de las Subpoblaciones Espermáticas
Las distribuciones de las subpoblaciones espermáticas fueron evaluadas después de la dilución y cada 24 horas utilizando el sistema Sperm Class Analyzer (SCA® v. 5.1, Microptic, España) y un microscopio de contraste de fase (Eclipse E200, Nikon) con una cámara digital (Scout SCA780, Basler, USA). El software fue configurado para la especie con cubreobjetos de 20 x 20 mm, óptica en lente de ph-, gota de 7 µl y platina térmica a 37 °C. Los parámetros evaluados fueron: velocidad rectilínea (VSL), velocidad curvilínea (VCL), velocidad media (VAP), amplitud lateral de la cabeza (ALH) y frecuencia de batido de la cola (BCF).
Se empleó la clasificación predeterminada por el software para la clasificación de las subpoblaciones espermáticas, según los criterios de la Organización Mundial de la Salud (OMS). Se establecieron cuatro tipos de espermatozoides: Tipo A(espermatozoides rápidos progresivos), Tipo B (espermatozoides rápidos y espermatozoides medios progresivos), Tipo C (espermatozoides medios y espermatozoides lentos), y Tipo D (espermatozoides estáticos). A partir de la VCL, los espermatozoides fueron clasificados como estáticos (<15 µm/s), lentos (15-24 µm/s), medios (25-50 µm/s) y rápidos (>50 µm/s). La progresividad fue definida como aquellos espermatozoides con un índice de rectitud (STR) mayor a 70%, donde STR = (VSL/ VAP) x 100. En el análisis se incluyeron 1000 espermatozoides por cada eyaculado y tratamiento.
Análisis Estadístico
Se realizó mediante el ajuste de modelos lineales con la inclusión de los efectos fijos del conejo, el tiempo de refrigeración y de la interacción entre el tratamiento y la subpoblación espermática. Se calculó un índice de velocidad seminal (SVi) mediante el análisis de componentes principales (PCA) de los parámetros cinéticos de cada subpoblación espermática. Se extrajeron los eigenvectores para establecer la ecuación de SVi (Núñez-Martínez et al., 2006). Se evaluó la normalidad de los datos mediante la prueba de Shapiro-Wilk y las diferencias entre medias mediante la prueba de Tukey (p<0.05). Todos los análisis se realizaron mediante el software SAS v. 9.2 (SAS, USA).
RESULTADOS
El diluyente utilizado para la refrigeración seminal influyó sobre las proporciones de espermatozoides clasificados en diferentes subpoblaciones, según su velocidad y progresividad. Los efectos fijos del conejo, el tiempo de refrigeración y de la interacción entre el tratamiento y la subpoblación espermática fueron significativos para todos los modelos lineales ajustados para los diferentes parámetros seminales (p<0.0001). La Figura 1 muestra la distribución de las subpoblaciones espermáticas para cada diluyente y tiempo de refrigeración.
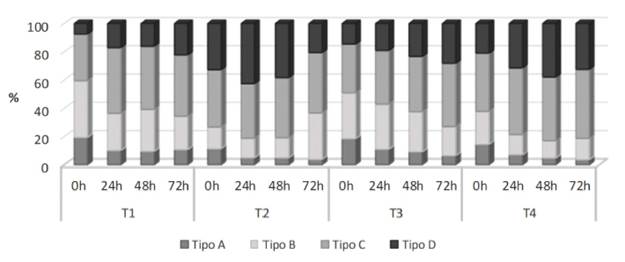
Figura 1. Distribución de subpoblaciones de espermatozoides en el semen de conejo según el diluyentes y tiempo de refrigeración T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube). Tipo A: espermatozoides rápidos progresivos. Tipo B: espermatozoides rápidos y espermatozoides medios progresivos. Tipo C: espermatozoides medios y espermatozoides lentos. Tipo D: espermatozoides estáticos
Cuadro 1 Parámetros cinéticos del semen de conejo por tratamiento después de la dilución (hora 0)
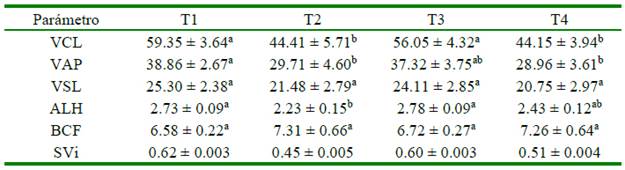
T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube)
VCL: Velocidad curvilínea. VSL: Velocidad rectilínea. VAP: Velocidad promedio. ALH: Amplitud lateral de la cabeza. BCF: Frecuencia batido de cola. SVi: índice de velocidad seminal
Los resultados están expresados como media ± error estándar. Superíndices diferentes dentro de filas indican diferencias significativas entre tratamientos (p<0.05)
La dilución del semen en cada tratamiento generó una respuesta variable en los parámetros cinéticos de los espermatozoides. Se calculó el SVi como una forma de expresar integralmente la cinética espermática (Cuadro 1).
Las subpoblaciones espermáticas establecidas presentaron variaciones en la magnitud de los parámetros cinéticos evaluados. En la Figuras 2, 3 y 4 se presentan los resultados de las velocidades espermáticas (VCL, VSL y VAP) para las subpoblaciones de espermatozoides de los tipos A, B y C, respectivamente.
La ALH mostró de manera reiterada resultados mayores para T1 y T3 en los diferentes tiempos de refrigeración y subpoblaciones (Figura 5). La BCF presentó valores mayores para T2 y T4 en la subpoblación de espermatozoides tipo A a las 0, 24 y 48 h de refrigeración (Figura 6), mientras que no se observó una tendencia concreta en las diferencias entre los tratamientos para las subpoblaciones de tipo B y C.
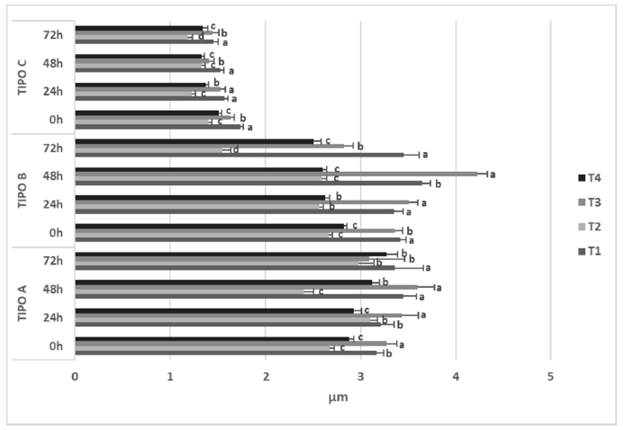
Figura 5. Amplitud lateral de la cabeza (ALH) de las subpoblaciones espermáticas por diluyente y tiempo de refrigeración. T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube) VCL: Velocidad curvilínea. VSL: Velocidad rectilínea. VAP: Velocidad promedio Tipo A: espermatozoides rápidos progresivos. Tipo B: espermatozoides rápidos y espermatozoides medios progresivos. Tipo C: espermatozoides medios y espermatozoides lentos. Los resultados están expresados como media ± error estándar. Letras diferentes indican diferencia significativa entre tratamientos (p<0.05).
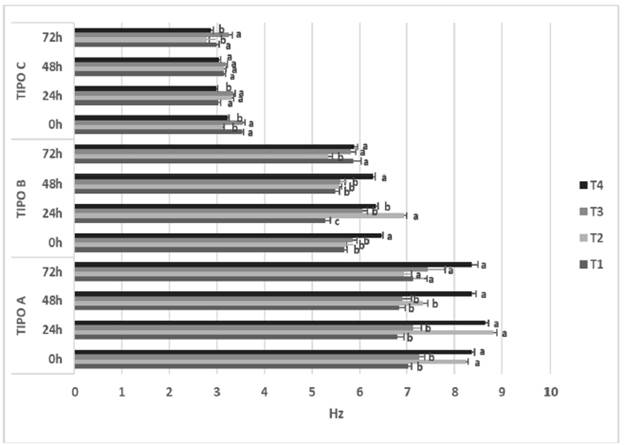
Figura 6. Frecuencia de batido de cola (BCF) de las subpoblaciones espermáticas por diluyente y tiempo de refrigeración. T1: leche descremada y azucares (EquiPlus®, Minitube, Alemania). T2: dextrosa, citrato sódico y acetato potásico (MRAbit®, Kubus, España). T3: caseinatos de sodio, fosfatos y azúcares (PoliCryo, European Patent EP3169154B1). T4: trisácido cítrico y yema de huevo (Triladyl®, Minitube, Alemania) Tipo A: espermatozoides rápidos progresivos. Tipo B: espermatozoides rápidos y espermatozoides medios progresivos. Tipo C: espermatozoides medios y espermatozoides lentos Los resultados están expresados como media ± error estándar. Letras diferentes indican diferencia significativa entre tratamientos (p<0.05).
DISCUSIÓN
Diferentes investigaciones han reportado subpoblaciones en el semen de mamíferos que muestran la heterogeneidad de los espermatozoides presentes dentro de una muestra (Quintero-Moreno et al., 2007; Santolaria et al., 2015). Esta característica no necesariamente se atribuye a factores externos (Mendoza et al., 2012); por lo tanto, la explicación para la presencia de diferentes tipos de espermatozoides dentro de una misma muestra de semen se ha asociado con los estadios de vida o maduración de los espermatozoides (Dorado et al., 2013). Así mismo, las subpoblaciones podrían representar diferentes momentos fisiológicos en las células espermáticas, lo que podría constituirse como una estrategia reproductiva relacionada con la capacitación, que facilite alcanzar el éxito reproductivo mediante la fertilización (Valverde Abarca y Madrigal Valverde, 2018). En el presente estudio se evidenciaron diferentes subpoblaciones espermáticas, catalogadas de acuerdo con parámetros específicos de su movilidad y cinética, y con diferente distribución según el tiempo de almacenamiento en refrigeración. A su vez, el diluyente mostró un efecto determinante en la distribución de dichas subpoblaciones, siendo evidente la reducción de las poblaciones de espermatozoides estáticos (Tipo D) con el uso de T1 y T3 (Figura 1). Quintero-Moreno et al. (2007) clasificaron las subpoblaciones de espermatozoides de conejo según su movilidad, encontrando dos subpoblaciones con movimiento progresivo y dos con movimiento no lineal; siendo las primeras, aquellas relacionadas con menor proporción de anormalidades y menos cromosomas alterados en los espermatozoides.
Los parámetros cinéticos evaluados al momento de la dilución, así como el SVi estimado (Cuadro 1), muestran que la composición del diluyente influye sobre las características de movimiento de los espermatozoides, posiblemente por un efecto directo sobre la fisiología y el metabolismo espermático. Así mismo, se evidenció que las velocidades de desplazamiento fueron superiores para la subpoblación de espermatozoides Tipo A (Figura 2), en comparación con las subpoblaciones Tipo B (Figura 3) y Tipo C (Figura 4). Se ha reportado diversas formas de modificar las subpoblaciones en su distribución y cantidad; por ejemplo, con la adición de algún compuesto (Ramió et al., 2008; Kanuga et al., 2012), la composición de proteínas del plasma seminal (Ledesma et al., 2017), con procesos como tinción o centrifugación (Miró et al., 2009; D’Amours et al. 2012) o mediante congelación o refrigeración durante tiempos específicos (Dorado et al., 2011). En este sentido, tanto la composición del diluyente como el tiempo en refrigeración produjeron diferencias en el comportamiento de las subpoblaciones espermáticas, tanto en la velocidad de desplazamiento como en parámetros asociados con la capacitación, la hiperactivación y la capacidad fertilizante de los espermatozoides como ALH (Figura 5) y BCF (Figura 6).
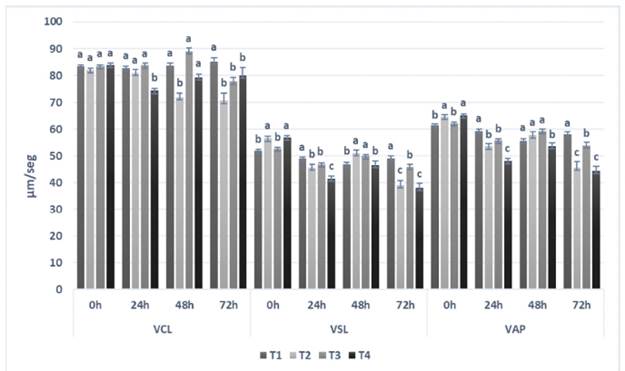
Figura 2. Velocidades espermáticas de la subpoblación Tipo A por diluyente y tiempo de refrigeración. T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube) VCL: Velocidad curvilínea. VSL: Velocidad rectilínea. VAP: Velocidad promedio Los resultados están expresados como media ± error estándar. Letras diferentes indican diferencia significativa entre tratamientos (p<0.05)
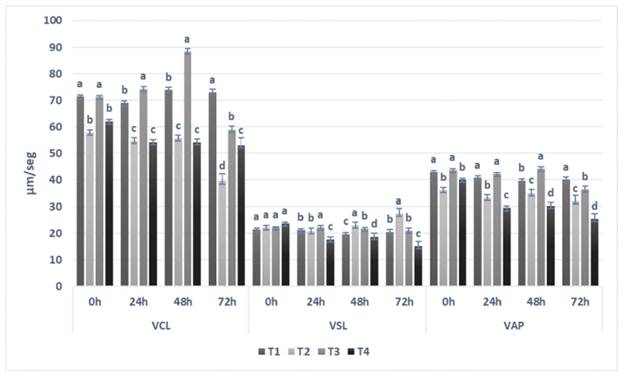
Figura 3. Velocidades espermáticas de la subpoblación Tipo B por diluyente y tiempo de refrigeración. T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube) VCL: Velocidad curvilínea. VSL: Velocidad rectilínea. VAP: Velocidad promedio Los resultados están expresados como media ± error estándar. Letras diferentes indican diferencia significativa entre tratamientos (p<0.05)
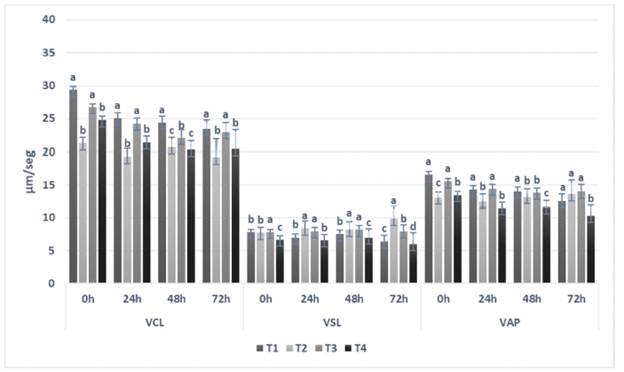
Figura 4. Velocidades espermáticas de la subpoblación Tipo C por diluyente y tiempo de refrigeración. T1: EquiPlus® (Minitube); T2: MRAbit® (Kubus); T3: PoliCryo; y T4: Triladyl® (Minitube) VCL: Velocidad curvilínea. VSL: Velocidad rectilínea. VAP: Velocidad promedio
En este estudio se encontró que la refrigeración del semen de conejo a 16 °C permite conservar las características de movimiento de los espermatozoides por 72 horas, de forma más eficiente con los diluyentes compuestos por leche descremada y azucares o por caseinatos de sodio, fosfatos y azúcares, en comparación con aquellos basados en dextrosa, citrato sódico y acetato potásico o en trisácido cítrico y yema de huevo. No obstante, está última composición presentó al momento de la dilución el tercer mayor valor para el SVi, aunque en la mayoría de los casos produjo la reducción más severa de los parámetros cinéticos en las diferentes subpoblaciones espermáticas. El-Seadawy et al. (2017) encontraron que la suplementación del diluyente trisácido cítrico-glicerol y yema de huevo con extracto etanólico de propóleo (PEE) fue capaz de mantener las características del semen refrigerado de conejo durante las 72 h.
De acuerdo con los hallazgos de este estudio, la clasificación e identificación de las subpoblaciones en el semen de conejo podría tener implicaciones prácticas en los programas de inseminación artificial; así mismo, según otros autores, la estructura de las subpoblaciones de espermatozoides móviles podría desempeñar un papel importante en la determinación de la capacidad fertilizante en muestras con un índice bajo de fertilización in vivo (Quintero-Moreno et al., 2007).
CONCLUSIONES
Los diluyentes compuestos por leche descremada y azúcares o por caseinatos de sodio, fosfatos y azúcares son una alternativa apropiada para la conservación de semen de conejo en condiciones de refrigeración, dado que favorecen el mantenimiento prolongado de los parámetros cinéticos de los espermatozoides y la prevalencia de subpoblaciones espermáticas con características superiores de velocidad y progresividad.
La composición del diluyente para la refrigeración afecta en la distribución y las características cinéticas del semen de conejo y, por lo tanto, podría influir en su capacidad fertilizante.












 uBio
uBio 


