INTRODUCCIÓN
El mastocitoma cutáneo es el tumor cutáneo más frecuente en el canino, constituyendo alrededor del 20% de los tumores de piel en la especie (Villamil et al., 2011). Se observa predisposición racial, la cual puede correlacionarse también con el grado histológico en cada raza afectada. Por ejemplo, los perros Pug, Bulldog Francés y Bóxer tienen mayor riesgo de presentar mastocitomas de bajo grado, mientras que los Shar-Pei, Maltés y Weimaraner tienen mayor probabilidad de verse afectados por neoplasias de alto grado (Mochizuki et al., 2017; Smiech et al., 2017; Smiech et al., 2018; Reynolds et al., 2019).
Este tumor cutáneo, derivado de mastocitos de la dermis o del tejido subcutáneo, se caracteriza por tener una presentación clínica muy variable, lo que dificulta el pronóstico. Las lesiones tumorales pueden ser eritematosas, edematosas, de crecimiento rápido, ulceradas, con o sin lesiones satélites, así como generar una reacción inflamatoria local e incluso generar signos paraneoplásicos. Los perros afectados pueden presentar signología gastrointestinal, derivada de la naturaleza proinflamatoria de los componentes de los gránulos de este tipo de células mastocíticas (histamina, heparina, proteasas) (Blackwood et al., 2012). La determinación del grado histológico es importante para establecer el pronóstico clínico. En la clasificación histológica del mastocitoma cutáneo se utiliza un sistema con tres grados histológicos (I, II y III) según Patnaik et al. (1984) y otro con dos categorías (bajo grado y alto grado) según Kiupel et al. (2011).
El curso y pronóstico de la enfermedad puede estar asociado a la presencia de mutaciones en el gen c-Kit. Este proto-oncogen codifica para una proteína de transmembrana que actúa como receptor de tirosina quinasa (Lennartsson et al., 2005). La mutación más frecuente del gen c-Kit es la duplicación del exón 11, que causa una activación constitutiva del receptor, favoreciendo la activación de mecanismos celulares que favorecen la progresión del tumor (Blackwood et al., 2012). Ante esto, para el tratamiento del mastocitoma cutáneo, se han desarrollado fármacos que actúan como inhibidores de tirosina quinasa, tales como imatinib, toceranib y masitinib, siendo estos dos últimos tratamientos aprobados para su uso en medicina veterinaria (London et al., 2014). Imatinib en cambio, es un fármaco de uso humano, fue el primero en salir al mercado y su uso en el tratamiento de diferentes tipos de neoplasias está ampliamente validado (Waller, 2018). En perros, existen reportes del uso de imatinib en el tratamiento de mastocitomas cutáneos de alto grado con resultados que varían entre remisiones parciales, totales y tiempos de sobrevida de entre 20 y 47 semanas (Nakano et al., 2014; Kim et al., 2016).
Entre las drogas quimioterapéuticos más efectivas para el tratamiento del mastocitoma de alto grado se encuentran la vinblastina y la lomustina, que pueden ser utilizadas de manera individual o en combinación con prednisona (Blackwood et al., 2012). Se ha descrito un protocolo que combina vinblastina, prednisona y toceranib, el cual demostró tener eficacia y ser seguro en pacientes con tumores de alto grado (Olsen et al., 2018).
Se presenta un caso clínico de un mastocitoma cutáneo de alto grado en un canino de una de las razas más susceptibles a este tipo de tumor. Se estableció un tratamiento combinado que incorporó el uso de un fármaco inhibidor de tirosina quinasa, tratamiento poco difundido en Chile.
CASO CLÍNICO
Se presenta en consulta privada un ejemplar canino, raza Shar Pei, hembra de 10 años, esterilizada, con vacunas al día y desparasitaciones pendientes. No convive con otros animales y reside, junto a sus propietarios, en la ciudad de San Antonio, Chile.
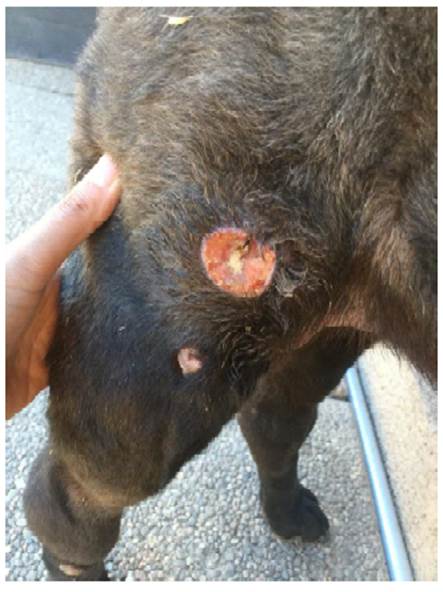
Al examen físico se observan masas múltiples y eritematosas, mayormente en la cara medial del miembro posterior derecho (Figura 1A). Según antecedentes de anamnesis, estas masas fueron identificadas por los propietarios un mes previo al día de la consulta. En el examen clínico se registró una frecuencia cardíaca de 130 latidos por minuto, frecuencia respiratoria de 20 por minuto, tiempo de llenado capilar de un segundo, mucosas rosadas e hidratadas, ausencia de secreciones nasales y oculares, abdomen normal a la palpación y temperatura rectal de 38.4 °C.
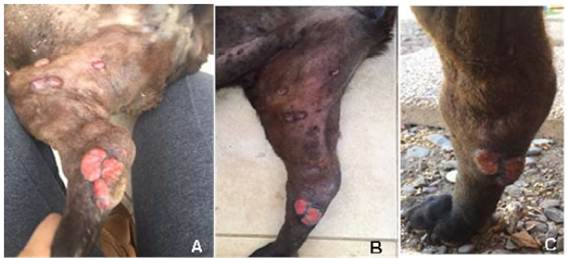
Figura 1 Imágenes de distribución y tamaño de las neoplasias (mastocitoma de alto grado citológico) en paciente canino Shar Pei, hembra de 10 años. A. Imagen registrada el día de la primera consulta. B. Imagen registrada 7 días postratamiento. C. Imagen del tumor de mayor tamaño registrada 10 días postratamiento
En la consulta se procedió a realizar una citología mediante punción con aguja fina de las masas más representativas. A la muestra microscópica (Figura 2), se observó un componente celular moderado, compuesto por tres tipos celulares. El primer tipo fue de células caracterizadas por citoplasma y núcleo redondos, moderada relación núcleo/citoplasma, anisocitosis y anisocariosis marcada, frecuente macrocariosis, células en binucleación y escasa granulación; el segundo tipo celular presente fue de eosinófilos en moderada cantidad; y el tercer tipo fue de fibroblastos con características ocasionales de reactividad. Estas características fueron compatibles con mastocitoma de alto grado citológico.
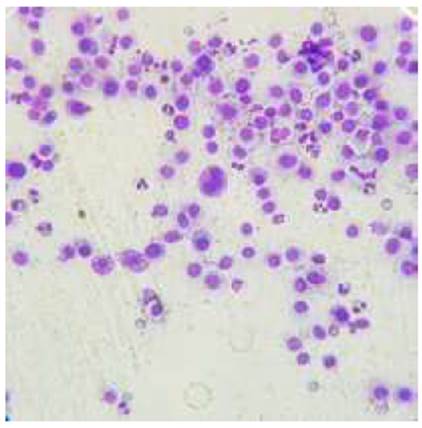
Figura 2 Imagen de citología obtenida mediante punción con aguja fina de una masa tumoral de mastocitoma de alto grado citológico. En el centro de la imagen se observa una célula multinucleada y abundantes mastocitos con escasos gránulos (Tinción Diff-QuikTM, 40X)
Dado este resultado, se procedió a realizar la estadificación clínica de la paciente. En la radiografía de tórax no se observaron anormalidades, a excepción de signos sugerentes de megaesófago. En la ecografía no se observaron anormalidades en los linfonodos mesentérico e iliácos y solo se informó como hallazgo una imagen sugerente de calcificaciones en el bazo. Dado que la paciente presentó al menos cuatro lesiones delimitadas, se clasificó a la neoplasia como un mastocitoma múltiple, sin evidencia de invasión de linfonodos ni de metástasis, lo que corresponde a estadio clínico II, según el sistema de clasificación propuesto por Horta et al. (2018). No se realizó punción con aguja fina de linfonodos regionales.
Para confirmar el diagnóstico sugerido por la citología, se obtuvo una muestra por biopsia excisional para estudio histopatológico. Se indicó Omeprazol oral en dosis de 0.5 mg/ kg cada 24 horas, para prevenir la manifestación de signos gastrointestinales. El informe histopatológico concluyó que el tipo celular predominante de la lesión fue de células mastocíticas, con marcada atipia celular, baja diferenciación, índice mitótico de 12 figuras en 10 campos de 400X, abundante vascularización y necrosis amplia y diseminada en aproximadamente el 10% de la lesión, dando como diagnóstico mastocitoma de alto grado (Kiupel et al., 2011).
La paciente recibió tratamiento con una combinación de vinblastina, prednisona, e imatinib. El protocolo utilizado fue una variación del descrito por Olsen et al. (2018). Se indicó vinblastina 1.6 mg/m2 endovenoso cada 2 semanas, durante 16 semanas (8 dosis); imatinib 10 mg/kg vía oral diario durante 16 semanas; prednisona 1 mg/kg vía oral 1 vez al día durante todo el proceso de tratamiento. En el periodo que la paciente estuvo en tratamiento, se realizaron controles mensuales durante siete meses, observándose remisión parcial de las masas tumorales, que se mantuvo estable desde el día 10 del tratamiento (Figuras 1B, 1C) hasta el séptimo mes.
A solicitud de la propietaria, se decide suspender el tratamiento de vinblastina al octavo mes, ya que este procedimiento resultaba muy estresante para el animal, exhibía evidentes señales de agresividad y requería de sedación para su manejo. El tratamiento continuó solo con imatinib y prednisona. Un mes posterior a este cambio, en la última consulta de seguimiento, no se observó recidiva de las masas tumorales que anteriormente habían experimentado remisión parcial, pero se evidenciaron dos nuevas masas ubicadas en la cara lateral del miembro anterior derecho, eritematosas y ulceradas (Figura 3). La citología de estas neoplasias resultó ser compatible con un mastocitoma de alto grado. Lamentablemente, la paciente falleció mientras dormía, tres semanas luego de la última consulta sin presentar ninguna signología paraneoplásica asociada a la presencia del mastocitoma cutáneo múltiple de alto grado.
DISCUSIÓN
El mastocitoma cutáneo es la neoplasia que se diagnostica con mayor frecuencia en casos de neoplasias de piel en perros, por lo que existe un gran interés por investigar aspectos relacionados con la presentación, tratamiento y progresión de este tumor. Se conocen variantes genéticas que confieren riesgo de presentación de otras neoplasias menos frecuentes, como el sarcoma histiocítico en Boyero de Berna (Abadie et al., 2009; Shearin et al., 2012) y el melanoma en algunas razas de manto negro (Hernández et al., 2018); sin embargo, si bien se ha reportado una clara predisposición racial hacia la presentación de mastocitoma, se desconocen las mutaciones que pudiesen estar asociadas a mayor riesgo de desarrollo de esta neoplasia. Solo se ha determinado un polimorfismo genético en un gen que codifica para una proteína de adhesión celular, el cual estaría asociado a mayor riesgo de presentación de mastocitoma en las razas Golden Retriever y Labrador Retriever (Biasoli et al., 2019).
Sería interesante conocer si estos polimorfismos también están presentes en otras razas que presentan mayor predisposición a este tipo de neoplasia, como los Shar Pei, ya que diferencias en las secuencias génicas entre razas pudiesen relacionarse con la alta variabilidad de presentación clínica de la enfermedad.
El pronóstico de vida en pacientes con mastocitoma cutáneo depende de múltiples factores, como el grado histológico, estadio clínico, localización de las masas, índice de proliferación, tasa de crecimiento, densidad de vascularización, recurrencia, presencia de signos sistémicos, edad, raza, sexo, tamaño del tumor y presencia de mutaciones en el gen c-Kit (Withrow et al., 2013). Entre estos factores, el grado histológico reviste de especial importancia. Independiente del sistema de clasificación histopatológica que se utilice (Patnaik o Kiupel), las neoplasias que contienen células más diferenciadas tienen mejor pronóstico que aquellas que exhiben alto grado de indiferenciación y características histológicas de malignidad, como marcada atipia celular y alta vascularización. Las primeras corresponden a un tipo de neoplasia más benigno, ya que menos del 10% hace metástasis y generalmente no causa la muerte del paciente (Blackwood et al., 2012).
La sobrevida de los pacientes que presentan neoplasias de alto grado puede variar entre 70 y >1000 días, si se instaura un protocolo de tratamiento quirúrgico y adyuvante adecuado, que combine drogas anticancerígenas con distinto mecanismo de acción, tal como el protocolo usado en este caso clínico que incorporó vinblastina, prednisona y un inhibidor de tirosina quinasa, basándose en lo reportado por Olsen et al. (2018). Estos autores, a partir de un estudio retrospectivo evaluaron la progresión y sobrevida de pacientes de tres grupos, según factores pronósticos, reportando una respuesta positiva en el 90% de los pacientes, con tiempos de sobreviva variable. En el caso del presente reporte el tiempo de sobrevida de la paciente fue de 260 días (37 semanas), lo que concuerda con los resultados de sobrevida promedio del grupo que recibía tratamiento paliativo (218 días) en el estudio de Olsen et al. (2018).
La paciente no presentó evidencia de metástasis ni de signología paraneoplásica durante el periodo de seguimiento. No obstante, se observó una rápida progresión de la enfermedad luego de retirar la administración de vinblastina, evidenciándose nuevas masas que fueron compatibles con un mastocitoma escasamente diferenciado, a la vez que las masas que habían experimentado remisión parcial se mantuvieron estables. Este tipo de progresión agresiva en algunas masas y casi ausente en otras podría estar relacionada a la naturaleza biológica de cada una de las neoplasias de la misma paciente. Se ha observado que existen diversos tipos de mutaciones en el gen c-Kit, con distinta frecuencia en los casos de mastocitoma, pero que en su conjunto están presentes en el 30% de los caninos afectados (Bonkobara et al., 2015). Además, existe evidencia de que los mastocitomas de alto grado pueden generar resistencia al tratamiento con inhibidores de tirosina quinasa en perros (Nakano et al., 2017), lo que sugiere que las células tumorales evolucionan generando mutaciones secundarias que les permiten mantener su alta proliferación. La mortalidad causada por la neoplasia ocurre en más del 80% de los casos y previo a los 175 días (Horta et al., 2018).
En el caso reportado, se observó recurrencia inmediata luego de la biopsia excisional que se realizó para confirmar el diagnóstico, por lo que se podría inferir que la potencial rápida progresión de estas masas fue inhibida con el tratamiento antineoplásico instaurado, permitiendo remisiones parciales que se mantuvieron estables durante 210 días en los que la paciente tuvo una buena calidad de vida. Al suprimir la administración de vinblastina, las neoplasias que habían experimentado remisión parcial no experimentaron recurrencia. Esto pudo deberse a que estos tumores tenían gran sensibilidad al inhibidor de tirosina quinasa; es decir, la remisión parcial podría haber estado explicada por la acción de la combinación de imatinib y prednisona. Sin embargo, probablemente otros microtumores estaban siendo controlados con el tratamiento de vinblastina, los cuales se hicieron evidentes al poco tiempo de retirar la droga del protocolo de tratamiento.
Por lo tanto, existe una alta probabilidad de que las primeras masas de esta paciente hayan contenido mutaciones en c-Kit, pero no las nuevas neoplasias. Esto permitiría explicar la rápida progresión de la enfermedad a través de nuevas neoplasias, a pesar de la continuidad del tratamiento con imatinib. Este reporte de caso presenta evidencia sugerente que permite apoyar la existencia de tumores con características genéticas diferentes en un mismo paciente. Lamentablemente no fue posible realizar el diagnóstico de mutaciones en c-Kit en estos tumores, lo que hubiese permitido confirmar esta hipótesis (Thamm et al., 2019).
CONCLUSIONES
La utilización del protocolo de quimioterapia combinada de vinblastina, prednisona e imatinib demostró buena tolerancia en la paciente, no generó neutropenia y favoreció el tratamiento del mastocitoma cutáneo mútiple de alto grado, aun cuando los factores predisponentes sugerían un pronóstico reservado y baja sobrevida.












 uBio
uBio