INTRODUCCION
El oso de anteojos (Tremarctos ornatus) es un mamífero endémico de los Andes tropicales, perteneciente a la familia Ursidae, orden Carnívora. Es el único oso de Sudamérica, habita una variedad de ecosistemas como bosques y pasturas altiplánicas desde la sierra norte de Venezuela, Colombia, los Andes de Ecuador y Perú, hasta la zona este de Bolivia (Velez-Liendo y García-Rangel, 2017). Son animales omnívoros, basando su dieta principalmente en frutas y vegetación y ocasionalmente en carne. La especie cumple un rol importante como dispersor de semillas, permitiendo la sobrevivencia de una serie de plantas, como las Lauráceas (Gonzales et al., 2016).
MINAGRI-SERFOR es la entidad de gobierno que aprueba la clasificación y categorización de las especies amenazadas de fauna silvestre en el Perú y considera a T. ornatus en situación vulnerable mediante Decreto Supremo N.° 004-2014-MINAGRI (MINAGRI-SERFOR, 2016). Esto implica que está prohibida su caza, captura, tenencia, transporte o exportación con fines comerciales. Además, se encuentra en la mis- ma categoría en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN) (Velez-Liendo y García- Rangel, 2017) y en el Apéndice I de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES, 2017). Entre sus principales amenazas están la cacería y la pérdida de hábitat. Estos animales son cazados por razones de subsistencia, protección frente a los ataques hacia el ganado o cultivos, miedo al animal por razones culturales, y tráfico de individuos vivos o de partes de estos. Por otro lado, la fragmentación y pérdida de hábitat se da principalmente por la deforestación, crecimiento poblacional humano, explotaciones petroleras y mineras (Velez-Liendo y García-Rangel, 2017).
Perú y Bolivia han elaborado planes para su conservación (Wallace et al., 2014), así como en Venezuela que se formuló el «Plan de Acción para la Conservación del Oso Andino (T. ornatus) (2006-2016)» (Yerena et al., 2007). En 2016, Perú a través del MINAGRI-SERFOR se publicó el «Plan Nacional de Conservación del Oso Andino (T. ornatus) para el periodo 2016- 2026», donde se identifica la situación actual de la especie y se menciona la existencia de una población en cautiverio. Además, menciona la falta de conocimiento sobre aspectos fisio- lógicos y reproductivos y el estado sanitario de la especie. Por esta razón, uno de sus objetivos es realizar investigaciones in situ y ex situ sobre estos aspectos para la toma de decisiones orientadas a la conservación de la especie y su hábitat.
Existen diversas herramientas y pruebas para la evaluación física y fisiológica de animales en cautiverio que varían en niveles de riesgo e invasividad, como son los exámenes de patología clínica de sangre y orina, o aquellos basados en imágenes como radiografías y ultrasonografías. La ultrasonografía o ecografía es una herramienta que permite diferenciar entre una gama de tejidos (Barr et al., 2006), pudiéndose diferenciar estructuras normales de anormales para identificar patologías. Al tratarse de una prueba no invasiva, en tiempo real, cuyo equipo puede ser transportable a campo, permite su aplicación en el diagnóstico de diversas patologías en animales silvestres (Fowler y Miller, 2015). Un examen ecográfico general usualmente incluye los órganos abdominales y pélvicos (Matton y Nyland, 2016).
Dentro de las principales enfermedades reportadas en úrsidos en cautiverio se encuentran las patologías tegumentarias, gastrointestinales y oculares. Entre las gastrointestinales se encuentran las neoplasias, vólvulos, obstrucciones y la enfermedad inflamatoria intestinal, entre otras. Muchas de estas se pueden diagnosticar a través de la ecografía y con apoyo de exámenes complementarios (Fowler y Miller, 2015)
La literatura veterinaria referente a re- portes ecográficos detallados en fauna silvestre es aún limitada, existiendo escasa información publicada acerca de la anatomía del oso de anteojos. Ante esto, el objetivo del estudio fue realizar la descripción ultrasonográfica de los órganos abdominales y pélvicos del oso de anteojos (T. ornatus) en cautiverio, información que será útil para reconocer las características normales de los órganos de ubicación abdominal y pélvica en esta especie, constituyendo una herramienta diagnóstica útil en el control sanitario rutinario en los ejemplares en cautiverio.
MATERIALES Y METODOS
El estudio comprendió la evaluación de ocho ejemplares adultos (Tremarctos ornatus). Seis de ellos (3 machos y 3 hembras) correspondieron a la colección del zoológico del Patronato del Parque de las Leyendas «Felipe Benavides Barreda», ubica- do en Lima, Perú, y dos individuos machos de la colección del Centro de Rescate Mundo Natural ubicado en Tingo María, Perú. Los criterios de inclusión contemplaron ejempla- res aparentemente sanos sin distinción de sexo o edad, sin historia de enfermedad en los últimos seis meses estando en cautiverio.
Los animales fueron anestesiados como parte de su control sanitario anual empleando dardos disparados con cerbatanas. Se utilizó 5-8 mg/kg ketamina y 1-1.5 mg/kg xilacina administrado vía intramuscular (Fowler y Miller, 2015), según los pesos de registros previos. Una vez bajo sedación, se procedió a realizar el examen físico completo rutinario y la toma de muestras de sangre periférica para los análisis de patología clínica correspondientes.
El procedimiento de evaluación ultrasonográfica se realizó con un equipo MyLab One Vet (Esaote, Italia) con transductor convexo SC3123, 9-4 MHz, ángulo 93°. Para una mejor visión de los órganos se aplicó etanol 70% para facilitar la aplicación de abundante gel de ultrasonido sobre la superficie de la piel y lograr un adecuado contacto del transductor con la superficie corporal.
Para describir la topografía de los órganos abdominales y pélvicos, la superficie abdominal se delimitó en nueve regiones por planos imaginarios (Evans y deLahunta, 1991) (Figura 1). Las regiones abdominales forma- das por planos transversos se dividen en abdominal: craneal, media y caudal. Estas a su vez se dividen en tres, dando nueve regiones abdominales formadas por planos parasagitales (Done et al., 2010). El abdomen craneal inicia a la altura del apéndice xifoides, y a lo lateral el hipocondrio derecho e izquierdo. El abdomen medio inicia caudal a la línea imaginaria que limita el abdomen craneal, y termina en una línea imaginaria entre las dos crestas ilíacas. A su vez, este abdomen medio se divide en la región umbilical en la zona ventral y el flanco derecho e izquierdo a lo lateral. Finalmente, el abdomen caudal inicia des- de la línea intertubercular y va hasta el final del abdomen; la zona ventral es la región púbica y los laterales la región inguinal (adaptado de Evans y deLahunta, 1991).
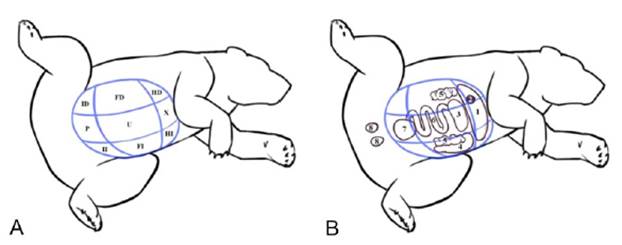
Figura 1 Regionalización anatómica y órganos abdominales del oso de anteojos (Tremarctos ornatus), adaptado de Evans y deLahunta (1991). (A) Regiones: HD (Hipocondrio derecho), HI (Hipocondrio izquierdo), X (Xifoidea), FD (Flanco derecho), FI (Flanco izquierdo), U (Umbilical), ID (Inguinal derecho), II (Inguinal izquierdo), P (Púbica). (B) órganos: 1 (Hígado), 2 (Vesícula biliar), 3 (Estómago), 4 (Bazo), 5 (Riñones), 6 (Intestino), 7 (Vejiga), 8 (Testículos)
El examen ecográfico se inició con la visualización del hígado y vesícula biliar en el abdomen craneal, luego se evaluaron ambos riñones y el bazo en los respectivos flancos, se prosiguió con el estómago en el abdomen medio y finalmente en la región pélvica y escrotal se evaluó la vejiga y órganos reproductivos. Durante la evaluación ultrasonográfica se registraron las características de topografía, morfología, ecogenicidad, ecotextura, arquitectura y dimensiones de los órganos de ubicación abdominal y pélvica. Asimismo, se hizo el registro digital de imágenes y videos del procedimiento. Estos datos fueron sometidos a estadística descriptiva obteniéndose la media como medida de tendencia central, la desviación estándar y rango como medidas de dispersión. Los datos se presentan en cuadros.
Al haber limitada información sobre los parámetros ecográficos de ejemplares sanos en esta especie, los datos registrados en la evaluación ecográfica de los órganos abdominales y pélvicos fueron comparados con aquellas del único estudio ecográfico realiza- do post mortem de un oso de anteojos hembra por Cahua y Sato (2012). Adicionalmente, se emplearon referencias de hallazgos de estudios similares de otras especies de la familia Ursidae y Bovidae, y en otras especies de carnívoros, como el perro doméstico (Canis lupus familiaris).
RESULTADOS
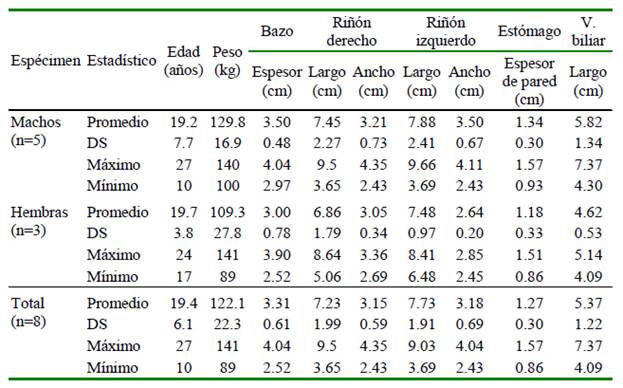
El manejo y protocolo de anestesia utilizados permitieron realizar el procedimiento ecográfico y el control sanitario en general sin inconveniente. Los animales no presenta- ron efecto adverso alguno durante el procedimiento anestésico ni en el tiempo de recuperación posterior a la anestesia. Los estadísticos de las edades y pesos de los especímenes evaluados se presentan en los cuadros 1 y 2; llamando la atención una hembra obesa (141 kg) que superó en más de 40 kg el peso de sus congéneres.
Los resultados del examen de patología clínica indicaron valores dentro de los parámetros normales, con excepción de la hembra obesa que presentó niveles elevados para glucosa (112 mg/dl) y colesterol (461 mg/dl), aunque dentro los rangos referenciales, según los registros de Species360 para T. ornatus (Fowler y Miller, 2015). Sin embargo, el nivel elevado de triglicéridos (1030 mg/dl) sobrepasó los valores referenciales (87.93-196.04 mg/dl) (Castellanos et al., 2010). No obstante, este ejemplar fue incluida en el estudio al no presentar alteraciones al examen clínico.
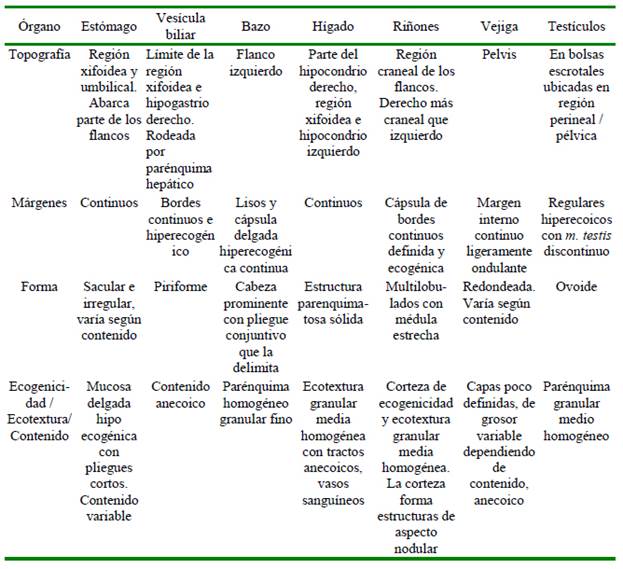
Las características ecográficas: topo- grafía, márgenes, forma, ecotextura y ecogenicidad del bazo, hígado, vesícula biliar, riñones, estómago, vejiga en el abdomen (Cuadro 1); y en el caso de los machos, los testículos en las bolsas escrotales se encuentran descritas en el Cuadro 3. Las dimensiones de los órganos abdominales se detallan en el Cuadro 2 y de los órganos los pélvicos en el Cuadro 3.
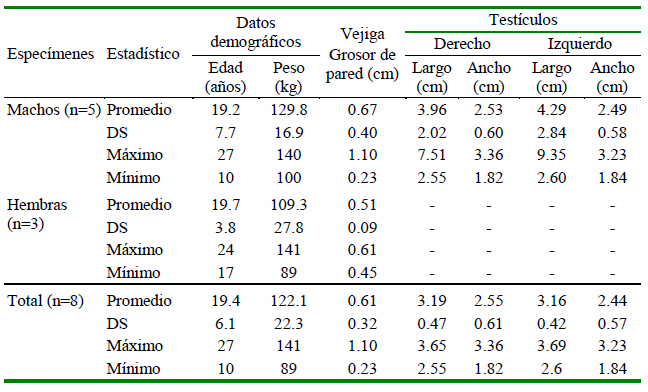
Cuadro 2 Estadísticos de edad, peso, sexo y dimensiones de los órganos pélvicos, obtenidos mediante ultrasonografía en ocho ejemplares de Tremarctos ornatus en cautiverio
El hígado se encontró en la región craneal del abdomen, la región xifoidea, el hipocondrio izquierdo y parte del hipocondrio derecho. Está delimitado cranealmente por el diafragma y caudalmente por el estómago. Presentó bordes continuos y un parénquima de ecotextura y ecogenicidad media y homogénea. La vascularización hepática se observó como tractos anecoicos característicos de este órgano (Figura 2A).
La vesícula biliar se observó piriforme, ubicándose en el límite de la región xifoidea y del hipocondrio derecho, rodeada por parénquima hepático. El margen interno se observó continuo e hiperecogénico, de gro- sor variable según el volumen contenido. Cuatro individuos presentaron la pared vesicular discretamente gruesa e hiperecogénica; en el resto, la pared fue delgada. El contenido se observó anecoico, sin evidencia de sedimento biliar (Figura 2A).
El bazo se ubicó en la región del flanco izquierdo, craneal al riñón izquierdo. Los márgenes fueron lisos, presentando una cápsula delgada continua hiperecogénica. En cuanto a la forma, se reconoció una cabeza prominente con un pliegue conjuntivo que la delimitaba del cuerpo. El bazo presentó un parénquima homogéneo, de ecogenicidad y eco- textura granular fina y densa. pudiendo observar en el parénquima esplénico estructuras vasculares y venas esplénicas (Figura 2B).
El estómago se localizó en la región del abdomen medio, entre la región xifoidea y umbilical, abarcando también parte de los flan- cos. Presentó una forma sacular e irregular, variando en cada individuo según el contenido de gas o alimento. El órgano mostró la pared gástrica con capas de ecogenicidad alternada y pliegues cortos; observándose la mucosa delgada e hipoecogénica, la submucosa de grosor moderado e hiperecogénica, una muscular gruesa e hipoecogénica, y una serosa fina e hiperecogénica (Figura 3A).
Cuadro 3 Características ultrasonográficas (topografía, márgenes, forma, ecotextura y ecogenicidad) de los órganos abdominales y pélvicos en ocho ejemplares de Tremarctos ornatus en cautiverio.
Los riñones, se encontraron en la región del flanco derecho e izquierdo, respectivamente; siendo el derecho más craneal que el izquierdo. Tuvieron forma multilobulada, de modo que estos lóbulos se dividen también en corteza y médula, presentando entre 10 a 12 lóbulos por riñón. Los bordes del riñón fueron hiperecogénicos, mientras que la corteza fue de ecogenicidad y ecotextura granular media homogénea, en tanto que la médula correspondió en cada lóbulo a una pequeña área central irregular anecoica (Figura 3B).
En la región pélvica se encontró la vejiga. Su forma fue redondeada y el tamaño varió según la cantidad de orina. Presentó bordes regulares, con las capas de la pared poco definidas, un margen interno continuo ligeramente ondulante y un contenido anecoico (Figura 4A). Los testículos son ovoides y se ubican en la parte externa de la región pélvica, en las bolsas escrotales. Poseen márgenes regulares continuos e hiperecoicos y un parénquima granular medio homogéneo. El mediastinum testis se observó como una tenue línea hiperecogénica y discontinuo al corte sagital (Figura 4B). Para el caso de las hembras, no se pudo distinguir las secciones del aparato reproductor.
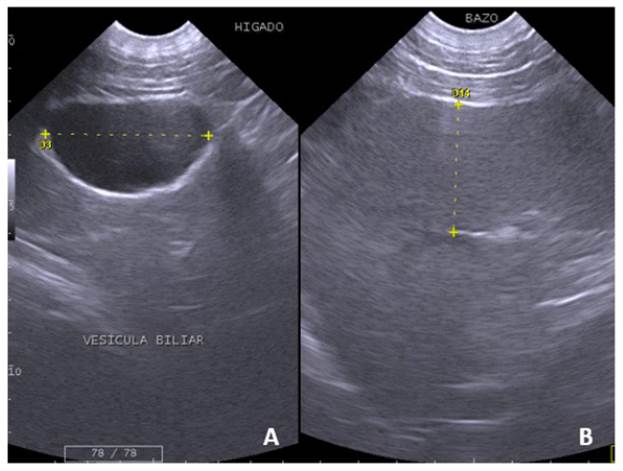
Figura 2 Imágenes ultrasonográficas del hígado, vesícula biliar y bazo del oso de anteojos (Tremarctos ornatus). (A) Hígado, se observa un parénquima hepático normal de ecotextura granular media homogénea. Vesícula biliar con contenido anecoico y pared hiperecogénica (5.0 cm de longitud) rodeada por parénquima hepático de ecotextura
DISCUSION
El manejo y protocolo de sedación empleados permitió realizar el control sanitario y procedimiento ecográfico sin dificultad. Siendo los resultados del examen de patología clínica normales (con la excepción de un individuo), se esperaría que los osos no pre- sentasen alteraciones anatomopatológicas en los órganos, como se corroboró en los resultados. Los resultados fueron comparados principalmente con un reporte realizado en una osa de anteojos en el post portem. Ese animal de 28 años y de 38 kg de peso fue criado en cautiverio, y eutanasiado debido a un cuadro de inanición y emaciación crónica (Cahua y Sato, 2012).
El hígado se visualizó abarcando parte del hipocondrio derecho, región xifoidea e hipocondrio izquierdo, mientras que Cahua y Sato (2012) lo describieron en los espacios derecho e izquierdo del abdomen, pero en ambos casos limitado por el arco costal, al igual que en el perro (Penninck y D’Anjou, 2008). Esta diferencia podría deberse al fundamento que usaron Cahua y Sato (2012) para delimitar las áreas del abdomen, información que no especifican en su reporte. En la necropsia describieron seis lóbulos: lateral derecho, medial derecho, cuadrado, medial izquierdo, lateral izquierdo y caudado; tal como lo describe Raven (1936) en el oso panda (Ailuropoda melanoleuca). Sin embargo, en este estudio, como sucede en el perro y otras especies domésticas, a pesar de que el hígado se divide en lóbulos, estos no se logran diferenciar ecográficamente (Matton y Nyland, 2016).
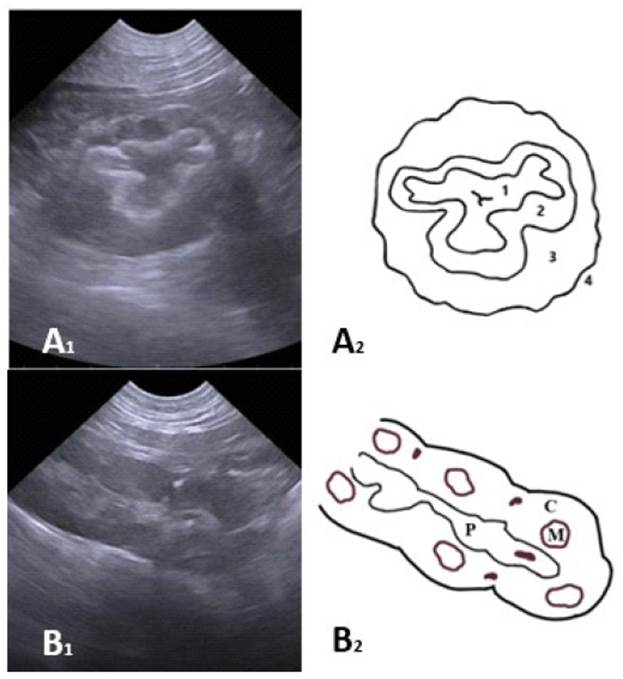
Figura 3 Imágenes ultrasonográficas del estómago y riñón del oso de anteojos (Tremarctos ornatus) (A1) Corte transversal del estómago sin contenido. Se diferencian las cuatro capas de la pared del estómago; y en el dibujo (A2) se esquematizan la mucosa (1), submucosa (2), muscular (3), serosa (4). (B1) Corte longitudinal del riñón. Se aprecian los lóbulos con buena diferenciación cortico medular; y la pelvis; (B2) ilustrados en el dibujo: P (Pelvis), M (Médula), C (Corteza)
Cahua y Sato (2012) describen el parénquima hepático como homogéneo, lo cual concuerda con lo hallado en el presente estudio; sin embargo, ellos encontraron el hígado moderadamente hipoecogénico y de grano fino, mientras que en el presente estudio se observó un parénquima de textura granular media, al igual que lo descrito en el perro (Matton y Nyland, 2016). Al compararlo con el bazo, el hígado es ligeramente hipoecoico y de ecotextura más granular, situación semejante a lo descrito en el perro (Penninck y D’Anjou, 2008). Los tractos anecoicos observados correspondientes a vasos sanguíneos también han sido descritos en el perro y otras especies domésticas como ramas de las venas hepáticas y portales (Matton y Nyland, 2016).
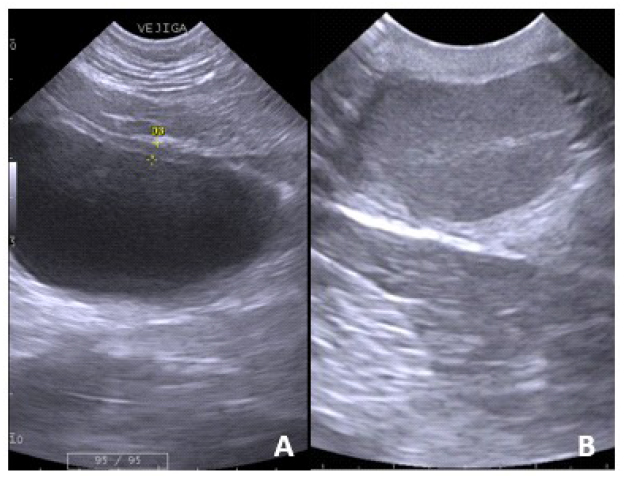
Figura 4 Imágenes ultrasonográficas de vejiga y testículo del oso de anteojos (Tremarctos ornatus) (A) La vejiga se observa con las capas de la pared poco definidas y un contenido anecoico, pared de 0.47 cm de espesor. (B) Testículo observándose el mediastinum tesis, hiperecogénico y discontinuo.
Los animales que presentan obesidad pueden tener el hígado con ciertas alteraciones ecográficas como aumento de la ecogenicidad y aumento del tamaño, aunque hay casos donde no se encuentran cambios específicos en la ecogenicidad (Matton y Nyland, 2016). En el caso de la hembra obesa el parénquima hepático fue similar al del resto de los animales en estudio.
La vesícula biliar se ubicó rodeada de parénquima hepático, de aspecto piriforme, al igual que lo presenta el perro (Penninck y D’Anjou, 2008). Es de bordes continuos hiperecogénicos y contenido anecoico, lo que coincide con la descripción de Cahua y Sato (2012), quienes reportaron la vesícula biliar con un largo de 7.69 cm, valor que está dentro del rango de los valores del presente estudio.
Las secciones del sistema gastrointestinal tales como estómago y asas intestinales coincidieron con lo característico de los carnívoros, lo que concuerda con la descripción hecha en los úrsidos (Cubas et al., 2014; Fowler y Miller, 2015). A pesar de ser animales con dieta omnívora, casi herbívora (Chávez, 2018), poseen un sistema gastrointestinal simple y no poseen ciego, características similares a la descrita en el oso panda, especie estrictamente herbívora (Langer, 2017). El estómago al igual que en el estudio de Cahua y Sato (2012) se presentó en la región xifoidea y umbilical, abarcando parte de los flancos, aunque aquel estudio menciona que solamente se extiende medialmente hasta el riñón derecho.
A nivel de la pared del estómago se identificaron ecográficamente las siguientes capas: una mucosa delgada hipoecogénica, una submucosa moderada hiperecogénica, una capa muscular hipoecogénica gruesa y una serosa hiperecogénica. Cahua y Sato (2012) también describieron una capa muscular bastante gruesa, hipoecogénica y de grano grueso, solamente descrita a nivel de la porción descendente del estómago. La pared del estómago en los osos de anteojos fue mucho más gruesa que la descrita para perros, 0.30 a 0.50 cm (Matton y Nyland, 2016). Sin em- bargo, es importante recalcar que en las evaluaciones del grosor de la pared debe considerarse el contenido y distensión del estómago al momento de la evaluación (Penninck y D’Anjou, 2008).
El riñón izquierdo y derecho se ubica- ron en la parte craneal del flanco izquierdo y derecho, respectivamente, siendo el derecho más craneal que el izquierdo, igual a lo descrito en el perro (Matton y Nyland, 2016). Presentaron una morfología multilobulada, como lo describe Cahua y Sato (2012), se- mejante a la descrita en el bovino doméstico, Bos taurus (Carvalho et al. 2009), en el oso polar, Ursus maritimus (Bechshøft et al., 2011) y en el oso pardo, Ursus arctos (Goœcicka y Tomasik. 1979); quienes indican que estos lóbulos funcionan de forma independiente y se dividen en corteza y médula. En el bovino, el riñón posee un aproxima- do de 20 lóbulos (Carvalho et al., 2009), mientras que Bechshøft et al. (2011) reportó un riñón de oso polar con 47 lóbulos. En el presente estudio fue de aproximadamente de 10 a 12 lóbulos, probablemente debido al menor tamaño del oso de anteojos.
La explicación más probable para la forma lobulada de los riñones en los osos, al igual que las otras especies mencionadas, la proponen Stenvinkel et al. (2018), quienes postulan que es debido a las características de los túbulos contorneados proximales, que son de menor tamaño en comparación al resto de especies, por lo que tienen una menor capacidad para el flujo intraluminal, y al ser una especie de gran tamaño y tener la limitante de la longitud de estos túbulos, requieren la conformación de multi lóbulos.
La corteza, según Cahua y Sato (2012) fue de ecogenicidad de grano fino, moderadamente hipoecogénico, en tanto que en este estudio se observó una corteza de ecogenicidad y ecotextura granular media y homogénea. Ambos estudios coinciden que la médula se observa anecoica, con bordes hiper- ecogénicos, y la pelvis se observa como un tejido hiperecogénico en donde confluyen los lóbulos. En cuanto a las dimensiones del riñón, Cahua y Sato (2012) reportaron una longitud de 8.52 cm y un ancho de 3.24 cm, va- lores dentro de los rangos encontrados en este estudio.
La topografía anatómica del bazo difiere de la descrita por Cahua y Sato (2012), pero es similar a lo descrito para el perro por Matton y Nyland (2016). Por otro lado, el órgano presentó un parénquima homogéneo granular fino, al igual que el perro (Matton y Nyland, 2016; Penninck y D’Anjou, 2008), en tanto que Cahua y Sato (2012) mencionan un parénquima homogéneo de grano grueso. Al igual que en el perro, los márgenes esplénicos fueron lisos y regulares, y el órgano presenta cabeza, cuerpo y cola (Matton y Nyland, 2016). Cahua y Sato (2012) reportaron un espesor de 2.24 cm (a nivel del hilio), dato que se encuentra dentro del rango determinado en este estudio.
La vejiga se ubicó en la región pélvica, como se presenta en perro y otras especies domésticas (Matton y Nyland, 2016). Tiene un margen interno continuo, ligeramente ondulante en algunos casos, lo cual puede variar al igual que la forma según la cantidad de orina (Matton y Nyland, 2016). El grosor de la mucosa también varió dependiendo del contenido, siendo esta más gruesa a menor contenido. En perros, el grosor normal de la pared vesical varía entre 0.13 a 0.17 cm (Penninck y D’Anjou, 2008), mientras que, en este estudio, tanto para machos como hembras, la media fue mucho mayor. La pared se observó ecogénica, similar al perro; sin embargo, las capas que la conforman fue- ron poco definidas, como se ha descrito en el perro y otras especies domésticas (Penninck y D’Anjou, 2008, Matton y Nyland, 2016), con contenido anecoico.
Los testículos del oso de anteojos se ubicaron en las bolsas escrotales, con características similares a las descritas en el perro y otras especies domésticas (Matton y Nyland, 2016); sin embargo, a diferencia de estas especies, los osos de anteojos presen- taron un mediastinum testis poco remarcado y algo discontinuo.
Finalmente, no se pudo distinguir ninguna de las secciones del aparato reproductor en los tres individuos hembra. Esta situación se presenta frecuentemente en la perra, que bajo condiciones normales no se suelen identificar los ovarios ni los cuernos uterinos en etapa de anestro, debido a su pequeño tamaño, además de la dificultad que genera el gas de las asas intestinales y el tejido adiposo que los rodea (Penninck y D’Anjou, 2015; Matton y Nyland, 2016).












 uBio
uBio