INTRODUCCION
Las células madre mesenquimales (CMM) son células adultas multipotentes que se obtienen de fuentes conocidas como médula ósea, tejido conectivo y sangre del cordón umbilical, entre otras, con plasticidad para diferenciarse en linajes celulares de condrocitos, adipocitos y osteocitos y de las que se han logrado establecer cultivos que ha permitido estudiar sus propiedades biológicas (Carvalho et al., 2013).
Una fuente alternativa y promisoria para la obtención de CMM equinas son los tejidos sinoviales, por lo que es importante conocer sus características fenotípicas y potencial de diferenciación. Se ha reportado que las células mesenquimales cultivadas provenientes del líquido sinovial (CMM-LS) y de la membra-nasinovial (CMM-MS) de articulaciones de caballos sanos, con osteoartritis o con osteocondritis disecante presentaron morfología fibroblastoide y capacidad de adherirse al plástico, así como expresión positiva a los marcadores de multipotencia como CD90 y CD44 (Hernández et al., 2011), además de marcadores de sinoviocitos como lisozima, PGP 9.5, PCNA y vimentina (Zayed et al., 2017). Estas células fueron capaces de diferenciarse en linajes condrogénicos, osteogénicos y, aunque pobremente, en linajes adipogénicos (Fülber et al., 2016).
Se ha demostrado que las células mesenquimales aisladas del líquido sinovial de caballos son fuertemente positivas para CD44, CD90 y el complejo mayor de histocompatibilidad (MHC) de clase I, así como moderadamente positivas para CD11a/CD18, CD105 y MHC de clase II y negativas para CD34 y CD45. Estas células derivadas del líquido sinovial se diferencian en linajes condrogénicos, osteogénicos, adipogénicos y tenogénicos (Murata et al., 2014). Al comparar el potencial condrogénico in vitro de poblaciones de células madre mesenquimales procedentes de médula ósea equina (CMM- MO) y CMM-LS del mismo donante equino, se encontró que eran similares en morfología celular, viabilidad e inmunofenotipo, pero va- rían en su potencial condrogénico y en la ex- presión de las proteínas condrogénicas (Zayed et al., 2017). Resultados similares muestran que las CMM derivadas de la membrana sinovial tienen mayor potencial de regeneración articular y capacidad de diferenciación condrogénica, ya que son una fuente más cercana a los condrocitos (Santos et al., 2018). A diferencia de las CMM derivadas de la médula ósea que expresan marcadores de hipertrofia y osteogénesis (Runx2) cuan- do son diferenciadas a condrocitos, las del líquido sinovial producen una mayor cantidad de tejido cartilaginoso y no expresan un fenotipo hipertrófico (Chen et al., 2016).
Las CMM se pueden aislar de tejidos usando otros marcadores de multipotencial como STRO-1, proteína de superficie celu- lar, y CD 146, molécula de superficie celular perteneciente a la superfamilia de las inmunoglobulinas, expresada en células provenientes del ligamento periodontal humano (Xu et al., 2009).
En relación al aislamiento y purificación de CMM, se viene usando con éxito la técnica de clasificación de células activadas magnéticamente (MACS) que evita la heterogeneidad celular y permite tener un linaje celu- lar puro en las placas de cultivo (Chen et al., 2016). Esta técnica consiste en utilizar partí- culas magnéticas unidas a anticuerpos para marcar las células que expresan el fenotipo que se desea aislar y ser separadas posteriormente a través de un campo magnético (Korkusuz et al., 2018).
Esta investigación tuvo como objetivo purificar las CMM provenientes del fluido sinovial de las articulaciones de caballos que expresan el marcador de superficie STRO-1 utilizando la técnica de MACS con la finalidad de evaluar su capacidad de proliferación y capacidad multipotente, así como los linajes celulares en que pueden diferenciarse.
MATERIALES Y METODOS
Muestras
Las muestras se obtuvieron de tres Caballo Peruano de Paso en aparente buen estado de salud, que fueron sacrificados en el matadero local Casa Blanca, localizado en el distrito de Pachacámac, Lima, Perú.
Células madre mesenquimales de líquido sinovial (cmm-ls)
El líquido sinovial (LS) se obtuvo por aspiración directa, usando una jeringa estéril de calibre 20, del metatarso, previamente afeitadas y desinfectadas con alcohol al 70% seguido de solución yodada (10% en solución salina). Se diluyeron aproximadamente 2 ml de LS en PBS (buffer fosfato) suple- mentado con 400 U/ml de penicilina, 400 U/ ml de estreptomicina y 1 µg/ml de anfotericina B. Las muestras se centrifugaron a 185 g durante 10 minutos a temperatura ambiente. El botón celular se suspendió en medio DMEM con alto contenido en glucosa suple- mentado con 10% de suero fetal bovino y 100 U/ml de penicilina, 100 U/ml de estreptomicina y 0.25 µg/ml de anfotericina B (medio de cultivo con solución antibiótica- antimicótica 1x). Las células posteriormente fueron cultivadas en placas de Petri de 30 mm2 a 38 °C en 5% de CO .
Cuando las células alcanzaron un 80- 90% de confluencia se realizó el primer pasaje. Las células se cosecharon con tripsina- EDTA al 0.05% y fueron sembradas en una placa de Petri de 100 mm2. Finalmente, luego del tercer pasaje, los cultivos primarios resultantes se criopreservaron con medio de cultivo suplementado al 10% de DMSO (dimetil sulfóxido) y fueron almacenados en nitrógeno líquido hasta el inicio de los procedimientos experimentales.
Purificación del CMM-LS STRO-1
La purificación de CMM-LS STRO-1 se realizó mediante la técnica de clasificación de células activadas magnéticamente (MACS), siguiendo las instrucciones del pro- veedor (Miltenyi Biotec, Alemania). En re- sumen, las células se cosecharon con tripsina- EDTA al 0.05%, fueron suspendidas en PBS con 0.5% de albúmina y se adicionó una so- lución con anticuerpos de ratón anti STRO-1 conjugadas con FITC (10 ìg/ml). La mezcla fue incubada durante 1 h a 4 °C, las células fueron lavadas dos veces y posteriormente incubadas en presencia de microesferas con- jugadas con anticuerpos anti FITC durante 30 min en oscuridad a 4 °C. Seguidamente, las células fueron lavadas dos veces para eliminar el exceso de anticuerpos y finalmente se pasaron por un campo magnético. Las células retenidas en la columna se liberaron y diluyeron en PBS con albúmina al 0.5%, luego se centrifugaron a 289 g y se suspendieron en medio de cultivo (CM) y cultivadas hasta alcanzar la semi confluencia, para después ser criopreservadas en nitrógeno líquido.
Proliferación Celular
Las células se sembraron en placas de 12 pocillos a 30 000 células por pocillo en CM a 38 °C durante seis días sin reemplazo de medio. Luego se contó nuevamente el número de células y se calculó el tiempo de duplicación de la población, utilizando la herramienta en línea gratuita (http://www.- protocol-online.org/biology-forums-2/posts/ 13968.html). Todo el recuento se realizó utilizando la cámara Neubauer. Las células se lavaron dos veces con PBS y se cosecharon con Tripsina-EDTA. Las células resultantes se resuspendieron en 1 ml de formalina al 4% y se diluyeron en PBS 1:100.
Diferenciación a Tres Linajes Celulares
Las células se sembraron en placas a 300 000 células por pocillo en 12 pocillos en CM. Al alcanzar el 95% de con- fluencia se cultivó en medio de diferenciación específica durante 21 días.
Para la diferenciación osteogénica, el medio DMEM con alto contenido de glucosa fue suplementado con 10% de suero fetal bovino, dexametasona 0.1 µM, â- glicerofosfato 10 mM, sal trisódica del ácido L-ascórbico 2-fosfato 50 µM, y 1x de solución antibiótica-antimicótica.
Para la tinción osteogénica específica se usó rojo de Alizarina para detectar la deposición extracelular de calcio. La monocapa se fijó usando una solución de formalina al 10% durante 1 hora, se lavó 3 veces con agua corriente y se añadió 1 ml de solución de rojo de alizarina al 2% en cada pocillo durante 1 h. Luego se eliminó el sobrante y los pocillos se lavaron 6 veces con agua de grifo hasta que el agua se mantuvo clara. Seguida- mente, los pocillos se llenaron con glicerina y se mantuvieron a temperatura ambiente.
Para la diferenciación condrogénica, el medio consistió en DMEM con alto con- tenido de glucosa suplementado con suero fetal bovino al 10%, 10 ng/ml de TGF- â 3, 10 g/ml de insulina, sal trisódica del ácido L-ascórbico 2-fosfato y 1x de so- lución antibiótico-antimicótica.
Para la detección condrogénica, se usó una solución de azul alcián al 0.02%, pH
1. Después de la fijación de la monocapa con etanol al 100 % durante 1 h, se añadió 1 ml de la solución durante 3 horas, después de este periodo las monocapas se enjuagaron 6 veces con etanol al 100% y se cubrieron con glicerina.
Para la diferenciación adipogénica se utilizó DMEM con alto contenido de glucosa suplementado con suero fetal de bovino al 10%, 1 µM, insulina 10 µg/ml,
3-isobutil-1-metilxantina 0.5 mM, indometacina 0.1 mM y 1x de solución antibiótica-antimicótica.
La tinción Oil Red se usó para la detección adipogénica. Las monocapas se lavaron 3 veces con PBS y se fijaron con 10% de formaldehído durante 1 h, luego se tiñeron con 2% de Oil Red durante 1 h con agitación suave. Se eliminó el ex- ceso de tinción y la monocapa se lavó 5 veces con agua del grifo.
Para medir la diferenciación, se utilizó el software de imagen J. Se seleccionaron y fotografiaron cinco campos representativos de cada muestra. Los valores de diferenciación se expresaron como porcentaje del área cubierta por cada tinción específica.
Expresión de Genes Multipotencia
El ARN total se extrajo usando Trizol. La síntesis de ADNc se preparó usando la transcriptasa reversa M-MLV y el ADNc resultante se usó como molde para la qPCR (PCR cuantitativa). El qPCR se realizó utilizando el sistema BioRad con cuantificación mediante Sybr Green. Los genes de multi- potencia cuantificados fueron OCT4 y NANOG. El gen utilizado para normalizar la expresión génica fue GAPDH y la cuantificación relativa de los genes objetivo se realizó con el método delta delta Ct (2-ÄÄCT).
Análisis Estadístico
Los resultados para cada ensayo fueron expresados como la media aritmética con su respectiva desviación estándar. Las diferencias estadísticas significativas se calcula- ron usando la prueba t-Student para mues- tras dependientes con un valor de p <0.05 usando GraphPad Prism Software v. 8.3.1.
RESULTADOS
Aislamiento y Enriquecimiento Magnético
Las CMM aisladas de líquido sinovial sin purificar (CMM-LS) de las articulaciones de caballo mostraron capacidad de ad- herirse al plástico y mostraron morfología fibroblastoide cuando fueron observadas en el tercer pasaje. De la misma manera, cuan- do se usó la técnica de clasificación de células activadas magnéticamente (MACS), se logró purificar las CMM de líquido sinovial que expresaban el marcador STRO-1 (CMM- LS STRO-1); sin embargo, no mostraron diferencias morfológicas aparentes en compa- ración a las CMM-LS (Figura 1).
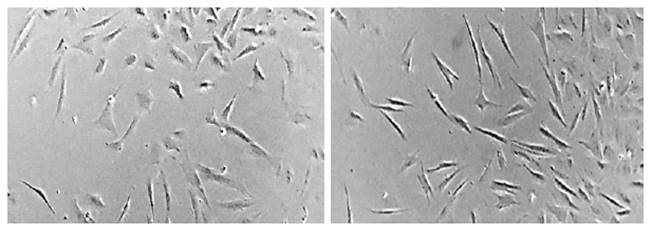
Figura 1 Morfología de las células madre mesenquimales (CMM). Izquierda: CMM-LS. 40X; Derecha: CMM-LS STRO-1. 40X
Proliferación Celular
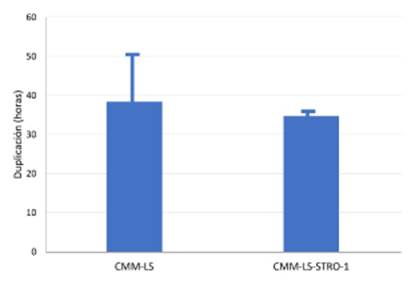
El tiempo de duplicación de las CMM- LS fue de 38.42 ± 12.05 h y de las CMM-LS STRO-1 de 34.7± 1.54 h. Las CMM-LS
STRO-1 muestran una ligera reducción del tiempo de duplicación en 4 h aproximadamente, pero sin diferencias significativas entre los tipos celulares (Figura 2).
Diferenciación Celular
Después de 21 días de inducción a los tres linajes celulares (adipocitos, condrocitos y osteocitos), las CMM-LS y las CMM-LS STRO-1 fueron capaces de diferenciarse en los tres linajes celulares. La diferenciación adipogénica mostró la presencia de pequeñas vesículas lipídicas que fueron positivas a la tinción Oil Red (Figura 3A,B). Las CMM- LS mostraron un área de diferenciación adipogénica significativamente mayor (31.44± 4.16%) con respecto a las CMM-LS STRO-1 (17.33 ± 3.09%), que se relacionó con el tamaño de sus vesículas (Figura 3C).
Durante la diferenciación condrogénica se evidenció la secreción de glucosa- minoglicanos (GAG) que fueron detectados con azul de alcian. La comparación del área de diferenciación condrogénica entre las CMM-LS y CMM-LS STRO-1 no se pudo analizar debido a que estas últimas formaron una micromasa gelatinosa (Figura 4B). Esta cualidad denota cambios en la morfología y arquitectura de la población celular que está asociada a una mayor secreción y deposición de proteínas de la matriz extracelular, siendo esta característica un indicador de una mejor capacidad condrogénica en comparación a las CMM-LS que tuvieron una condrogénesis incompleta, mostrando nódulos aislado de diferenciación (Figura 4A).
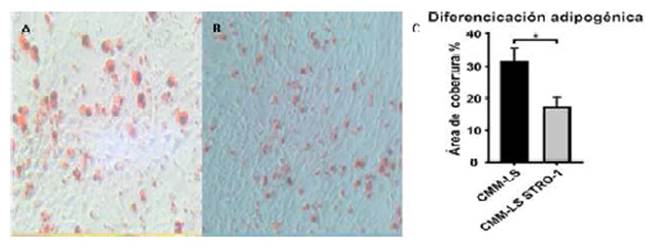
Figura 3 Diferenciación adipogénica. (A) Diferenciación adiposa de CMM-LS. (B) Diferenciación adiposa de CMM-LS STRO-1. (C) Área de cobertura de la diferenciación adipogénica. (p<0.05)
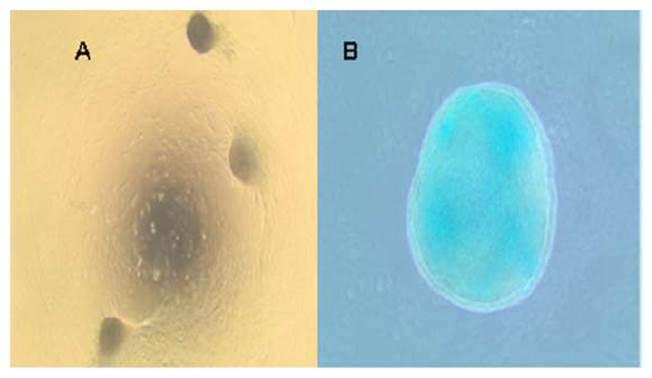
Figura 4 Diferenciación condrogénica. (A) Diferenciación condrogénica incompleta de CMM- LS. (B) Diferenciación condrogénica CMM-LS STRO-1 con formación de micromasa.
Las células que fueron inducidas a diferenciación osteogénica sintetizaron una matriz extracelular rica en cristales de hidroxiapatita de calcio que fueron teñidas positivamente con rojo de alizarina (Figura 5A,B). Las CMM-LS STRO-1 mostraron un área de diferenciación adipogénica significativamente mayor (64.44 ± 40%) con respecto a las CMM-LS (50.67 ± 5.50%, Figura 5C).
Expresión de Genes Multipotencia
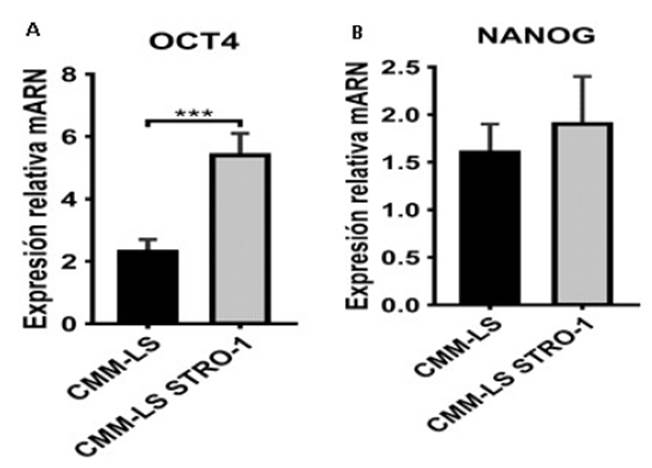
La expresión del factor de transcripción OCT4 muestra un incremento significativo en CMM-LS STRO-1 en comparación a las CMM-LS. La diferencia en el nivel de ex- presión relativa fue de aproximadamente cuatro unidades arbitrarias (Figura 6A). Por otro lado, NANOG, otro factor transcripcional de multipotencia, mantuvo una expresión relativa similar entre las CMM-LS y las CMMLS-STRO-1 (Figura 6B). Este resultado sugiere que existe una correlación entre las células que expresan el marcador STRO-1 y la expresión de OCT4.
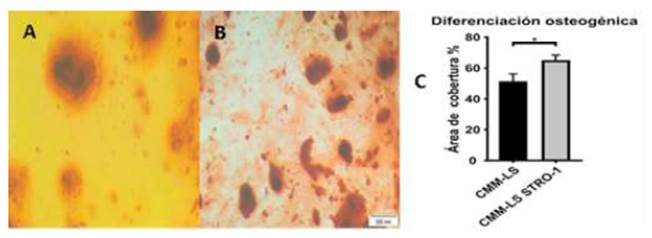
Figura 5 Diferenciación osteogénica. Diferenciación osteogénica de CMM-LS; (B) Diferenciación osteogénica CMM-LS STRO-1 que muestra una deposición mineral masiva; (C) Área de cobertura de la diferenciación osteogénica (p<0.05)
DISCUSION
Se analizaron las propiedades biológicas de las células madre mesenquimales provenientes del líquido sinovial de las articulaciones de las extremidades de caballo (CMM- LS). Las muestras obtenidas fueron caracterizadas por su peculiaridad de adherirse al plástico de los frascos de cultivos, indicador usado también para CMM provenientes de médula ósea (Tondreau et al., 2004) de tejido adiposo (Estrada y Venegas, 2007) y de pulpa dentaria (Takeyasu et al., 2006), entre otras. Se observó que estas células de forma fibroblastoide crecían como focos de células denominadas, según Friedenstein et al. (1976), unidades de fibroblastos formadoras de colonias, que mantienen su morfología por periodos de cultivo relativamente prolonga- dos, lo que ocurre de la misma manera en cultivos de CMM de origen adiposo (Estrada y Venegas, 2007).
Existen distintos mecanismos de sepa- ración de células que permiten organizarlas acorde con ciertas características morfológicas, de manera que se pueda hacer una selección específica con la finalidad de optimizar su aislamiento mediante el enriquecimiento de células precursoras mesenquimales (CMM) con mayor pureza con un biomarcador determinado. Las CMM cardiovasculares humanas obtenidas mediante inmunoselección para el antígeno precursor del estroma 1 (STRO-1) tienen una mayor clonogenicidad, capacidad proliferativa, potencial de diferenciación multilinaje y ex- presión de ARNm con relación a las obtenidas por el método tradicional (Psaltis et al., 2010). Los resultados presentados utilizando la técnica de campos electromagnéticos con el biomarcador de superficie STRO-1 (CMM-LS STRO-1) tienen la capacidad de proliferar más rápidamente que las CMM- LS obtenidas sin purificar. Además, manifestaron una mayor predisposición a ser diferenciadas a condrocitos y osteocitos en comparación con las CMM-LS sin purificar, y una menor predisposición a diferenciarse en adipocitos. Esta predisposición hacia los linajes osteocondrales se debería a que las células que expresan STRO-1 tienen el potencial de formar nuevo cartílago de forma espontánea (Otsuki et al., 2009) y, además, porque los condrocitos del tejido hialino del cartílago articular surgen de las CMM (Vinod et al., 2018). Esta capacidad de las CMM-LS STRO-1 se manifiesta en muestras humanas, diferenciándose en adipocitos, condrocitos y osteocitos (Koyama et al., 2011) Como se puede apreciar las CMM aisladas mediante STRO-1 / (MACS) muestran una tendencia significativa a diferenciarse como linajes osteocondrales.
En las CMM el aumento de su potencial de proliferación y diferenciación está en estrecha relación con la expresión de los factores de transcripción OCT-4 y Nanog, regu- lando positivamente la ADN (citosina-5) metiltransferasa (DNMT-1) codificada en humanos por el gen DNMT-1, importante en el mantenimiento de autorenovación y el estado indiferenciado (Tsai et al., 2012). Es por esto que se utilizan como marcadores para determinar si una célula es pluripotente, ya que, como se ha indicado, están involucrados en la supresión de genes de diferenciación. Resultados similares usando los mismos marcadores de toti y multipotencia han sido re- portados por Prado et al. (2015), sugiriendo que tanto el líquido como la membrana sinovial de equinos parecen ser una fuente de células madre con potencial de pluripotencia.
Estos resultados hacen suponer que la coexpresión de OCT-4 y Nanog podrían incrementar las funciones fisiológicas de las CMM-LS STRO-1 relacionadas con una mejor proliferación, autorrenovación y la predisposición a diferenciarse a los linajes osteocondrales; sin embargo, se necesitan realizar estudios que permitan aclarar el papel funcional de estos marcadores de pluripotencia en células madre adultas. Como aplicación inmediata, los resultados obtenidos podrían constituir una opción atractiva para el tratamiento de lesiones articulares que son comunes en caballos de alto rendimiento.
CONCLUSIONES
Las células madre derivadas del líquido sinovial son de naturaleza mesenquimal, porque expresan los marcadores específicos que permiten identificar su inmunofenotipo.
Las células madre mesenquimales de fluido sinovial positivas a STRO-1 pueden ser fácilmente aisladas utilizando la técnica de MACS.
La coexpresión de OCT4 y NANOG en las CMM-LS STRO-1 podría estar relacionada con sus propiedades fisiológicas.
Las de CMM-LS STRO-1 presentan propiedades biológicas que pueden mejorar la regeneración osteocondral en las articulaciones de caballo.












 uBio
uBio