INTRODUCCION
El axolotl o ajolote (Ambystoma mexicanum), endémico de la ciudad de México, es un anfibio caudado de cuerpo robusto con tres pares de branquias externas. En la antigüedad fue inspiración para la creación de la leyenda del dios «Xolotl» y fuente de alimento, con propiedades medicinales para las culturas mesoamericanas (Barcat, 2018; Zapata y Solís, 2013). En la actualidad es una de especie de importancia para las investigaciones biomédicas, debido a que no experimenta metamorfosis y a que posee la capacidad de regenerar cualquier tipo de tejido (Vázquez-Molina, 2010; Zapata y Solís, 2013). Sin embargo, la especie se encuentra en la categoría de peligro crítico de extinción en México, debido a la contaminación del lago Xochimilco (único lugar donde se encuentra en estado silvestre) (Voss et al., 2015;Vázquez-Molina, 2010), la aparición de enfermedades emergentes como la chitridio- micosis (Fowler, 2012; Mendoza-Almerallaa et al., 2015), la caza indiscriminada y la introducción de especies invasoras (Zambrano, 2010). Se han desarrollado diversos programas de protección para esta especie (Voss et al., 2015; Vance, 2017).
El axolotl ha sido sujeto de múltiples investigaciones tales como, inducción de metamorfosis con hormona tiroidea (Rosenkilde et al., 1995), criopreservación de semen (Chester y Figiel., 2013), fecundación in vitro (Mansour et al., 2011), anestesiología (Zullian et al., 2016), y creación de quimeras hematopoyéticas (Lopez, 2015), entre otras; sin embargo, los estudios hematológicos son escasos, algunos están incompletos, y otros fueron realizados con ejemplares enfermos (Wright, 2001) o con especies no emparentadas (Solis et al., 2007; Finkler, 2013).
Rosenkilde et al. (1995) proporcionaron datos cuantitativos de las líneas celulares hematológicas para axolotl y otras especies. Boutilier et al. (1992) publicaron un reporte de hematología y bioquímica sanguínea realizado en una hembra adulta de axolotl que estaba afectada por una neoplasia ovárica, siendo esta referencia el primer estudio de hematología reportado en axolotls de cautiverio. Iannacone et al. (2008) identificaron la morfología de las líneas celulares hematológicas de Aequidens mauseanus y Ambystoma mexicanum. Barriga-Vallejos et al. (2015) reportaron valores hematológicos del axolotl de Toluca (Ambystoma rivulare), en tanto que Takami y Une (2017) analizaron parámetros de bioquímica sérica y hematocrito provenientes de axolotls mantenidos en cautiverio. De todo lo anterior, se evidencia la carencia de estudios hematológicos específicos para A. mexicanum. Por tal motivo, el objetivo del presente estudio fue determinar los rangos de los valores hematológicos y bioquímicos de axolotls mantenidos en cautiverio en el distrito de San Juan de Miraflores (Lima-Perú).
MATERIALES Y METODOS
Población y Muestra
Previa autorización del Comité de Ética Institucional de la Universidad Científica del Sur, se obtuvieron 32 larvas de axolotls de variedad silvestre (coloración verde olivo y negro, natural de los ejemplares del lago Xochimilco), en aparente buen estado de salud, comprobado por evaluación clínica (piel brillante sin presencia de lesiones hemorrágicas, úlceras o crecimiento de hongos, branquias largas con presencia de filamentos, heces firmes en forma de frejol, sin diarrea) (Wright, 2001). Las larvas tenían 1.5 meses aproximadamente, medían 5 cm de largo y tenían 3 g de peso en promedio.
Las larvas nacieron en cautiverio en el acuario «Huancayo» del distrito de Ate, Lima- Perú, el cual tenía autorización para comercializarlos en calidad de mascotas, según el reglamento nacional (Ley Forestal y de Fauna Silvestre N°2963) (SERFOR, 2015).
Sitio de Estudio
Los ejemplares fueron trasladados en bolsas plásticas llenas de agua a una casa particular del distrito de San Juan de Miraflores, Lima-Perú, donde fueron mantenidos bajo condiciones controladas durante un año, hasta que alcanzaron un peso de 50 g y 30 centímetros de longitud como mínimo, para poder obtener una muestra de sangre suficiente (0.5-0.8 ml) para ser procesada en laboratorio.
Se estableció un periodo de cuarentena de 90 días para observar si alguno de los ejemplares desarrollaba síntomas de enfermedades (Cinco larvas no sobrevivieron). Cada axolotl fue alojado individualmente en recipientes plásticos de 60 por 30 cm y 4 L de capacidad, para evitar conductas de canibalismo (Wright y Whitaker, 2001d). Los recipientes fueron llenados con agua de grifo (pH 6.5 y densidad 1.050 g/ml), la cual fue tratada con solución acondicionadora para peces de acuario (Nutrafin Acua-Plus) a razón de 0.1 ml/L. Se les ofreció un fotoperiodo de 12 horas de luz y oscuridad (Takami y Une, 2017). No se utilizó ningún tipo de sustrato o decoración en los recipientes, para evitar laceraciones en la piel y la presentación de timpanismo por ingesta accidental.
Se realizaron cambios de agua dos ve- ces a la semana, retirando el 50% del volumen total de líquido y completando con agua limpia previamente acondicionada. La temperatura fue mantenida en un rango de 8.3 a 10 °C (Schad, 2008; Servin, 2011; Mena y Montes, 2014). Se realizó la limpieza de sedimento, heces y restos de muda con ayuda de un sifón para acuarios. No se utilizaron equipos de filtración automatizado debido a que las corrientes generadas por la recirculación de agua provocan lesiones y estrés en los ejemplares (Schad, 2008; Servin, 2011; Mena y Montes, 2014).
Se realizaron control de pesos y tamaño mensuales, así como análisis coprológicos por método de sedimentación (Wright y Whitaker, 2001). En dos ejemplares se encontró trofozoítos de protozoarios flagelados, los cuales no recibieron tratamiento, ya que no ocasionaron signos clínicos en los ejemplares y son atribuibles a población comensal del intestino (Wright y Whitaker, 2001).
Los axolotls fueron alimentados con presas vivas, tres veces por semana, empleando para este fin Artemia salina y Tubifex tubifex (previamente desinfectado con albendazol y metronidazol) (Browne, 2009; Servin, 2011).
Colección de Muestras
Se realizó en dos etapas para no sobre- pasar el 1% de peso vivo de sangre recolectada (Wright, 2001; Campbell, 2015a) y cuando los ejemplares tenían dos años de edad. Con la primera muestra se realizó el análisis bioquímico y con la segunda, luego de tres meses, el análisis hematológico (número de eritrocitos, hematocrito, hemoglobina, valores absolutos y relativos de las líneas celulares de leucocitos). Los ejemplares (9 hembras y 18 machos) no recibieron alimento las 48 horas previas a la contención química para reducir el riesgo de emesis (Wright, 2001).
En la contención química se utilizó Eugenol (U.S.P 926) (solución a base de clavo de olor con 99.5% de pureza) diluido en 1 L de agua proveniente de las peceras de los axolotls (dosis: 350 µl/l) (Baitchman y Stetter, 2014). Los especímenes fueron sujetados utilizando guantes de polietileno sin talco (R&G) y colocados en un recipiente de 20 x 15 cm y 1 L de capacidad conteniendo la solución anestésica y mantenido a la misma tempera- tura del recinto (10 °C). Luego de 30-40 minutos se produjo la pérdida del reflejo de enderezamiento y se alcanzó plano quirúrgico (Baitchman y Stetter, 2014). El individuo fue posicionado ventro-dorsal en una esponja humedecida con agua del recinto y se mantuvo la humedad de la piel y branquias con agua del recinto sin anestésico (Wright et al., 2001; Baitchman y Stetter, 2014). La frecuencia cardiaca y saturación de oxígeno fue monitoreada con pulsioxímetro (EDAN H100) y Doppler fetal (Jumper JPO-1008) (Wright et al., 2001b; Baitchman y Stetter, 2014).
Se utilizó una jeringa de tuberculina de 1 ml (25 G x 5/8"; Vanish Point), la cual se cargó con heparina de sodio (Laboratorios Rovi de 1000 UI/ml) para impregnar las paredes, y luego se expulsó el contenido (Wright et al., 2001a; Takami y Une, 2017). La sangre (1% del peso vivo del animal, 0.5-0.8 ml) se tomó de las venas branquiales (Zwemer, 1991) en un minuto de tiempo cronometrado (Wright, 2001a; Campbell, 2015a) y fue almacenada en tubos de heparina de litio (Vacuette LH; Nipro) y mantenidas en refrigeración a 4 °C hasta su procesamiento (una hora después). Todos los ejemplares fueron devueltos a sus recintos luego de 30 minutos (periodo de recuperación), sin que luego de 24 horas se observen efectos secundarios y recibieron alimento.
Procesamiento de Muestras
Las muestras para bioquímica sanguínea fueron procesadas en el laboratorio privado de la Unidad de Cuidados Intensivos Veterinarios (UCIVET), ubicado en Lince, Lima, utilizando el rotor Vet Scan Avian Reptilian Profile Plus en el analizador auto- matizado Vet Scan Vs2 Abaxis, el cual per- mite analizar 10 parámetros. aspartato aminotransferasa (AST) mediante el método modificado IFCC, creatina quinasa (CK) mediante fosforilación inversa, glucosa (GLU) utilizando el método de reducción de cobre, calcio (Ca) con la reacción de Arsenazo III, fósforo (PHOS) mediante sucrosa fosforilasa, proteínas totales (TP) utilizando la reacción de Buriet, albúmina (ALB) utilizando la coloración verde de bromocresol, sodio (Na) mediante coloración enzimática y potasio (K) por espectrofotometría.
Las muestras para el análisis hemato- lógico fueron remitidas al laboratorio Vet Diagnostics, Callao, Perú. Las muestras fue- ron procesadas manualmente empleando un microscopio óptico trinocular Eurotech de campo claro, la cámara de Neubauer y las tinciones Natt-Herrick (conteo total de leucocitos y eritrocitos) y tinción Wright- Giemsa (conteo diferencial de leucocitos). Se determinó el número de eritrocitos (RBC), leucocitos (WBC), eosinófilos, basófilos, heterófilos, azurófilos y linfocitos (Campbell, 2015a; Wright, 2001). Los trombocitos no se pudieron contabilizar debido a la presencia de núcleo y la dificultad para diferenciarlos de los linfocitos (Campbell, 2015b; Wright, 2001). Para la hemoglobina (Hb) se utilizó método fotométrico de metahemoglobina azida fotométrica utilizando un hemoglobinómetro portátil Mission), el hematocrito (Ht) se calculó mediante centrifugación de tubos microcapilares a 12 000 rpm. La hemoglobina corpuscular media (HCM), concentración de hemoglobina corpuscular media (CHCM) y el volumen corpuscular medio (VCM) se calcularon mediante las fórmulas matemáticas respectivas (VCM=Hematocrito (L/L) * 1000/Eritrocitos*(1012/L); HCM=Hb (g/dl) * 10/ Eritrocitos * (1012/L); CHCM=Hb (g/dl) * 10/Hematocrito (L/L)).
Análisis de Resultados
Los rangos referenciales se establecieron según los lineamientos de la Sociedad Americana de Patología Clínica Veterinaria (ASVCP) para muestras de fauna silvestre, exóticos y neonatos, con tamaños muestrales mayores e iguales a 20 y menores a 40 (Kristen y Friedrich, 2012). Estos lineamientos indican que se deben descartar «valores aberrantes», puesto que son atribuidos a errores de muestreo o procesamiento. En este caso se descartaron cinco valores (1 de AST, 3 de glucosa y 1 de fósforo). Para el análisis de los datos se utilizó el programa informático Excel y el paquete estadístico SPSS.
RESULTADOS Y DISCUSION
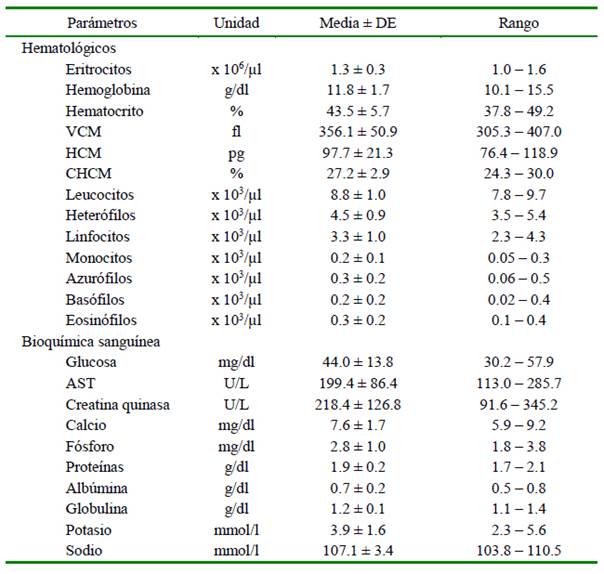
Se determinaron rangos referenciales con media y desviación estándar (DE) de 13 parámetros hematológicos y 10 bioquímicos para la especie Ambystoma mexicanum (Cuadro 1). Solo existen dos reportes de parámetros hematológicos para esta especie, siendo estos los de Iannacone et al. (2008), quienes describen la morfología de las líneas celulares, y los valores relativos mas no los valores absolutos de leucocitos, y el estudio de Takami y Une (2017) quienes solo calcularon el hematocrito y la bioquímica sanguínea, de allí que es difícil comparar los resultados obtenidos. Por otro lado, Boutilier et al. (1992) presentaron valores hemáticos de una sola hembra afectada con una neoplasia ovárica.
Los valores de hematocrito (Ht) reportados por Iannacone et al. (2008) de 8.5- 33.8% son mucho más bajos que los del presente estudio (Cuadro 1), diferencias que pueden deberse a la hidratación, la dieta empleada o a efectos del anestésico utilizado. Un estudio en esturiones siberianos (Acipen-cer baerii) reveló que el Eugenol produce una pequeña elevación de los valores de hemoglobina y hematocrito (Gomulka et al., 2015). Este efecto también se observó para el hematocrito en ratas cuyos valores suboieron ante la exposición a Eugenol (Pandian et al., 2018). Por otro lado, los va- lores de hematocrito del presente estudio se encuentran dentro del rango de 18-47% re- portado por Takami y Une (2017).
Con relación a la bioquímica sanguínea, Takami y Une (2017) reportan valores de 81- 1139 U/L de AST, en tanto que en el presen- te estudio se encuentran en el rango de 113- 285 U/L. Por otro lado, los valores de glucosa de 17-55 mg/dl presentados por estos autores fueron similares a los obtenidos en este estudio (30.2-57.9 mg/dl) (Cuadro 1). Sin embargo, cabe acotar que la glucosa es un parámetro que se ve afectado por el tiempo de procesamiento de la muestra, ya que al pasar las horas las células consumen la glucosa residual obteniendo resultados inferiores. Por otro lado, los valores de creatina quinasa (CK), albumina, globulina, proteínas totales, sodio, potasio y calcio fueron similares a los presentados por Takami y Une (2017).
Por último, los valores de fósforo (1.8-3.8 mg/dl, Cuadro 1) fueron inferiores a los reportados por Takami y Une (2017) de 3-6 mg/dl. Estas diferencias pueden explicarse por la producción de huevos en las hembras, ya que, en especies de aves, reptiles y anfibios, hay una tendencia a la elevación de los valores de calcio y fosforo por estimulación hormonal o formación del cascarón de los huevos (Wright, 2001a). También se ha registrado cambios en las concentraciones de fósforo y calcio en cuadros de acidosis o alcalosis respiratoria (Ghosh y Joshi, 2008). Por esta razón sería conveniente monitorear la ventilación de los anfibios anestesiados y separar parámetros de electrolitos en grupos específicos para machos y hembras, teniendo en cuenta además si el muestreo fue ejecutado en temporada de apareamiento.












 uBio
uBio