INTRODUCCION
Las técnicas de producción in vitro de embriones (PIVE) son atractivas debido a las posibilidades de disminuir los costos de producción de embriones para la transferencia, el diagnóstico molecular pre-implantación, la clonación de células somáticas o de embriones y para la producción de bovinos transgénicos (Otero et al., 2020). Adicionalmente, las PIVE han permitido la investigación básica en los mecanismos de la maduración de oocitos, fertilización y desarrollo embrionario, generando grandes aportes sobre las con- diciones de cultivo y factores que mejoren la producción de embriones de buena calidad (Viana et al., 2012; Lonergan y Fair, 2016). Aun así, se reconoce que la baja eficacia de la PIVE se debe en parte a la reanudación precoz de la meiosis después de la eliminación artificial de los complejos cúmulo-oocito (CCOs) de los folículos antrales (Ramos et al., 2018; Ferré et al., 2020). Cuando el oocito se extrae mecánicamente del folículo antral para la PIVE, el adenosín monofosfato cíclico (AMPc) que está dentro del oocito disminuye y comienza la reanudación meiótica pre- coz. Este proceso, ampliamente conocido como maduración nuclear espontánea, se atribuye al agotamiento de los factores inhibidores del folículo (Ramos et al., 2018).
In vivo, en el modelo bovino, la reanudación meiótica, es adquirida por el oocito, posterior al pico de la hormona luteinizante (LH), la cual modula un aumento del AMPc en las células de la granulosa que rodean al oocito e induce el desacoplamiento de las uniones gap con el oocito, induciendo una reducción en las concentraciones de AMPc intra-oocitarias que permite la activación de factores de transcripción que inducen la reactivación meiótica ((Tsafriri et al., 1996; Conti et al., 2002). Sin embargo, en los procesos de maduración in vitro, el oocito es aspirado de un folículo que no ha alcanzado su máximo tamaño y es cultivado por 24 ho- ras en presencia de las gonadotropinas FSH y LH (Bernal-Ulloa et al., 2016), afectándose la calidad de los embriones producidos bajo estas condiciones de maduración (Lopera- Vasquez et al., 2017).
El AMPc es importante en la transducción de señales dentro de la célula y funciona como mensajero celular. Las concentraciones de AMPc se controlan mediante la modulación de su síntesis, por la enzima adenilato ciclasa que convierte el adenosín trifosfato (ATP) en AMPc y pirofosfato (Ramos Leal et al., 2018). Por otro lado, la de- gradación de AMPc se produce como resultado de la activación de la fosfodiesterasa de nucleótidos cíclicos (PDE) dentro de los complejos cúmulo-oocito (Tsafriri et al., 1996; Ramos Leal et al., 2018). Así, concentraciones relativamente altas de AMPc dentro del oocito, detienen la activación meiótica al suprimir el factor promotor de la maduración (FPM) (Duranthon y Renard, 2001; Mayes y Sirard, 2002; Josefsberg et al., 2003; Jones 2004); por el contrario, concentraciones relativamente menores de AMPc inducen la activación de FPM, lo que resulta en la reanudación de la meiosis (Park et al., 2016; Ramos et al., 2018).
Lo anterior ha conducido a la búsqueda de modificaciones en los protocolos de producción in vitro de embriones, encaminados a la prevención de la maduración nuclear espontánea a través de mediadores químicos. Una alternativa sería el uso de inhibidores de las enzimas fosfodiesterasas del AMPc (Thomas et al., 2004; Botigelli et al., 2017; Ramos et al., 2018; Gupta et al., 2020). Debido a la expresión específica de PDE en la unidad folicular, se han evaluado medicamentos que permitan una inhibición selectiva, aumentando la concentración intracelular de AMPc, ya sea en las células de la granulosa o en el oocito (López et al., 2008). Resulta- dos previos de este grupo de investigación demostraron que el Rolipram, un inhibidor de fosfodiesterasas tipo 4 (PDE4), puede reemplazar la acción de las hormonas gonadotrópicas FSH y LH durante el proceso de maduración in vitro de oocitos bovinos (López et al., 2008). Sin embargo, la especificidad del Rolipram por las PDE-4 es del orden micromolar e inhibe otras fosfodiesterasas en otros tejidos, presentan- do efectos colaterales (López et al., 2008; Ramos Leal et al., 2018). De esta manera, se han desarrollado nuevas generaciones de inhibidores con constantes de inhibición más bajas (Huang et al., 2001; Bolger, 2017), que pueden inducir la maduración del oocito sin afectar su competencia para el desarrollo embrionario in vitro.
El 4- (3-clorofenil) -1,7-dietilpirido [2,3- d] pirimidin-2 (1 H)-ona o YM976 es un inhibidor específico de la PDE-4 (Aoki et al., 2001a). Se han estudiado sus efectos en procesos inflamatorios (Aoki et al., 2000), como antiasmático (Aoki et al., 2001b), como relajante muscular (Moriuchi et al., 2003), como inhibidor de la proliferación de líneas células tumorales (Kowalczyk et al., 2009), como inhibidor de la emesis y náuseas (McDonough et al., 2020) y en combinación con fármacos anestésicos (Aragon et al., 2021). No obstante, no se ha evaluado como inhibidor específico de la PDE-4 durante las PIVE. En la actualidad su nombre ha sido modificado como Y4877 según el catálogo de Sigma Aldrich. En consecuencia, el objetivo de este trabajo fue evaluar el efecto del inhibidor de fosfodiesterasas tipo 4, YM976, sobre la maduración in vitro de oocitos bovinos y su capacidad para formar embriones después de la fertilización.
MATERIALES Y METODOS
Colecta de Ovarios y Manipulación de los Oocitos
Los ovarios de bovino fueron obtenidos de hembras sin definición de raza, sacrifica- das en la Central Ganadera de Medellín, Colombia. Inmediatamente después de la evisceración, se eligieron los órganos reproductivos en cuyos ovarios hubiera al menos un cuerpo lúteo. Los ovarios fueron removidos y depositados en solución tampón de fosfato salino (PBS) estéril a 37 °C, y trasladados al Laboratorio de Genética de la Universidad Nacional, sede Medellín, en un tiempo no mayor a 30 minutos.
En el laboratorio, los ovarios fueron la- vados dos veces con solución PBS atemperado a 37 ºC y puestos en baño maría a la misma temperatura. Los folículos ováricos con tamaño entre 3 y 8 mm fueron aspirados con jeringa de 5 ml y aguja N.° 18. El líquido folicular conteniendo los CCOs fue deposita- do en un tubo cónico de 15 ml a 37 °C y protegido de la luz. Los aspirados foliculares se pasaron por un filtro de células de poros de 100 ìM de diámetro. Los oocitos fueron se- parados y depositados en caja de Petri estéril de 60x15 mm, con 3 ml de medio TCM-199 con sales de Hank (Tissue Culture Medium 199, Gibco/Invitrogen). Los CCOs fueron clasificados morfológicamente bajo visión por estereomicroscopio y solo aquellos con células del cumulus compacto y con más tres capas de células de la granulosa fueron seleccionados para el proceso de maduración in vitro (Lindner y Wrigth, 1983; Hawk y Wall, 1994; Ayala et al., 2018). Finalmente, los CCOs fueron lavados tres veces en me- dio TCM 199 con sales de Hank y transferidos a caja de Petri de 35 mm con el mismo medio, para ser utilizados en los procedimientos experimentales.
Maduración in vitro (MIV)
El medio base de maduración in vitro estuvo compuesto por TCM199 (12340030, sales de Gibco Earls), que contenía 25 mM de L-glutamina, 6 mg/ml de albúmina de fracción V (BSA), suero fetal bovino al 3%, 1 µg/ml de 17 β-estradiol, piruvato de sodio 0.30 mM y ácido ascórbico 100 µM. El medio fue servido en gotas de 50 ml y cubiertas con aceite mineral en cajas de Petri de 35 mm de diámetro. Los CCOs fueron depositados en grupos de 10 por gota para la maduración in vitro. Las condiciones de cultivo fueron
38.5 °C, 5% de CO2 y 90% de humedad relativa (Otero et al., 2017).
Tratamientos Experimentales
Los CCOs fueron asignados al azar en una de las seis condiciones de MIV, dos con- troles (positivo y negativo) y cuatro tratamientos experimentales. Control 1 (C1): medio de maduración suplementado con 25 µg/ml de hormona estimulante del folículo (Folltropin), 5 UI/ml de hormona luteinizante (Chorulon); Control 2 (C2): medio base de maduración sin suplementación hormonal; Tratamiento 1 (YM1), Tratamiento 2 (YM10), Tratamiento 3 (YM100), Tratamiento 4 (YM1000): medio base de maduración suplementado con 1, 10, 100 o 1000 nM de YM976, respectivamente.
Para evaluar la reanudación de la meiosis en metafase II, los oocitos fueron desnudados y teñidos con Hoechst 33342. Se utilizó un microscopio de fluorescencia (Nikon Eclipse 80i, con filtro C-FL UV-2E/C de 465- 495 nm) para determinar la expulsión del primer cuerpo polar en los seis tratamientos.
Fertilización y Desarrollo in vitro
Cumplidas las 24 horas de maduración in vitro en las condiciones de cultivo, los CCOs fueron lavados en medio de fertilización FERT-TL (IVL02, Caisson Laboratories, USA) suplementado con 10 mg/ml de heparina (Sigma H0519), hipotaurina 1 mM (Sigma H1384), epinefrina 250 mM (Sigma E4642), penicilamina 2 mM (Sigma P4875), solución antibiótica 1X (ICN 1670049 MP Biomedicals) y transferidos a gotas de 50 µl del mismo medio.
Para todos los procesos de fertilización in vitro se utilizó semen congelado del mismo toro. El semen fue descongelado a 37 °C por 1 min, se seleccionaron los espermatozoides viables y móviles mediante gradiente de swim up durante 45 min. Se utilizó una concentración final de 2x106 espermatozoides/ml. Las condiciones de fertilización fueron de 38.5 °C, 5% de CO2 y 90% de humedad relativa, durante 18-20 horas. Finalizado el tiempo de fertilización, los cigotos fueron transferidos a medio de cultivo KSOM-Evolve (día 1) suplementado con 6 mg/ml de albúmina sérica bovina (BSA-FAF), solución antibiótica 1X y suero fetal bovino al 3% para evaluar el desarrollo embrionario temprano (D1).
Análisis de los Datos
La evaluación de la expansión del complejo cúmulo-oocito se hizo a las 24 horas de MIV, mediante el uso del estereomicroscopio (Nikon SMZ 450, Nikon Instruments, USA). Se consideró como Grado 1: poco o nada de expansión, Grado 2: la expansión moderada de las capas externas del cúmulo y, Grado 3: expansión de todas las capas (Calder et al., 2003; Ayala et al., 2018). La reanudación de la metafase II se evaluó por la expulsión del primer cuerpo polar. En el desarrollo embrionario temprano, se determinó la tasa de clivaje como número de embriones con dos o más células sobre el total de oocitos inseminados al día 3 (D3), el número de embriones con cuatro o más células sobre el total de oocitos inseminados al D3, la tasa de producción de blastocistos al día 7 (D7) y la tasa de producción de blastocistos expandidos al día 8 (D8).
Los datos fueron tomados utilizando cada una de las gotas de cada tratamiento como una repetición, sobre las cuales se realizaron las mediciones de las variables de respuesta, expansión de las células del cúmulo, reactivación de la meiosis II y desarrollo embrionario temprano (clivaje, embriones de cuatro o más células, embriones en etapa de blastocisto y en blastocisto expandido). El efecto los tratamientos sobre cada variable fue analizada mediante un análisis de varianza unifactorial. Se realizaron pruebas de comparación entre medias mediante la prueba de Tukey para tamaño de muestra (n) desigual en las variables de respuesta. Se estimaron correlaciones de Pearson entre las variables, grado de tres de expansión del cúmulo, reanudación de la meiosis II, tasa de clivaje, embriones con cuatro o más células y porcentaje de embriones en etapa de blastocisto y blastocisto expandido considerando una diferencia estadísticamente significativa con un valor de p<0.05. Todos los análisis se realiza- ron utilizando el programa Statistica v. 10.0 (TIBCO Software, Tulsa OK, USA).
RESULTADOS
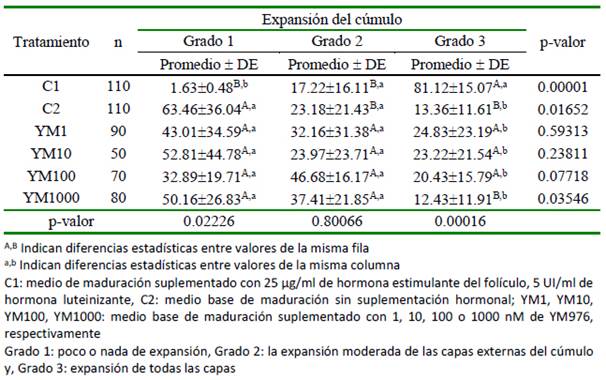
El efecto del uso del YM976 sobre el grado de expansión de las células de cúmulo a 24 horas de maduración in vitro se presenta en el Cuadro 1. En los grupos control, C1 presentó el mayor grado de expansión (grado 3) (p= 0.00001), en tanto que para C2 fue en el grado 1 (p= 0.01652). El porcentaje de grado expansión de las células del cúmulo no varió significativamente entre los grupos suplementados con YM976. Por otro lado, para el grado 1 de expansión, el menor porcentaje se observó en el grupo de oocitos madurados en presencia de gonadotropinas (C1) (p= 0.02226); en cambio, para el grado 3, la mayor cantidad de oocitos con cúmulo expandido se encontró en C1 (p=0.00016), no habiendo diferencias significativas entre tratamientos para el grado 2.
Cuadro 1.Efecto del uso del YM976 en la expansión de las células de cúmulo a 24 horas de maduración in vitro de complejos cúmulo-oocito bovinos (%)
Cuadro 2 Efecto del uso del YM976 en la reanudación meiótica de oocitos bovinos cultivados in vitro (%)
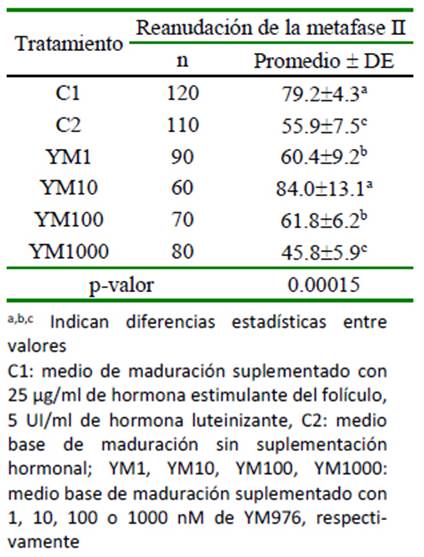
Los oocitos madurados en presencia de gonadotropinas (C1) y bajo una concentración del inhibidor de PDE-4 YM976 de 10 nM (YM10) presentaron los porcentajes más altos de reanudación de la metafase II (Cuadro 2). Los tratamientos YM1 y YM100 presentaron resultados similares entre sí, pero menores a C1 y YM10. Los menores porcentaje de reanudación meiótica se observa- ron en YM1000 y C2.
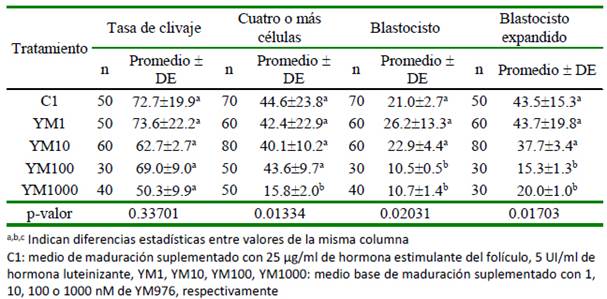
El desarrollo embrionario temprano por efecto del YM976 durante la producción in vitro de embriones bovinos se presenta en el Cuadro 3. La tasa de clivaje al día 3 no varió entre tratamientos (p=0.33701). El número de embriones con cuatro o más células fue menor en YM1000 (p=0.01334). El porcentaje promedio de embriones que alcanzó esta fase en C1, YM1, YM10 y YM100 fue de 42.68%. El porcentaje de embriones que se desarrollaron hasta la etapa de blastocisto al día 7 y la fase de blastocisto expandido fue mayor (p= 0.02031 y p=0.01703, respectivamente) en C1, YM1 y YM10 respecto a YM100 y YM1000.
Cuadro 3 Efecto del uso del YM976 en el desarrollo embrionario temprano durante la producción in vitro de embriones bovinos (%)
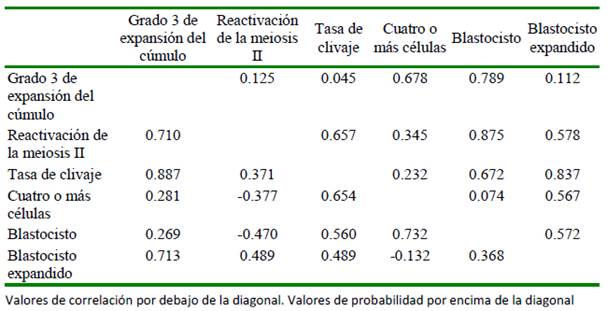
Las correlaciones de Pearson entre las variables en estudio se presentan en el Cuadro 4. Solo se encontró una correlación significativa (p= 0.045) y de magnitud positiva, entre el grado 3 de expansión del cúmulo y la tasa de clivaje. La reactivación de la meiosis II presentó correlaciones negativas (p>0.05) con las variables de desarrollo embrionario temprano, al igual que entre en embrión con cuatro o más células y los blastocistos expandidos.
DISCUSION
La maduración del oocito se inicia durante el crecimiento folicular y se completa durante el pico preovulatorio de LH, el cual induce la ovulación. Esta maduración, involucra cambios a nivel citoplasmático y nuclear, que capacitan al oocito para los posteriores eventos como la fertilización y el desarrollo embrionario (Sovernigo et al., 2017). Por otro lado, la competencia meiótica se re- fiere a la capacidad del oocito para completar el ciclo meiótico o maduración nuclear, que es adquirida durante el crecimiento folicular y está estrechamente relacionada con el tamaño del oocito y este a su vez con el tamaño del folículo (Bo y Mapletoft, 2013); mientras que la adquisición de la competencia para el desarrollo depende de la íntima relación del oocito con las células de la granulosa, cuya función principal es la de nutrir al oocito hasta etapas finales de su desarrollo (Alemu et al., 2018).
Cuadro 4 Correlaciones de Pearson entre las variables de respuesta estudiadas sobre la maduración y desarrollo embrionario temprano durante la producción in vitro de embriones bovinos
Sin embargo, durante la producción in vitro de embriones, los oocitos son aspirados del folículo, interrumpiendo la maduración que ha estado adquiriendo durante la dinámica folicular, para ser sometidos a una maduración forzosa en presencia de gonadotropinas. Durante este tiempo, las gonadotropinas inducen la expansión y maduración nuclear hasta metafase II en el oocito, procesos que son mediados principalmente por la vía del AMPc (Ramos et al., 2018). Cuando los ni- veles de AMPc dentro del oocito descienden, se induce la continuación de la meiosis, caracterizada por el rompimiento de la vesícula germinal generando la maduración del oocito (Ferré et al., 2020). A su vez, los niveles de AMPc son regulados por las enzimas fosfodiesterasas (PDE) que hidrolizan el AMPc en AMP, con una expresión especifica de compartimiento en la unidad folicular, donde la PDE tipo 3 (PDE-3) se expresa en el oocito y la PDE tipo 4 en las células del cúmulo (López et al., 2008; Gupta et al., 2020). Así entonces, la utilización del YM976 debería prevenir la degradación de AMPc en oocitos bovinos, resultando en su acumulación en cúmulos y oocitos, manteniendo es- tables las uniones gap, retardando la reanudación de la meiosis (Santana et al., 2019). Esta prolongación de las uniones gap durante la maduración in vitro en presencia de inhibidores de PDE-4 podría permitir el paso de metabolitos, iones, nucleótidos y aminoácidos, que mejoran la maduración citoplasmática del oocito, aproximándose a una sincronización entre la maduración citoplasmática y nuclear (Luciano et al., 2011).
De cumplirse lo anterior, el porcentaje de maduración nuclear encontrado en los tratamientos YM1, YM10, YM100 y YM1000, deberían ser similares al encontrado en cúmulos madurados en presencia de gonado-tropinas. Sin embargo, el resultado demuestra una cinética diferente, donde, tanto para los grados 1 y 3 de expansión del cúmulo, las estructuras maduradas en presencia de gonadotropinas fueron mayores (Cuadro 1). En el grado 3, es clara la relación inversa entre el porcentaje de maduración y el aumento en la concentración de YM976 en el medio de cultivo. También, durante la reanudación de la meiosis II (Cuadro 2), se nota que, en la concentración de 10 nM de YM976 se alcanza el mayor valor, para luego disminuir de manera inversamente proporcional a la concentración de YM976. Estos resultados podrían ser explicados de dos maneras: concentraciones altas de YM976 (YM100 y YM1000) podrían tener efecto inhibitorio sobre la PDE-3 localizada en el oocito; por otro lado, la expresión diferencial de subtipos de PDE-4 (A, B, C, D) o variantes generadas por splicing alternativo, provocarían una amplia variedad de isoformas de fosfo diesterasa con mecanismos diversos de regulación de la actividad su catalítica (Santana et al., 2019).
Resultados similares son presentados al utilizar los inhibidores de PDE-4 Rolipram, Burolactona I, Ro 20-1724, Roflumilast y Roscovitina, sobre la reanudación de la meiosis II (Huang et al., 2001; Sagirkaya et al., 2007; López et al., 2008; Marques et al., 2011; Santana et al., 2019). Esto demuestra las posibles diferencias en la cinética de maduración según el bloqueador y su mecanismo de acción. Este reporte sería el primero en evaluar el efecto del YM976 sobre el grado de expansión de cúmulo, un indicador confiable de la futura calidad del embrión (Bo y Mapletoft, 2013; Lopera-Vasquez et al., 2017).
El porcentaje de clivaje no varió significativamente entre todas las condiciones experimentales utilizadas, con un rango entre 50.3 y 73.6%, sugiriendo que el porcentaje de clivaje no es un buen criterio para evaluar la competencia del oocito, debido a que se presentaron diferencias en el porcentaje de maduración nuclear que no se correlacionan con los porcentajes de clivaje. Tasas similares a las del presente estudio son reportados por Alm et al. (2005) (67.4%), Sagirkaya et al. (2007) (76.2%) y Santana et al. (2019) (67.5%), utilizando otros inhibidores de PDE. Por otro lado, el porcentaje de em- briones en estado de cuatro o más células fue similar a otros reportes (Sirard, 2017; Marques et al., 2011; Santana et al., 2019). En el presente estudio, solo el tratamiento de mayor concentración del inhibidor YM976 (YM1000) fue diferente al resto de tratamientos, sugiriendo que esa concentración puede tener un efecto deletéreo durante la maduración de oocito. Esto también se observó por la correlación negativa entre embriones en estado de cuatro o más células y el porcentaje de embriones en estado de blastocisto expandido.
Concentraciones bajas de YM976 (1 y 10nM) favorecieron el desarrollo de los embriones hasta la etapa de blastocisto, con porcentajes similares a los obtenidos en los oocitos madurados en presencia de gonadotropinas. Esto es concordante con el uso de Rolipram (López et al., 2008, Santana et al., 2019) y Burolactona I (Marques et al., 2011) como inhibidores de PDE en el medio de cultivo. Estas diferencias en el porcentaje de blastocistos con YM100, a pesar de que el porcentaje de maduración nuclear y de clivaje fueron similares a los resultados con YM1, sugieren que el parámetro del porcentaje de blastocisto es un criterio de evaluación de la competencia y calidad del oocito.
Los datos sugieren una relación inversa entre la concentración del YM976 en el me- dio de maduración del oocito y la cantidad de embriones que llegaron hasta la etapa de blastocisto expandido, obteniéndose valores similares al control con bajas concentraciones del inhibidor (1 y 10 nM). Es posible que la baja eficiencia en la producción de em- briones podría estar relacionadas con la concentración del inhibidor; no obstante, también podría ser afectada tanto por la calidad intrínseca del oocito como por las condiciones cultivo in vitro. En este sentido, se ha re- portado que cuando la maduración nuclear de los oocitos se produce durante un periodo de tiempo prolongado utilizando un inhibidor de PDE-4 en el medio de maduración, la calidad de los embriones producidos es clara- mente reducida (Santana et al., 2019). Sin embargo, en el presente estudio, la duración del proceso de maduración in vitro para todos los tratamientos fue de 24 horas, que es el tiempo usual para este procedimiento.
Por último, las diferencias entre los resultados del presente estudio y los reportes de literatura podrían justificarse por el tipo de oocitos recuperados en ovarios de planta de sacrificio, los cuales son heterogéneos en términos de calidad y competencia. Finalmente, se sugiere evaluar un rango entre 1 y 10 nM para determinar la concentración optima del inhibidor para la producción in vitro de em- briones bovinos.
CONCLUSIONES
Las concentraciones 1 y 10nM del inhibidor de PDE-4 YM976, durante la maduración in vitro de oocitos, disminuyen la expansión de las células de la granulosa.
Altas concentraciones (100 y 1000 nM) del inhibidor de PDE-4 YM976 presentan efectos deletéreos sobre la producción in vitro de embriones bovinos, mientras que, en concentraciones de 1 y 10 nM como único estímulo, presentan una maduración nuclear y competencia para el desarrollo embrionario similar a los oocitos madurados con gonadotropinas, sugiriendo que pueden ser aplicadas en procesos de maduración in vitro de oocitos bovinos.












 uBio
uBio 

