INTRODUCCION
El uso de crioprotectores reduce los efectos perjudiciales de la congelación y descongelación sobre los espermatozoides, ya que los protege del choque térmico, el estrés osmótico y las alteraciones en la fluidez y la permeabilidad de la membrana (Murphy et al., 2017). A pesar de los buenos resultados obtenidos con crioprotectores como la yema de huevo y la leche (Bergeron y Manjunath 2006), existe un énfasis creciente en la necesidad de eliminar productos de origen animal de los diluyentes de congelación, con el fin de facilitar la comercialización internacional de semen congelado (Layek et al., 2016; Anzar et al., 2019). Además, éstos presentan una alta variabilidad en sus componentes (Plante et al., 2015), interfieren y dificultan la evaluación microscópica y los ensayos metabólicos y bioquímicos en el semen diluido (Singh et al., 2012, 2013), y pueden alte- rar la integridad estructural y funcional de los espermatozoides descongelados (Pugliesi et al., 2012). Así mismo, se ha reportado que los productos de origen animal pueden pre- sentar endotoxinas que reducen la capacitad fertilizante de los espermatozoides (Aires et al., 2003), y que microorganismos como Escherichia coli, Staphylococcus, Strepto- coccus, Pseudomonus,Haemophilus, Sal- monella, Campylobacter, Listeria y Myco-plasma, así como el virus de la influenza aviar pueden ser transmitidos por la yema de huevo (Thibier y Guerin, 2000).
Entre las alternativas para reemplazar la yema de huevo y la leche en los diluyentes de congelación de semen bovino se destaca el uso de lecitinas de soya (Aires et al., 2003); sin embargo, los diluyentes basados en este componente varían bastante entre lotes y producen tasas de fertilidad inconsistentes (Van Wagtendonk-de Leeuw et al., 2000; Layek et al., 2016). Por lo tanto, se ha recurrido al uso de componentes lipídicos purificados como el colesterol o los liposomas, los cuales han mostrado una capacidad equivalente de protección espermática a la obtenida con los diluyentes convencionales de congelación; sin embargo, su uso comercial se ha visto limitado por su alto costo (Röpke et al., 2011; Kumar et al., 2015; Anzar et al., 2019). Las lipoproteínas de baja densidad (LDL) purificadas han sido otra alternativa para reemplazar la yema de huevo en los diluyentes de congelación, alcanzando niveles de protección espermática equivalentes o superiores a la yema de huevo entera (Moussa et al., 2002; Varela et al., 2020a).
El caseinato de sodio (CS) es un aislado de caseína que se obtiene mediante la precipitación de las caseínas de la leche y su neutralización con hidróxido sódico, que por su producción estandarizada podría ser una alternativa de origen animal para la congelación de semen bovino. Es probable que el componente crioprotector de la leche sean las micelas de caseína, que son sus principales proteínas (Bergeron et al., 2007). Mediante estudios previos se ha demostrado que las micelas de caseína pueden proteger el semen bovino, equino y de pequeños rumian- tes durante el almacenamiento a 4 ºC (Batellier et al., 1997; Bergeron et al., 2007). El objetivo de este estudio fue evaluar el uso de caseinato de sodio (CS) en la dilución y la congelación del semen bovino, y su efecto sobre la calidad y la capacidad fertilizante in vitro de los espermatozoides.
MATERIALES Y METODOS
Recolección de Muestras
El material de investigación se recolectó en el departamento de Antioquia, Colombia. Cinco machos bovinos (Bos indicus y Bos taurus) entre tres y cinco años fueron usados para la colecta de semen mediante el método de electroeyaculación (ElectroJac5, Neogen Corporation, USA). Se obtuvieron tres eyaculados por animal para un total de 15 eyaculados. Los animales estuvieron so- metidos a condiciones estándar de alimentación, ambiente, manejo reproductivo, y pre- sentaron una condición corporal entre 3 y 4 (escala de 1 a 5). Se estableció un periodo de descanso sexual de una semana antes de cada colecta de semen. Con una cinta escrotal se evaluó la circunferencia escrotal de cada toro al nivel del diámetro mayor de ambos testículos. Se evaluó el volumen de cada eyaculado utilizando una probeta graduada y la concentración espermática mediante un fotómetro Spermacue® (Minitube, Tiefenbach, Alemania). El Comité Institucional para el Cuidado y Uso de Animales de la Universidad CES (CICUA), en su sesión número 38 del 18 de noviembre de 2019 aprobó los protocolos experimentales del presen- te estudio (Proyecto N.°. 200).
Dilución y Criopreservación del Semen
Cada eyaculado fue dividido en cuatro alícuotas que fueron diluidas en un medio compuesto por Triladyl® (Minitube, Tiefenbach, Alemania) con 8% v/v de lipoproteínas de baja densidad (LDL) (Moussa et al., 2002), y suplementado con caseinato de sodio (CS) mediante cuatro tratamientos: CS 3% p/v (CS3), CS 4% p/v (CS4), CS 5% p/v (CS5) y sin CS (Control). La concentración espermática final para todos los tratamientos fue de 60 x 106 espermatozoides/ml.
El semen se empacó en pajillas para 0.5 ml mediante un equipo automático de empaque y sellado por ultrasonido (MRS1 Dual V2, IMV Technologies, Francia). Las pajillas se mantuvieron a 4 °C durante 2 h. Posteriormente, se sometieron a vapores de nitrógeno líquido durante 15 minutos y luego fueron sumergidas en un tanque con nitrógeno líquido. Se congelaron tres pajillas por tratamiento a partir de cada eyaculado y toro, para un total de 180 muestras de semen. La descongelación del semen se realizó mediante un baño de agua a 37 °C durante 60 s.
Evaluación del Semen
Se evaluó la calidad del semen fresco, diluido y criopreservado para cada uno de los tratamientos establecidos. La movilidad y la cinética espermática se evaluaron mediante el sistema computarizado Sperm Class Analizer (SCA®, Microptic SL, España). Se utilizó un microscopio de contraste de fase (Nikon E200, Japón) con una cámara digital (Scout SCA780, Basler, USA). Se analizó la movilidad total (MT), la movilidad progresiva (MP), la velocidad curvilínea (VCL), la velocidad media (VAP), la velocidad lineal (VSL), la amplitud del desplazamiento lateral de la cabeza (ALH) y la frecuencia de batido (BCF) (Varela et al., 2020b). La integridad funcional de la membrana plasmática de los espermatozoides se evaluó la mediante la prueba hipoosmótica (HOS) (Neild et al., 1999).
Adicionalmente, se evaluó la morfología normal (MN) y la vitalidad espermática (VE) del semen fresco y diluido mediante la tinción con eosina-nigrosina (Barth y Oko, 1989), y la integridad estructural de la membrana (IEM) y la integridad acrosómica (IA) del semen descongelado mediante microscopía de fluorescencia.
La IEM se evaluó mediante el kit Live/ Dead (Thermo Fisher Scientific, USA). Se preparó una suspensión de espermatozoides a una concentración de 20 x 106 espermatozoides/ml en solución Hanks Hepes (HH) suplementada con 1% de albúmina sérica bovina (BSA). Dicha suspensión se incubó por 5 min a 35 °C con 6 mM de SYBR-14 y luego otros 5 min con 0.48 mM de yoduro de propidio. Se evaluaron los patrones de fluorescencia mediante un microscopio E200 con fluorescencia HBO (Nikon, Japón).
La IA de los espermatozoides se evaluó mediante el uso de la sonda fluorescente FITC-PNA (Sigma, USA) (Rathi et al., 2001). Se realizó un extendido de cada muestra espermática, el cual se fijó por 10 minutos con etanol al 95%. Luego, se dejó secar a temperatura ambiente y se agregaron 25 µl de 5 µg/ml de FITC-PNA en solución buffer fosfato (PBS). Cada extendido se guardó en oscuridad por 30 min y se lavó con agua destilada. Se evaluaron 200 espermatozoides usando un microscopio E200 con fluorescencia HBO (Nikon, Japón).
Evaluación de la Capacidad Fertilizante in vitro del Semen Descongelado
Se colectaron ovarios bovinos en la planta de beneficio de la Central Ganadera de Antioquia (Medellín, Colombia), se deposita- ron en solución salina (0.9% NaCl) a 34 °C y se transportaron en termos durante 30 min. Se colocaron en un baño serológico a 30 °C, se aspiraron los folículos de 2 a 8 mm con una jeringa de 5 ml y una aguja 18G. El líquido folicular se decantó por 15 min a 30 °C en un tubo cónico de 50 ml y el pellet se empleó para seleccionar los oocitos grado 1 y 2 según criterios de calidad previamente establecidos (Quispeet al., 2018).
Para la maduración in vitro, los oocitos se lavaron en medio B199, compuesto de TCM 199 y bicarbonato de sodio (25 mM), suplementado con 0.2 mM de piruvato de sodio, 10 µg/ml de sulfato de gentamicina y 10% de suero fetal bovino, y enriquecido con 0.5 µg/ml de FSH, 5.0 µg/ml de LH y 1 µg/ml de estradiol. Se transfirieron a cajas de Petri, que contenían gotas de 70 µl de medio B199 pH de 7.4. Se colocaron 10 oocitos/gota, se agregaron 3.5 ml de aceite mineral y se incubaron por 24 h a 38.5 °C, 95% humedad relativa y 5% de CO2.
La fertilización in vitro de los oocitos se realizó con espermatozoides bovinos seleccionados por el método del gradiente de Percoll® (Sigma, USA). Se emplearon 250 µl de Percoll 90% y 250 µl de Sperm-TALP, que se mezclaron suavemente. El gradiente se elaboró colocando 500 µl de Percoll 90% y sobre este, 500 µl de Percoll 45%. Se incubaron a 38.8 °C y se depositó 500 µl de semen descongelado sobre las dos capas de Percoll. Se centrifugó a 300 g durante 20 min. Se recuperó el precipitado mientras el Percoll fue eliminado. Para cada tratamiento se realizaron entre 3 y 5 repeticiones (según la disponibilidad de oocitos por proceso), donde cada gota con 10 oocitos, se tomó como una repetición.
Se preparó el medio Fert-TALP, suplementado con 10 µl/ml de solución antibiótica, 2 U/ml de heparina, 2 mM penicilamina, 1 mM hipotaurina, 250 mM epinefrina, 1 mM piruvato y 6 mg/ml albúmina sérica bovina (BSA). En cajas de Petri se colocaron gotas de 70 µl, donde inicialmente se agregó 35 µl de medio de fertilización, 3.5 ml de aceite mineral y 35 µl de medio. Previo a la coincubación de oocitos con espermatozoides, se evaluó su estadio de maduración por medio de la visualización de la expansión de las células del cúmulus (Restrepo y Vásquez, 2009). Se tomaron 5 µl de cada muestra de semen y se diluyó en agua destilada para la evaluación de la concentración. Se ajustó el volumen requerido para obtener una concentración de un millón de espermatozoides/gota. Se coincubaron los oocitos y los espermatozoides por 24 h. Para cada proceso se realizaron grupos control de oocitos sin espermatozoides para estimar partenogénesis.
El cultivo in vitro se realizó en el medio de desarrollo CR-1aa compuesto por 114.6 mM NaCl, 3.08 mM KCl, 26.18 mM NaHCO3 , 2.52 mM lactato de sodio, 0.55 mM L-lactato, 0.4 mM piruvato de sodio, 1.5 mg/ml glutamina, 3 mg/ml BSAFAF, 1% solución de antibiótico antimicótico, 10 µl/ml MEM esencial y 20 µl/ml BME aminoácidos no esenciales. Se eliminaron las células del cúmulus de los oocitos por pipeteo, los presuntos cigotos se lavaron tres veces y se trasladaron a medio de cultivo (día 1), empleando gotas de 100 µl cubiertas de 3.5 ml de aceite. Luego se colocaron nuevamente en la incubadora, en las mismas condiciones hasta el día 7. En este periodo se evaluó el clivaje, el cual se ajustó al restar el porcentaje de partenogénesis, y la producción final de blastocistos.
Análisis Estadístico
Se ajustaron modelos mixtos para cada variable de calidad seminal y para la tasa de producción in vitro de embriones (variables dependientes), en los cuales se incluyó el efecto fijo del tratamiento y el efecto aleatorio del eyaculado anidado dentro del toro. El modelo estadístico fue: Yijkl = µ + Ttoi + Rij + Tor (Ey)k + eijkl, donde Yijklmn: Variable dependiente (parámetro de calidad seminal o producción de embriones), µ: Media, Ttoi : Efecto fijo del tratamiento (i). (i= Control, CS3, CS4, CS5), Rij : Efecto fijo de la repetición o pajilla (j) (j=1….5), Tor (Ey)k : Efecto aleatorio anidado del eyaculado dentro del toro (k), eijkl: Error aleatorio.
La normalidad de los datos se evaluó mediante la prueba de Shapiro-Wilk. La comparación de las medias se realizó con la prueba de Tukey. Para el análisis de la capacidad fertilizante in vitro se realizó una prueba de Kruskal-Wallis. Se estableció un nivel de significancia de p<0.05. Los resultados se expresan como media ± error estándar de la media. Todas las evaluaciones se realizaron con el programa SAS 9.2. (SAS Inst., USA).
RESULTADOS
La circunferencia escrotal fue de 39.9 ± 0.52 cm. Los resultados para los parámetros de calidad del semen fresco se presentan en el Cuadro 1. El volumen y la concentración de espermatozoides fueron los parámetros de calidad seminal de mayor variabilidad.
Cuadro 1. Calidad de semen fresco de cinco toros (Bos indicus y Bos taurus) de 3-5 años (Medellín. Colombia)
Cuadro 3. Calidad posdescongelación del semen bovino congelado con el empleo de caseinato de sodio como crioprotector
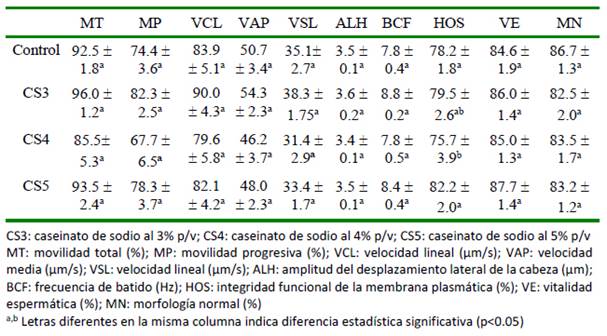
El efecto aleatorio del eyaculado anidado dentro del toro fue significativo para todos los modelos ajustados (p<0.05), tanto para el semen diluido como para el semen criopreservado, lo que sugiere que la variabilidad existente en la calidad del semen se puede atribuir en gran medida al reproductor e incluso a los eyaculados de un mismo animal. La adición de caseinatos en la etapa de dilución del semen bovino no produjo mayo- res efectos en la calidad seminal excepto por la reducción de la HOS para el tratamiento CS4 en comparación con C5 (p<0.05) (Cuadro 2).
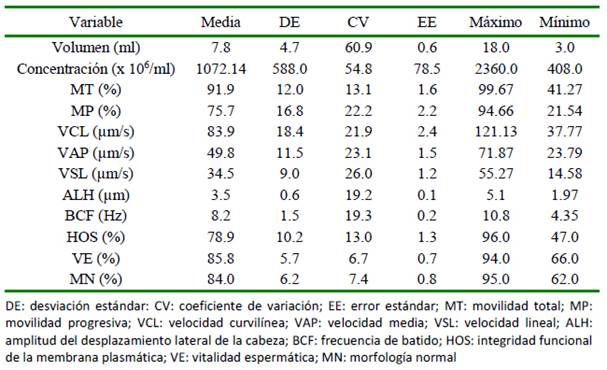
En el semen congelado y descongelado se observó un incremento en la MT y la BCF por efecto del tratamiento CS3, mientras que CS4 y CS5 produjeron una reducción en diferentes parámetros relacionados con la movilidad, la cinética y la integridad de membrana (p<0.05) (Cuadro 3). Todos los modelos ajustados para la evaluación del semen des- congelado presentaron coeficientes de determinación (R2) mayores a 0.70, por lo que se infiere que los efectos considerados en el estudio explicaron en una alta proporción la variabilidad de cada parámetro. En cuanto a la capacidad fertilizante in vitro del semen congelado y descongelado, no se encontraron diferencias entre los tratamientos (p>0.05) (Figura 1).
DISCUSION
El uso de leche entera y leche descremada en los diluyentes de congelación para proteger los espermatozoides durante el almacenamiento ha sido ampliamente descrito (Bergeron et al., 2007; Lusignan et al. 2011). La leche entera contiene lipoproteínas que podrían tener un efecto crioprotector, en tanto que la leche descremada no las tiene; sin embargo, es igualmente eficaz para proteger los espermatozoides (Plante et al., 2015). Con base a esto, se ha postulado que las proteínas de la leche, las caseínas, confieren el efecto crioprotector (Lusignan et al., 2011). Dichas proteínas forman fácilmente películas en soluciones acuosas debido a su estructura des- ordenada y a su capacidad de formar gran número de puentes de hidrógeno e interacciones y puentes hidrofóbicos (Bergeron et al., 2007; Lusignan et al., 2011).
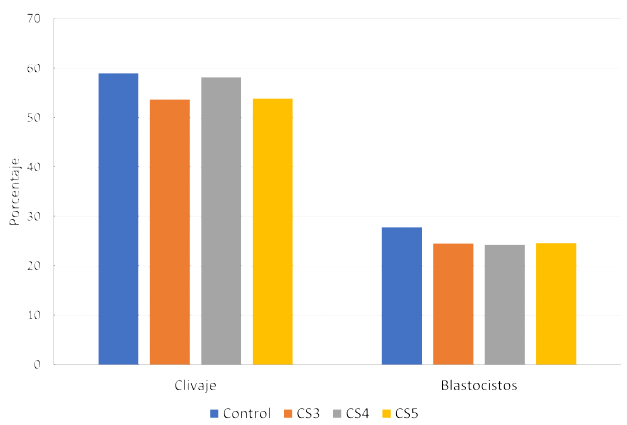
Figura 1 Capacidad fertilizante in vitro de semen bovino congelado con caseinato de sodio. CS3: caseinato de sodio al 3% p/v. CS4: caseinato de sodio al 4% p/v. CS5: caseinato de sodio al 5% p/v (p>0.05)
En el presente estudio la dilución del semen bajo los tratamientos con CS tuvo un efecto equivalente al tratamiento control, con relación con la movilidad, cinética, integridad de membrana, vitalidad y morfología; sin embargo, CS4 redujo HOS respecto al tratamiento CS5, aunque sin otros impactos significativos sobre la cinética espermática (Cuadro 2). En el semen congelado y descongelado, tanto CS4 como CS5 produjeron efectos deletéreos en múltiples parámetros, siendo llamativo que CS4 afectó tanto la movilidad como la integridad y la funcionalidad de la membrana plasmática (Cuadro 3). Esto podría estar relacionado con el efecto osmótico producido por la adición de mayores concentraciones de CS, que pudiese generar una condición de estrés osmótico y que, además, pudo verse exacerbada por el proceso de congelación, con un consecuente daño mecánico y oxidativo sobre la membrana plasmática y la alteración del metabolismo espermático (Meyers, 2005).
No obstante, el tratamiento CS3 incrementó la MT y la BCF del semen descongelado en comparación con el tratamiento control, lo cual, además de no asociarse con posibles alteraciones de origen osmótico u oxidativo, podría atribuirse al efecto benéfico de las caseínas aisladas de la leche mediante su interacción con las proteínas del plasma seminal bovino (BSP) (Bergeron et al., 2007; Plante et al., 2015). Las BSP son conocidas como perjudiciales para el propósito de la congelación seminal por su capacidad para extraer el colesterol y los fosfolípidos de la membrana plasmática (Bergeron y Manjunath 2006; Manjunath et al., 2007). La interacción de las micelas de caseína con las proteínas BSP impide dicha extracción, de manera similar a la acción protectora de las lipoproteínas de baja densidad (LDL) de la yema de huevo, manteniendo la viabilidad y la movilidad de los espermatozoides durante su almacenamiento (Bergeron et al., 2007; Lusignan et al., 2011). Por otro lado, las LDL purificadas han permitido por sí solas alcan- zar altos niveles de protección espermática durante la congelación (Moussa et al., 2002); sin embargo, estudios previos de este grupo de investigación muestran que, aunque estas tienen un efecto equivalente a la yema de huevo entera y la yema de huevo centrifugada en la conservación de la actividad mitocondrial, la integridad y la estabilidad de la membrana plasmática, no alcanzan el nivel de conservación de la MP de la yema de huevo centrifugada (Varela-Giraldo et al., 2020; Varela et al., 2020a). Por lo tanto, el mejora- miento observado de la MP por la adición de CS en un diluyente suplementado con LDL, otorga un nivel de protección espermática adicional, en un medio completamente definido con estos dos componentes purificados de origen animal.
Estudios previos han demostrado que el uso de diluyentes sin caseínas y yema de huevo bajo diferentes periodos y temperaturas de almacenamiento producen entre el 10 y 15% de pérdida de lípidos de la membrana plasmática (Bergeron et al., 2004, 2007). Esto podría deberse a la concentración de plasma seminal en el semen diluido, ya que la eliminación de lípidos de la membrana por efecto del plasma seminal o sus proteínas BSP de- pende de dicha concentración (Manjunath y Thérien, 2002; Bergeron et al., 2007). En relación con los resultados del presente estudio, la proporción de plasma seminal y la concentración de proteínas BSP podrían ser factores asociados a la variabilidad encontrada en la calidad espermática atribuible a los efectos del eyaculado y el reproductor.
En cuanto a la capacidad fertilizante in vitro, no se evidenciaron diferencias entre los tratamientos (Figura 1). Sin embargo, se pudo deducir que el semen bovino congelado en un diluyente a base de tris-glicerol-ácido cítrico y LDL, con o sin CS, conserva su capacidad posdescongelación para fertilizar oocitos y desarrollar embriones en condiciones in vitro. Se conoce que las caseínas modulan de forma positiva la inducción de la capacitación espermática, proceso esencial para la fertilización (Manjunath y Thérien, 2002). Otro estudio donde se evaluó el uso de diluyentes alternativos con ciclodextrinas y colesterol para la congelación de semen bovino reportó igualmente la conservación de la capacidad fertilizante in vitro de los espermatozoides (Anzar et al., 2019).
CONCLUSIONES
La suplementación del diluyente de con- gelación con caseinato de sodio puede mejorar la calidad posdescongelación del semen bovino, dado que en una concentración del 3% (p/v) tiene un impacto positivo sobre la movilidad y la cinética espermática.
El uso de caseinato de sodio en concentraciones superiores al 3% (p/v) en el diluyente de congelación tiene efectos deletéreos posdescongelación sobre la movilidad, la cinética y la integridad estructural y funcional de la membrana plasmática de los espermatozoides bovinos.
El uso de un diluyente de congelación de semen bovino basado en componentes de origen animal definidos como caseinato de sodio y LDL, podría constituirse en una alternativa a los diluyentes con componentes de origen animal no purificados y otros suplementos de origen vegetal.












 uBio
uBio