INTRODUCCION
Las biotecnologías reproductivas facilitan el progreso genético de los animales de producción (Cabrera y Yoong, 2009). La inseminación artificial (IA) como técnica reproductiva en los camélidos sudamericanos (CSA) aún no ha sido desarrollada completamente, en parte debido a la baja eficiencia de los procedimientos rutinarios existen- tes para el congelamiento de semen de estas especies (Gómez-Quispe et al., 2016). El éxito de esta técnica depende de las características biofísicas de los eyaculados, así como de los métodos para su procesamiento que aseguren una pérdida mínima de capacidad fecundante (Mostafa et al., 2014).
El semen es una sustancia líquida que contiene las células sexuales (espermatozoides) y las secreciones de los órganos accesorios del macho (Hafez, 2002). El mantenimiento de la capacidad fecundante de los espermatozoides debe tenerse en cuenta al implementar nuevas técnicas de criopreservación (Aller et al., 2003); sin embargo, se han tenido resultados insatisfactorios para la alpaca debido a la alta variabilidad de las características propias del semen (volumen, color, concentración, vitalidad y motilidad) (Bravo et al., 2000), la técnica de colección (Morton et al., 2006), la alta viscosidad (Rateb, 2016), la filancia y el uso de dilutores (Delgado y Quispe, 2015). Ante esto, se necesita priorizar investigaciones en alternativas biotecnológicas para el mejoramiento genético en los camélidos domésticos (Huanca et al., 2007).
Los protocolos de congelación de semen de alpaca se vienen modificando con la finalidad de mejorar la viabilidad y fertilidad espermática al descongelado (Stornelli et al., 2005). Se indica que la viscosidad y filancia del semen se debe a la presencia de mucopolisacáridos en las secreciones de las glándu- las bulbouretrales (Gonzáles, 2003). Hay estudios que utilizaron enzimas como la fibrinolisina, hialuronidasa, tripsina (Bravo et al., 2000) y colagensa (Giuliano y Casaretto, 2011), siendo efectivas para disminuir la viscosidad del semen de alpaca y llama. Así también, se han evaluado métodos mecánicos como la aspiración y expulsión del eyaculado a través de una aguja (Apaza et al., 2001) y sometido a centrifugación (Bérgamo et al., 2012), que han mostrado eficacia sobre la viscosidad sin alterar los parámetros seminales (Turín et al., 2013; Zirena, 2014).
Muchas de las alteraciones estructura- les y funcionales de los espermatozoides están relacionadas con la producción excesiva de radicales libres (RL) en el proceso de congelamiento (Tortolero et al., 2005), la cuál estaria alterando el potencial de membrana mitocondrial (PMM) que tiene relacion directa con la motilidad (Allauca et al., 2019). Ante esto, los laboratorios empezaron a utilizar antioxidantes como Tempol, catalasa (Gómez- Quispe et al., 2016; Muchotrigo, 2017), genisteína (Elsayed et al., 2019) y metil-β- ciclodextrina cargada con el colesterol (Ciprian, 2018), así como sustratos energéticos (Quispe et al., 2019), mejorando la vitalidad, funcionalidad de membrana, motilidad progresiva de espermatozoides en refrigeración y congelación/descongelación.
La preservación de semen es un reto para el desarrollo de la crianza de camélidos sudamericanos (Bravo et al., 2013), dadas las caracteristicas particulares de filancia y viscosidad del semen (Kershaw-Young et al., 2013), debiendo desarrollarse nuevas técnicas o adaptar las existentes. El presente estudio tuvo como objetivo evaluar el efecto de la colagenasa, pipeteo e incubación para disminuir la filancia del semen y su relación con la calidad espermática en alpacas para su criopreservación.
MATERIALES Y METODOS
El estudio se llevó a cabo en el Labora- torio de Biotecnología Reproductivas de la Estación Experimental Agraria Canaán, del Instituto Nacional de Innovación Agraria (INIA), ubicado en el distrito Andrés Avelino Cáceres Dorregaray, departamento de Ayacucho, Perú. La zona se encuentra a una altitud 2735 msnm. La fase experimental tuvo una duración de tres meses (abril-junio). La alimentación de los animales fue a base de alfalfa, pasto natural y heno de avena.
Se utilizaron siete alpacas macho de 4 a 7 años, los cuales fueron entrenados para la colección de semen. Las muestras de semen se colectaron utilizando una vagina artificial que simula una presión moderada del tracto reproductivo, a 38-42 °C. La vagina se colocó en un maniquí. Los eyaculados fueron colocados en forma inmediata en baño maría para evitar el shock térmico. La colección por cada animal se realizó tres veces por semana.
Se evaluaron las siguientes características macroscópicas del semen fresco:
-Color. Se realizó observando a trasluz en un tubo Falcón graduado, consideran- do los valores de transparente, semi lechoso y lechoso.
-Volumen. Se midió con el tubo Falcón graduado de 15 ml.
-pH. Se determinó mediante tiras reactivas indicadoras de pH aplicando una gota de semen.
-Filancia. Es la formación del hilo dada por la viscosidad del semen. Se midió con una regla haciendo una extensión que se toma en cuenta desde la lámina porta- objeto hasta la ruptura del hilo, con ayuda de una pipeta de 100 µl (Figura 1).
Se evaluaron las siguientes características microscópicas del semen fresco:
-Concentración. Se determinó utilizando la cámara de Neubauer. Para ello se diluyó el semen con agua bidestilada en relación de 0.1:0.9 ml en un tubo eppendorf. Luego se colocó 5 µl de la muestra en una cámara de Neubauer. Para el contaje de los espermatozoides (mill/ml) se utilizó un microscopio de con- traste de fase con objetivo de 40X.
-Motilidad. Se colocó 10 µl de semen en una lámina portaobjeto atemperada y se observó en un microscopio a 40X. Para determinar la motilidad, se consideró a todos los espermatozoides que presentaron algún tipo de movimiento (lineal o rotatorio). El resultado fue expresado en porcentaje.
-Vitalidad. Se coloca 10 µl de semen en una lámina portaobjetos seguido de 10 µl de eosina-nigrosina. Se homogeniza y se hace un frotis. Se cuentan 200 espermatozoides a 100X. Se consideraron como muertos a los espermatozoides coloreados y como vivos a los no coloreados. El resultado fue expresado en porcentaje.
La muestra de semen se distribuyó en volúmenes iguales en tres tubos eppendorf y se diluyeron con el dilutor comercial AndroMed® (Minitube) en proporción 1:1. Las muestras fueron sometidas a tratamientos químicos (T1: colagenasa), mecánico (T2: pipeteo) o físico (T3: incubación). El momento de la dilución fue considerado como tiempo 0. Para T1, el dilutor se preparó con colagenasa al 5%, para T2, el semen fue pipeteado 10 veces, y para T3, el semen fue incubado a 37 °C en una placa térmica durante 10 minutos. En los tres casos, se evaluó la filancia, motilidad y vitalidad espermática a los 20, 40, 60 y 120 minutos de la dilución, manteniendo el semen en refrigeración (+4 °C), siguiendo la metodología utilizada para el semen fresco
Para determinar los parámetros del semen fresco se utilizaron las medidas (estadígrafos) de tendencia central (promedio) y de dispersión (desviación estándar, va- lores mínimo y máximo). Se utilizó el análisis de varianza para evaluar el efecto de los tratamientos (químico, mecánico y físico) sobre la filancia de semen y la prueba de Duncan para determinar diferencias entre medias. Para el análisis estadístico se utilizó el pro- grama SAS v. 9.2.
El manejo de los animales se llevó acabo de acuerdo con el código de ética para experimentos con animales (http:// ec.europa.eu/environment/chemicals/ lab_animals/legislation_en.htm).
RESULTADOS Y DISCUSION
Los resultados de la evaluación macro y microscópica del semen fresco se muestran en el Cuadro 1. La motilidad fue regular, no llegando a alcanzar al porcentaje aceptable (70-80%) para ser sometido a la criopreservación, posiblemente debido a factores geográficos, método de colección y factores propios de la especie.
Cuadro 1 Características macroscópicas y microscópicas del semen fresco de alpacas, obtenidas por vagina artificial
Filancia
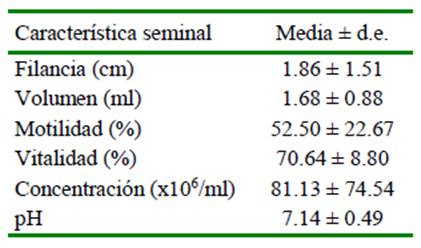
La filancia disminuyó con el transcurso del tiempo pos-dilución (Figura 1; p<0.05), pero no fue afectado por los tratamientos realizados (Cuadro 2).
Giuliano y Casaretto (2011) y Apaza-Callisaya et al. (2020) mencionan que la formación del hilo no debería utilizarse para evaluar la viscosidad, puesto que son características distintas; sin embargo, Bravo et al. (2000a) y Villanueva et al. (2018) determinaron la viscosidad seminal por medio de la filancia. Por otro lado, Mardonez y Delgado (2012) reportaron que la bromelina elimina la filancia de semen en llama, en tanto que Kershaw-Young et al. (2013) mencionan que la papaína reduce eficazmente la viscosidad seminal; no obstante, Huanca y Adams (2006) lo contradicen, puesto que tiene efectos per- judiciales sobre la integridad de los espermatozoides.
Con relación al tratamiento térmico, Bérgamo et al. (2012) evaluaron el pasaje de semen de llamas por aguja de 0.5 mm de- mostrando eficacia sobre la disminución de la filancia, en tanto que Zirena (2014) redujo la viscosidad sin alterar los parámetros seminales cuando sometió a 10 pasajes por una aguja N.°18 con jeringa de 5 ml y luego centrifugado a 802 g por 10 min, contradiciendo los resultados de Morton et al. (2008, 2012).
Así mismo, Giuliano y Casaretto (2011) experimentaron que el semen incubado a 37 ºC por 4 y 8 min no disminuye la filancia, mientras que Garnica et al. (1993) observa- ron que se elimina la vicosidad si el semen es incubado en baño maría a 37 °C por 24 h. Por otra parte, el semen de camello sometido a ondas ultrasónicas disminuyó la filancia y la viscosidad (Rateb, 2016).
Motilidad Espermática
No se observaron diferencias significativas entre tratamientos sobre la motilidad espermática (Cuadro 3). Asimismo, se observó una disminución de la motilidad luego de dilución (p<0.05) en los tres grupos; sin embargo, posterior a ello solo hubo una ligera diminución durante el tiempo pos-dilución del estudio (Figura 3).
Cuadro 2 Efecto del tratamiento1 del semen de alpaca sobre la filancia (cm) según el tiempo pos-dilución
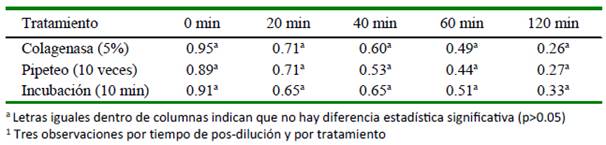
Cuadro 3 Efecto del tratamiento1 del semen de alpaca sobre la motilidad (%) según el tiempo pos-dilución
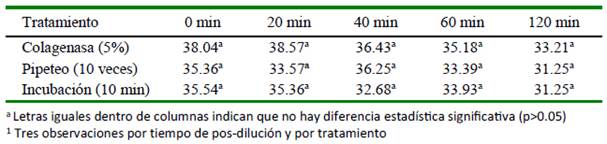
Cuadro 4 Efecto del tratamiento1 del semen de alpaca sobre la vitalidad espermática (%) según el tiempo pos-dilución
Se reporta que el tratamiento con colagenasa para disminuir la filancia afecta la motilidad espermática y la integridad acrosomal (Bravo et al., 2000a; Rateb, 2016); no obstante, Giuliano y Casaretto (2011) observaron que mejoró la movilidad progresiva además de conservar la integridad funcional de la membrana plasmática de los espermatozoides. En tanto, Fumuso et al. (2015) mencionan que los tratamientos enzimáticos podrían modificar el patrón de movilidad, interfiriendo la interacción ovocito-espermatozoi- de comprometiendo la unión de los gametos.
Saltos (2007) y Zirena (2014) mencionan que el pasaje del semen por una aguja y la centrifugación con fines de reducir la viscosidad seminal afectan negativamente la motilidad espermática; no obstante, Gómez-Quispe et al. (2019) centrifugando el semen a 700 g por 7 min obtuvieron una alta tasa de espermatozoides móviles con adecuada integridad funcional de la membrana plasmática. Así mismo, Morton et al. (2008, 2012) reportaron que el pipeteo suave no compromete la motilidad espermática. Por otro lado, Giuliano y Casaretto (2011) reportan que la incubación del semen durante 8 min mejoró la motilidad progresiva del espermatozoide, y Rateb (2016) utilizando el ultrasonido como trata- miento observó que hubo mayor motilidad espermática.
Vitalidad Espermática
No se observaron diferencias significativas entre tratamientos sobre la vitalidad espermática (Cuadro 4). Asimismo, solo se observó una ligera variabilidad en la vitalidad espermática entre el semen fresco y el semen diluido durante el tiempo del estudio (Figura 4).
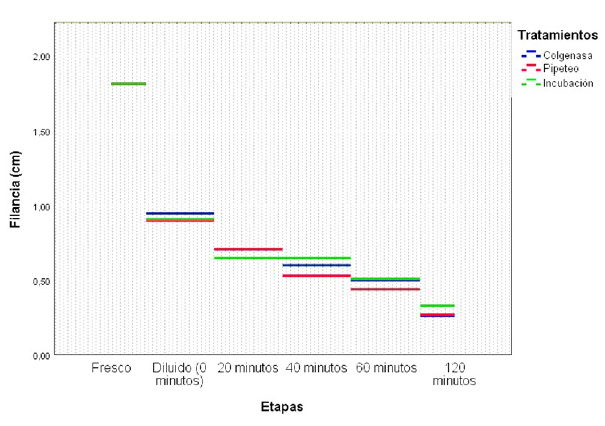
Figura 2 Comportamiento de la filancia seminal de alpacas pos-dilución del semen según los tratamientos efectuados en el semen
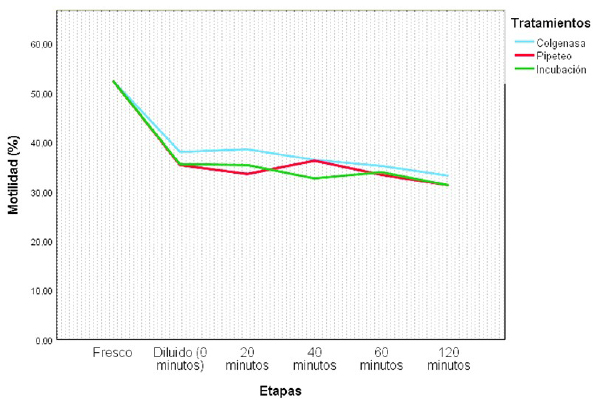
Figura 3 Comportamiento de la motilidad espermatica de alpacas pos-dilución del semen según los tratamientos efectuados en el semen en cada tiempo (etapa) de los tratamientos
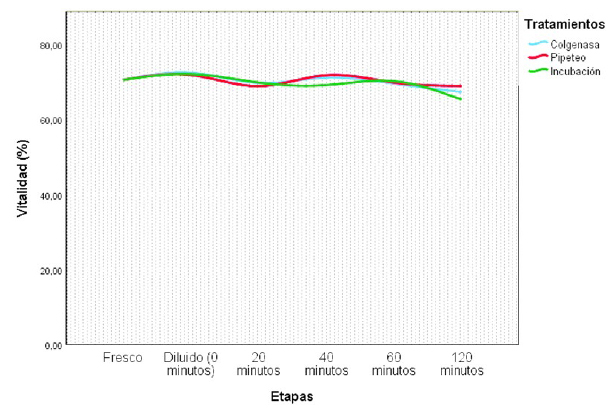
Figura 4 Comportamiento de la vitaliadad espermatica en alpacas en cada tiempo (etapa) según los tratamientos
En estudios similares, Bravo et al. (2000a) y Morton et al. (2012) utilizando colagenasa y tripsina observaron ligera disminución del porcentaje de espermatozoides vivos. Por otro lado, Rateb (2016) observó que el semen tratado con ultrasonido registró mayor porcentaje de viabilidad. No obstante, investigaciones recientes concluyen que la perdida de motilidad progresiva no solo sea debido a la acción mecánica, sino a efectos más complejos (Giuliano et al., 2010; Giuliano, 2012; Carretero et al., 2015, 2017).












 uBio
uBio 


