INTRODUCCION
La producción ovina en el Perú representa, en gran medida, un soporte económico trascendente para un gran sector de la población rural (Moya y Torres, 2008); especialmente aquellas que habitan en zonas don- de el desarrollo de la agricultura presenta limitantes, tanto por condiciones climáticas como altitudinales. La presencia de parásitos gastrointestinales en producciones ovinas suele causar graves pérdidas económicas a los productores cuando se presentan en explotaciones donde algunas prácticas de manejo favorecen la infección por nemátodos gastrointestinales (Lara, 2003), lo que representa una seria limitación para estos sistemas productivos (Vásquez et al., 2001), por una disminución de la productividad. A esto se añade la resistencia a los antiparasitarios convencionalmente utilizados para combatir- las, tales como los benzimidazoles (albendazol), imidazotiazoles (levamisol) o endectocidas (ivermectinas), que es cada vez más intensa y constituye un serio problema por resolver (Van Wyk, 2001; Lara, 2003).
Las parasitosis en general pueden alterar el bienestar animal independientemente del sistema productivo (Herrera et al., 2013), teniendo efectos negativos directos (ganancia de peso, desarrollo corporal, comporta- miento reproductivo) e indirectos (subutilización del recurso forrajero y la predisposición a enfermedades) (Soca et al., 2005), además de los costos implicados en los tratamientos del animal, reduciendo la rentabilidad (Márquez, 2003). Esta problemática es importante sobre todo en la crianza de ovinos en la sierra central del país, donde la prevalencia general de parasitismo gastrointestinal por nematodos puede alcanzar valores altos (Puicón et al., 2018).
En este contexto, conocer el nivel de asociación entre los cuadros de nematodiasis gastrointestinal del ganado ovino con la modificación patológica de ciertos parámetros fisiológicos como pérdida de peso, cuadros de anemia y disminución de los valores de hematocrito, resultará importante para entender la dinámica de estas parasitosis con el fin de implementar medidas de control adecua- das. El objetivo del presente estudio, por lo tanto, fue determinar el nivel de asociación entre los cuadros de nematodosis gastrointestinal y la variación patológica de parámetros fisiológicos en ovinos de raza Junín.
MATERIALES Y METODOS
Lugar del Estudio
El estudio se llevó a cabo en la Unidad de Producción Pachacayo de la SAIS Túpac Amaru Ltda. Nº 1, ubicada en el distrito de Canchayllo, provincia de Jauja, Región Junín, Perú, entre los 3600 y 4700 msnm. La crianza del ovino Junín es exclusivamente a campo abierto, a base de pastos nativos, sin recurrir a la estabulación ni a la alimentación su- plementaria.
Las pruebas diagnósticas de laboratorio se realizaron en los laboratorios de Sanidad Animal y Microbiología de la Facultad de Zootecnia de la Universidad Nacional del Centro del Perú, Huancayo, Región Junín. El trabajo se realizó entre marzo y diciembre de 2018, con dos muestreos de campo en los meses de mayo y octubre.
Población y Muestra
La población objetivo fue el total de carnerillos y borreguillas (animales destetados), de 4 a 6 meses de edad del lote Stud de la raza Junín. Se trabajó con la totalidad de los animales, considerado como conjunto completo (CEIBAL, 2007). Así, en la primera colección de muestras (mayo) se trabajó con 109 carnerillos y 98 borreguillas y en la segunda (octubre) con 89 carnerillos y 85 borreguillas.
Procedimiento
Los animales, identificados con aretes numerados, fueron pesados en una balanza tipo reloj: Se tomaron muestras de heces di- rectamente del recto y de sangre de la vena cefálica en tubos vacutainer con EDTA. Además, se registró el nivel de anemia mediante el método FAMACHA®, desarrollado en Sudáfrica y que se basa en el tratamiento selectivo de los animales en función de la coloración de la mucosa de la conjuntiva ocular relacionada con los diferentes grados de anemia, para el control de parásitos hematófagos, especialmente Haemonchus spp (van Wyk y Bath, 2002). Las muestras se llevaron al laboratorio en cajas térmicas para su procesamiento y análisis.
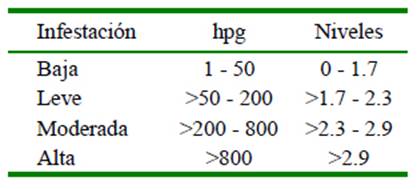
El contaje de huevos de los parásitos gastrointestinales (HPG) se realizó por el método McMaster (Hansen y Perry, 1994), con el fin de categorizar los niveles de infestación por animal (Morales y Pino, 2009) de acuerdo con lo indicado en el Cuadro 1. La identificación de las larvas se hizo con el método de Corticelli y Lai modificado (Luck- Montero et al., 2018), realizando pooles de muestras de heces para cada nivel de parasitismo, sexo y época. La determinación del hematocrito se hizo mediante la técnica de microhematocrito.
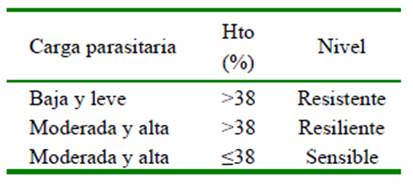
Los animales fueron clasificados por su condición de resistencia al parasitismo según los resultados de la coproscopía cuantitativa (carga parasitaria) y el valor del hematocrito (Morales et al., 2011) (Cuadro 2). No se consideró la lectura de la tarjeta FAMACHA como criterio en esta clasificación, de acuerdo con la propuesta de Morales et al. (2011), debido a que este criterio solo es válido para parásitos gastrointestinales hematófagos como los del género Haemonchus.
Cuadro 1 Niveles de parasitismo gastrointestinal según el número de huevos por gramo de heces (hpg) en ovinos
Análisis Estadistico
Se evaluó la normalidad de datos, donde el peso vivo y el hematocrito fueron variables normales, mientras que el hpg fue transformado en base logarítmica decimal para ser normalizada. Para el análisis de los datos se utilizó la correlación de Pearson entre el peso vivo, hematocrito y el hpg en base logarítmica decimal. Para evaluar diferencias entre sexos y estaciones con respecto al peso vivo, hpg en base logarítmica y porcentaje de hematocrito se hizo uso del modelo lineal de efectos fijos. Asimismo, la asociación entre el nivel de parasitismo y resistencia con el sexo y la estación se determinó con la prueba de Chi cuadrado de dependencias, utilizando la prueba de Mantel-Haenszel para probar la asociación condicional de las dos variables binarias (sexo y época) en presencia de una tercera variable categórica (nivel de parasitismo). Todos los análisis se hicieron con el paquete R v. 3.6.1.
RESULTADOS Y DISCUSION
Época del Año y Sexo
No se encontró diferencia significativa entre el peso vivo con las épocas de muestreo (sequía y lluvias) (Cuadro 3). No obstante, el peso promedio de los machos fue significativamente mayor que el de las hembras (p<0.05), lo cual concuerda con Castellaro et al. (2015) y Bianchi (2007), quienes señalan que la diferencia entre sexos se incrementa con la edad y las mejoras nutricionales.
El menor peso promedio de las borreguillas en la estación de inicio de lluvias (octubre) con relación al inicio de la época de sequía (mayo) se explica por el hecho de que estos lotes tuvieron diferentes zonas de pastoreo por consideraciones de manejo de la empresa, lo que se ve reflejado en un mayor rango de los pesos.
Los valores de hematocrito fueros significativamente mayores en la época de sequía (41.0 ± 0.17) que en la época de lluvias (39.7 ± 0.18; p<0.05), mientras que fue similar entre sexos. Los valores de hematocrito, sin embargo, se mantuvieron dentro del rango normal del ovino (30-60%; Andina Premier, 2015). Por otro lado, si se considera el efecto de la altitud, los valores del presente estudio fueron más altos que otros reportados a menor altitud (Morales et al., 2011). En un estudio llevado a cabo en Ayacucho en condiciones de altura, Ayala (2014) obtuvo valores de 43.9 y 36.2% de hematocrito para machos y hembras, respectivamente, con valores más alto en ovinos de 14- 16 meses en comparación con animales de 8-10 meses (38.8%).
Los coeficientes de correlación de Pearson fueron bajos para peso vivo y hematocrito (0.031) y para el peso vivo con el hpg en base logarítmica decimal (0.087). La única correlación significativa (p<0.05) se dio entre el hematocrito y el hpg en base logarítmica decimal (-0.12), lo que indica que a mayor hpg tiende a disminuir el valor del hematocrito en los ovinos del estudio.
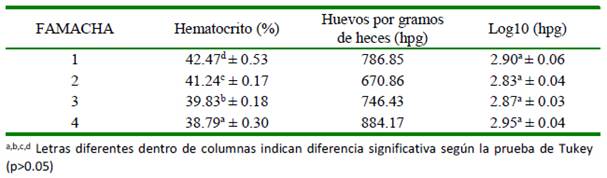
La relación entre los niveles FAMACHA y los valores del hematocrito mostraron una significativa relación (Cuadro 4), mientras que los valores transformados de hpg no mostraron diferencias significativas entre los niveles de FAMACHA (Cuadro 4). Esto permite asumir que el uso de FAMACHA no resulta significativo para establecer un nivel de parasitismo (hpg), pero podría ser de utilidad para asociarlo con el estado de anemia (valores de hematocrito) en las condiciones del estudio.
Cuadro 3 Promedios y rangos de peso vivo, hematocrito (Hto) y número de huevos por gramo de heces (hpg) en borreguillas y carnerillos de la SAIS Túpac Amaru durante las épocas de sequía y de lluvias (2018)

Cuadro 4 Asociación de valores FAMACHA, hematocrito y carga parasitaria en ovinos de la SAIS Túpac Amaru (2018)
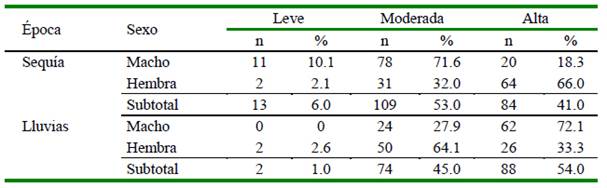
Cuadro 5. Asociación del nivel de parasitismo gastrointestinal con el sexo y época del año en ovinos de la SAIS Túpac Amaru (2018)
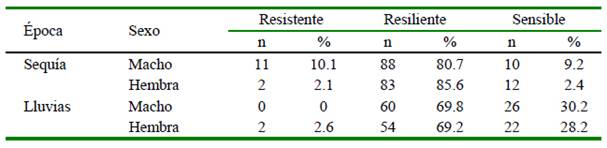
Cuadro 6 Asociación del nivel de resistencia al parasitismo gastrointestinal con el sexo y época del año en ovinos de la SAIS Túpac Amaru (2018)
No se encontraron diferencias significativas entre épocas del año en los valores transformados del hpg para carnerillos y borreguillas (2.84 ± 0.02 en el estiaje; 2.91 ± 0.03 en lluvias). Por otro lado, el valor del hpg fue significativamente menor en machos (2.82 ± 0.02) que en hembras (2.93 ± 0.03) (p<0.05).
Parasitismo Gastrointestinal
No se encontró asociación significativa entre los niveles de parasitismo gastroin-testinal con el sexo; sin embargo, hubo asociación significativa y positiva con la época del año al considerar el total de animales (V. Cramer’s = 0.17) (Cuadro 5).
Todos los animales evaluados estuvieron infectados con parásitos gastrointestinales, ya sea de manera leve, moderada o alta; sin embargo, el estadístico Mantel-Haenzel indica que no hubo asociación significativa entre los niveles de parasitismo con época del año y sexo.
Al evaluar la totalidad de animales, se encontró diferencias significativas (p<0.05) entre los grupos de niveles de parasitismo con temporada, para los niveles de parasitismo leve y moderado, pero no se encontraron diferencias en el nivel de parasitismo alto. La cantidad de animales con parasitismo leve disminuye al pasar de la época de sequía a la época de lluvias, mientras que los animales con parasitismo alto, se incrementa ligeramente (Cuadro 5). Según Piscoya (2017), en la sierra del Perú, donde el frio, la lluvia y el calor son muy intensos, en la época de lluvia existe una mayor prevalencia de parásitos intestinales, ya que las lluvias generan un ambiente adecuado para su desarrollo.
Resistencia al Parasitismo Gastrointestinal
Los animales fueron clasificados por su condición de resistencia al parasitismo según los resultados de la coproscopía cuantitativa (carga parasitaria) y el valor del hematocrito. En época de sequía se presentaron más casos de animales resistentes al parasitismo que en época de lluvias, al igual que el número de animales resilientes; sin embargo, hubo un incremento de animales sensibles en la estación de lluvias. La cantidad de hembras resilientes disminuyó al pasar de la época de sequía a la época de lluviosa (Cuadro 6); asimismo se encontraron diferencias significativas entre la proporción de animales sensibles con los animales resistentes y resilientes (p<0.05).
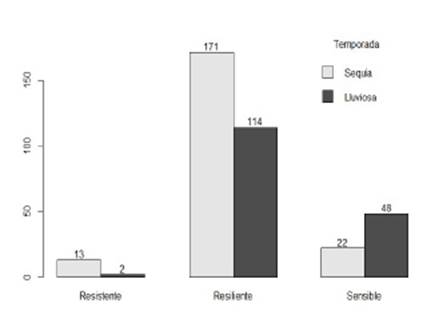
Figura 1 Asociación entre el nivel de resistencia al parasitismo gastrointestinal y la época del año en ovinos de la SAIS Túpac Amaru (2018)
Lope (2016) reportó en 142 ovinos en Tampobata, Perú, que el 40.5, 39.4 y 19.9% resultaron sensibles, resistentes y resilientes, respectivamente, para la estación de lluvias, mientras que Puicón et al. (2018), evaluando ganado ovino en dos cooperativas de la sierra central, encuentra una gran proporción de animales intermedios (resilientes), seguido de animales sensibles y una pequeña proporción de resistentes, indicando además, que con la pequeña proporción de animales resistentes se podría establecer una población genéticamente mejorada resistente al parasitismo gastrointestinal.
Considerando el total de animales (carnerillos y borreguillas), el grupo de animales sensibles, a diferencia del grupo de animales resistentes y resilientes, tiende a aumentar considerablemente al pasar de la época de sequía a la época de lluvias (Figura 1).
El aumento de animales sensibles al iniciarse el periodo de lluvias puede estar ocasionado por el aumento de la oviposición de los parásitos en estos animales lo que se puede interpretar como consecuencia de la prosecución del desarrollo de las larvas que habrían permanecido hipobióticas durante la época de sequía. Esto se puede considerar como la adaptación de los parásitos para sobrevivir dentro de los animales durante las épocas en que las bajas temperaturas no permiten el desarrollo de las larvas infectantes en la materia fecal (Sievers et al., 2002).
Cultivo de Larvas
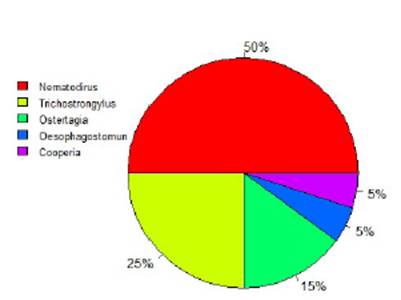
Hubo una mayor presencia de Nemato- dirus spp (50%) sobre otras especies de nematodos gastrointestinales (Trichostron- gylus spp, 25%, Ostertagia spp, 15% y otros), según se muestra en la Figura 2. Los resultados obtenidos son compatibles con lo reportado. En este sentido, Lupaca (2017) en su trabajo en ovinos en el sur del país encon- tró mayormente Haemonchus spp (23.1%), Ostertagia spp (22.1%), Nematodirus spp (15.4%) y Trichostrongylus spp (14.4%) Por otro lado, Rojas (2004) cita entre los princi- pales géneros parasitarios para la sierra del Perú a Strongyloides, Toxocara, Trichuris, Bunostomun, Capillaria, Trichostrongylus, Nematodirus, Lamanema, Ostertagia, Cooperia, Haemonchus y Chabertia.
La mayor presencia de Nematodirus spp puede justificarse por la mayor viabilidad de los huevos de esta especie sobre los de tipo estrongílido, ya que durante la época de sequía presentan una gran resistencia frente a la sequedad y bajas de temperatura características de la región altoandina (Leguía, 1991; Leguía y Casas, 1999).
CONCLUSIONES
Todos los ovinos estaban con algún nivel de parasitismo gastrointestinal, especial- mente durante la época de sequía.
Se encontró interacción significativa entre el sexo y la época sobre el peso de los animales (p<0.01).
Los valores de hematocrito fueron mayores en época seca.
Se encontró correlación significativa (p<0.05) entre el hematocrito y el número de huevos por gramo de heces en base logarítmica decimal (-0.12).
La mayor frecuencia de nematodos fue de Nematodirus (50%), seguido de Trichostrongylus (25%), y en menor proporción Ostertagia (15%), y Oesophagostomun y Cooperia (5% cada uno).












 uBio
uBio