INTRODUCCION
Las plantas de género Crotalaria pertenecen a la familia Fabaceae que comprende cerca de 600 especies, mayormente distribuidas en los trópicos y subtrópicos (Polhill, 1981; Chong et al., 2009). En Colombia se han reportado 19 especies, en su mayoría situadas en zonas cálidas y templadas por de- bajo de los 3000 msnm (Bernal, 1986). Se le utiliza mayormente en la agricultura, como abono verde y como cubierta en la preparación del suelo por su alta capacidad de fijación del nitrógeno (Mosjidis y Wang 2011). La planta es consumida accidentalmente al quedar incluida en el forraje ofrecido a los animales (Souza et al., 1997).
Plantas del género Crotalaria contienen metabolitos secundarios de naturaleza nitrogenada denominados alcaloides pirrolizidinicos (AP), tanto en hojas y florescencias, como en las semillas contenidas en vainas (Bernal, 1986), siendo entre los más relevantes en C. pallida la monocrotalina (Mn) y la usaramina (Um) (Copple et al., 2004; Edgar et al., 2011). Es- tos compuestos son metabolizados por enzimas hepáticas tipo citocromo P-450 (CP450) originando agentes alquilantes electrofílicos tipo esteres pirrólicos (EP) (Mingatto et al., 2007). A pesar de tener una vida media de escasos segundos en un medio acuoso, estos pirroles son un poderoso agente alquilante que se une al ADN, RNA y las proteínas (Niwa et al., 1991; Wagner et al., 1993; Yan y Huxtable, 1995), con la subsiguiente actividad citotóxica, antimitótica y megalocítica característica de sus procesos tóxicos (Hincks et al., 1991).
Las especies tóxicas de Crotalaria poseen un rendimiento de AP entre 0.2 y 3% (Peterson y Culvenor, 1983). En Colombia han identificado AP en C. pallida en 0.18% de su materia seca (MS) y dentro de estos, la Um en una concentración de 0.16% (Díaz et al., 2014). Anjos et al. (2010) demostró que las ovejas son susceptibles a la intoxicación aguda por Mn y que la intoxicación ocurre después de una sola dosis oral (205.2 mg/kg); sin embargo, las ovejas desarrollan una fuerte resistencia a la Mn después de la ingestión diaria de dosis no tóxicas (<136.8 mg/kg).
Según Nobre et al. (2005, las ovejas son más resistentes a la intoxicación por AP que el ganado vacuno y equino. En Brasil se han descrito cuadros de intoxicación aguda de forma experimental en ovejas con dosis entre 2.5 y 40 g/kg/d de hojas verdes de C. pallida (Borelli et al., 2016), además de un brote de intoxicación en Rio Grande do Norte (Riet-Correa et al., 2011). No obstante, se dispone de escasos estudios toxicológicos clínicos en rumiantes sobre la oferta ambiental asociada a plantas en Colombia, toda vez que la mayoría de los estudios se centran en la determinación de grupos de metabolitos se- cundarios de plantas que se asocian con eventos tóxicos en animales (Díaz, 2010, 2011, 2015; Lozano et al., 2010; Lozano y Díaz, 2013). Asimismo, son importantes los estudios sobre bioacumulación de xenobióticos en tejidos animales que son fuente de alimentos a los humanos (Díaz et al., 2014; Dusemund et al., 2018). Es así, que el objetivo de esta investigación fue determinar la posibilidad de toxicidad subcrónica en ovejas expuestas al consumo diario de MS de C. pallida colectada en los Llanos Orientales colombianos.
MATERIALES Y METODOS
Colecta y Preparado del Material Vegetal
La planta C. pallida (Figura 1) se colectó en el departamento del Meta (Colombia), zona de piedemonte llanero del municipio de Villavicencio. La zona tiene una altitud de 465 msnm, temperatura promedio de 27 oC y precipitación de 1900-2300 mm/año. La colecta se efectuó entre los meses de febrero a marzo, época de sequía en la zona.
Una muestra de hojas, tallo, florescencia y vainas se envió al Herbario Nacional de Colombia para la clasificación taxonómica, reportando la especie Crotalaria pallida Aiton. Las partes aéreas de la planta (hojas y pequeños tallos) fueron extraídas, limpia- das y pesadas (materia verde, MV), para luego ser sometidas en un horno de secado de aire recirculante a 60 °C durante 72 h. El rendimiento de MS fue de 55.28%. La MS fue molida hasta obtener un cernido homogéneo, guardándose a temperatura ambiente en frascos sellados.
Animales y Modelo de Toxicidad Subcrónica
Se utilizaron seis carneros enteros, raza criollo colombianos, provenientes del sistema de producción ovino de la Granja Barcelona (Universidad de los Llanos, Colombia). Los animales tenían entre 6 y 12 meses, peso pro- medio 27 kg. Se les realizó exámenes clínicos diarios durante 8 días antes del inicio de la exposición a C. pallida; además de pruebas paraclínicas (hemograma, coproparasitológicos y bioquímica sérica [aspartato aminotransferasa -AST-, gamma glutamil transpeptidasa -GGT-, nitrógeno ureico en sangre -BUN- y creatinina]) para confirmar su adecuado estado de salud para este estudio.
Se colocaron dos ovinos por corral den- tro de la zona de experimentación del Centro Clínico Veterinario de la Universidad de los Llanos, donde fueron alimentados con heno de Dichantium aristatum y agua potable ad libitum, y 200 g/animal/día de ración balanceada comercial. Luego de ocho días de adaptación, fueron divididos al azar en dos grupos: Control (G1) con dos ovinos y Grupo Experimental (G2) con cuatro ovinos. A los carneros del G2 se les incluyó en su dieta diaria 4.79% peso/peso de MV C. pallida (8 g MS C. pallida/kg), lo que corresponde al 1% de inclusión en la dieta (dosis baja) de acuerdo con Barbosa-Ferreira et al. (2011) durante los 28 días que duró el modelo subcrónico de intoxicación dietaria (Madingou et al., 2016). En el estudio se garantizó el bienestar de los animales experimentales cumpliendo con la normatividad nacional, Ley 84 de 1989 «Estatuto Nacional de Protección de los Animales» y las buenas prácticas de experimentación animal asociadas a «Ethical Guidelines for the Use of Animals in Research» (NENT, 2018). Además, se contó con el aval del Centro Clínico Veterinario de la Universidad de los Llanos para el uso de los animales experimentales.
Muestras y Procedimientos
Todos los animales fueron evaluados clínicamente cada 24 h (10:00 h) desde el día de la inclusión de C. pallida en la dieta (día 0, T0). Se les pesó y se colectaron muestras de sangre por punción yugular, en tubo con y sin EDTA para hemoleucograma, perfil hepático (AST y GGT) y perfil renal (BUN y creatinina) los días 0 (T0), 14 (T1) y 28 (T2) pos-exposición (PE) a C. pallida. Los carneros fueron sacrificados el día 28 PE siguiendo el protocolo de Woods (2017) para proceder con la necropsia, examen anatomopatológico (Johnson y Libal, 1986). Se tomaron muestras según metodología descrita por Luna (1968) de órganos del sistema nervioso central, tracto gastrointestinal y glándulas anexas, sistema cardiovascular, sistema respiratorio y sistema reproductivo.
Análisis Estadístico
Se aplicó la prueba de homocedasticidad de Barttle a los datos obtenidos sobre el examen clínico y las pruebas paraclínicas. Los resultados de los grupos G1 y G2 fueron comparados mediante la prueba de Chi-cuadrado, asumiendo un nivel de significancia estadística de p<0.05. Los hallazgos anatomo- patológicos e histopatológicos se describieron según sus lesiones y análisis porcentual. Se utilizó el programa Open Stat 4® v. 9.0.
RESULTADOS
Evaluación Clínica
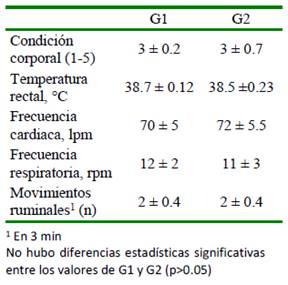
En la evaluación diaria no se observa- ron cambios significativos (p>0.05) en los signos clínicos entre los grupos G1 y G2 (Cuadro 1). Todos los animales presentaron durante los 28 días del estudio un estado mental de alerta y de docilidad, así como membra-importantes entre los animales de los grupos G1 y G2, siendo la ubicación, tamaño, peso, forma, bordes, superficie externa (lisa, brillante, trasparente), consistencia al corte y demás características de acuerdo con lo esperado para la especie.
El estudio histopatológico de los anima- les del grupo G1 no reportó ninguna alteración evidente en los órganos colectados, mientras que en todos los animales del grupo G2 se observaron cambios histopatológicos en hígado, pulmón y riñón. En el parénquima hepático se encontraron hepatocitos hincha- dos o vacuolados, cambio vacuolar severo de presentación difusa en zona media, con una leve congestión centrolobulillar, en el parénquima pulmonar engrosamiento moderado de los septos alveolares de forma generalizada (Figura 2) y proteinuria moderada en el riñón.
DISCUSION
Se reporta el impacto que tiene el consumo de plantas tóxicas por animales de abasto, especialmente en casos de toxicosis aguda o crónica, donde se presenta mortalidad, disminución de los parámetros productivos y gastos ocasionados por tratamientos preventivos y/o curativos (Grosso et al., 2011). La detección de plantas tóxicas en las dietas de animales es un desafío, ya que la toxicosis no se detecta cuando es subclínica (Scasta et al., 2020).
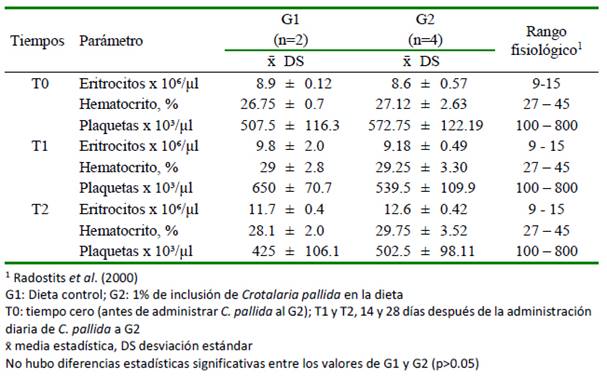
Cuadro 2. Valores de la serie roja del hemograma en carneros sometidos a una dieta experimental contenido Crotalaria pallida durante 28 días
Los animales, en muchos casos, son selectivos y evitan la ingesta de plantas tóxicas o tienen mecanismos fisiológicos que pue- den contrarrestar los efectos tóxicos (Iason y Villalva, 2006): sin embargo, a pesar de ser considerado un proceso de aprendizaje de- nominado aversión condicionada (Provenza et al., 1992), los casos de intoxicación por plantas son frecuentes, causando pérdidas económicas a los productores (Torres, 1983; Nielsen y James, 1992; Soares et al., 2018).
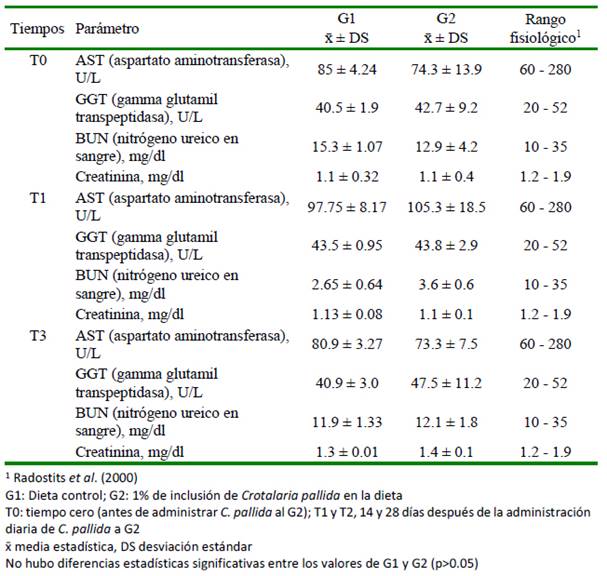
La identificación de signos clínicos aso- ciados a intoxicación por plantas puede ser una herramienta bien aplicada en el campo productivo y determinar la tolerancia de los animales permite construir planes preventivos que limiten la exposición. En este sentido, la valoración física y fisiológica de los animales de este estudio sometidos a una dieta de 8 g MS/kg PV de C. pallida por 28 días no mostró alteración de parámetros clínicos ni en los parámetros paraclínicos respecto a los valores normales para la especie reporta- dos por Radostis et al. (2000) (cuadros 1-4).
Borelli et al. (2016) describe que en la exposición a partir de 2.5 y hasta de 40 g MV/kg PV de hojas de C. pallida en ovinos ocasiona la presencia de signos clínicos (diarrea, inquietud, agitación, anorexia, respiración abdominal, taquipnea y taquicardia) y muerte entre 12-21 horas. Asimismo, Laws (1968) indicó que la dosis letal para ovejas puede estar entre 11.4 y 13.6 g MV de hojas/ kg PV, en tanto que Tokarnia y Döbereiner (1982) reportaron dosis tóxicas de C. anagyroides para rumiantes de 25 g/kg como dosis única.
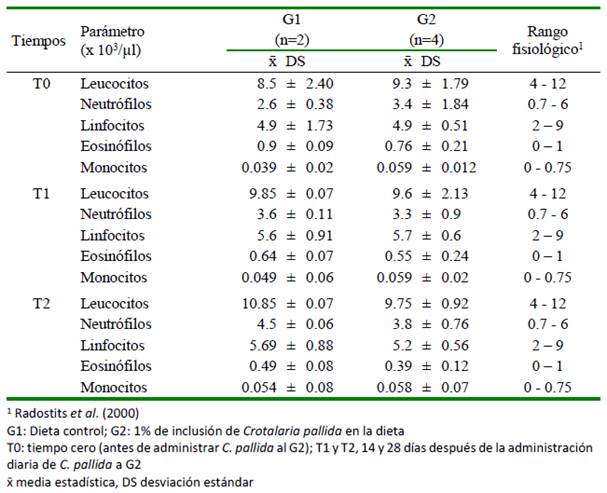
Cuadro 3 Valores de la serie blanca del hemograma en carneros sometidos a una dieta experimental contenido Crotalaria pallida durante 28 días
En contraste con el presente estudio, Boghossian et al. (2007) encontraron signos clínicos como pulso venoso positivo en bovinos intoxicados con C. pallida y disminución de los movimientos ruminales 59 días después de haber iniciado el experimento. Por otro lado, en estudios con otras especies de Crotalaria, por ejemplo, con C. retusa, se reportan signos neurológicos como incoordinación, depresión, anorexia y recumbencia en ovejas a las 48 h tras una única dosis diaria de 10 g/kg (Nobre et al., 2005), fotosensibilización (Nobre et al., 2004a); del mismo modo, con C. anagyroides se reporta excitación o depresión y muerte (Tokarnia y Döbereiner, 1983).
Los resultados del hemograma y la bioquímica sanguínea del presente estudio (cuadros 2-4) estuvieron dentro de los rangos esperados para la especie (Radostits et al., 2000). Queiroz (2013), por otro lado, tampoco encontró cambios significativos en el hemograma asociados a la intoxicación con C. incana en bovinos. Asimismo, Laws (1968) tampoco reportó alteraciones en la bioquímica sanguínea asociadas a la intoxicación con C. pallida en ovejas, ni Pessoa et al. (2013) en la actividad de AST ni GGT con C. juncea en burros. Por el contrario, Nobre et al. (2004a) reportan elevación de GGT en bovinos intoxicados naturalmente por C. retusa.
Los hallazgos histopatológicos reporta- dos en este estudio coinciden con las observaciones hechas por Copple et al. (2004), quienes también encontraron vacuolización y necrosis de hepatocitos (Figura 2A) en animales expuesto a C. pallida. Se hipotetiza que el alcaloide Mn bioactivo produce alteraciones en las células endoteliales sinusoidales hepáticas que conducen a hemorragia, deposición de fibrina, lesiones hepáticas coagulativas en las células del parénquima, megalocitosis, fibrosis hepática y oncosis centrolobulillar regional en el hígado (Copple et al., 2004; Nobre et al., 2004a,b, 2005). Asimismo, se ha reportado la posible presentación de lesiones extrahepáticas en donde pequeñas cantidades de los AP bioactivos pueden entrar a la sangre y ser transporta- dos a otros tejidos, como el parénquima pulmonar o renal (Panter et al., 2019), lo cual podría explicar las alteraciones halladas en pulmón en este estudio (Figura 2B).
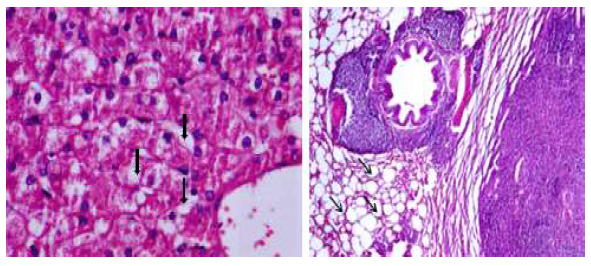
Figura 2 Hallazgos histopatológicos en carneros expuestos al consumo de Crotallaria pallida durante 28 días. A. Alteraciones del parénquima hepático. Las flechas señalan necrosis de hepatocitos con cambio vacuolar severo. B. Alteraciones del parénquima pulmonar. Las flechas señalan engrosamiento de los septos alveolares. 40X, coloración H-E
Los hallazgos histopatológicos pulmonares aquí reportados no coinciden con las lesiones pulmonares descritas por Gardiner et al. (1965), quienes refiere congestión, edema y hemorragias, que según Lee et al. (2005) podría deberse a una hipertensión pulmonar lo que explicaría el edema.
La resistencia de las ovejas a la intoxicación por AP se ha asociado en primera medida con la capacidad de las enzimas hepáticas para desintoxicación, con una baja tasa de producción hepática de pirroles (Cheeke, 1998, 1994); así mismo, Cheeke y Shull (1985) reportaron que existe una mayor producción de EP en bovinos comparados con ovinos. De la misma forma, los microorganismos ruminales pueden desintoxicar los AP consumidos (Culvenor et al., 1984; Duringer et al., 2005). Estas acciones podrían explicar la tolerancia clínica observada en el presente estudio a la ración diaria; pero queda la discusión de que esta misma dosis ha sido reportada por otros autores como tóxica (Nobre et al., 2005; Borelli et al., 2016). Por otro lado, es sabido que las plantas acumulan metabolitos secundarios de acuerdo con consideraciones ontogenéticas de sus procesos adaptativos al agroecosistema y fenómenos medio ambientales preponderantes en el momento de su colecta (Jiménez et al., 2003; Chacón et al., 2013).
CONCLUSION
La ingestión diaria por 28 días de dosis bajas de partes aéreas de Crotalaria pallida (hojas y pequeñas ramificaciones) produce intoxicación subcrónica asintomática en ovinos, sin afectar los perfiles hemáticos, hepáticos y renales, pero causando alteraciones histopatológicas en hígado y pulmón.












 uBio
uBio