INTRODUCCION
Las enfermedades zoonóticas transmitidas por animales domésticos han sido ampliamente estudiadas; sin embargo, el conocimiento sobre la interfaz animales silvestres- animales domésticos y humanos es aún limitado (Miller et al., 2013). Igualmente, la falta de claridad en el proceso ecológico de trans- misión de enfermedades entre animales de vida silvestre y el ganado dificulta el control de las enfermedades infecciosas en estas poblaciones (Barasona et al., 2014).
En Estados Unidos, de 86 enfermedades reportadas en aves, rumiantes, porcinos y lagomorfos, el 79% tiene un componente de vida silvestre asociado con la transmisión, el mantenimiento o el ciclo de vida del patógeno y, de esas enfermedades, 40% tienen potencial zoonótico (Miller et al., 2013). Además, se estima que 75% de las enfermedades infecciosas en humanos son de origen zoonótico, en tanto que 74.5% de las patologías reemergentes se asocian con zoonosis. Así mismo, Otte y Pica-Ciamarra (2021) re- portaron que el 72% de las enfermedades zoonóticas se originan en la vida silvestre. Por ello, la vigilancia sanitaria de la fauna silvestre debe considerarse tan relevante como la de los animales domésticos con el fin de proteger tanto la salud de los animales como del humano (WAHIS, s.f.).
Los cerdos silvestres (Sus scrofa) son una especie de relevancia epidemiológica, debido a que pueden servir como reservorios de múltiples enfermedades transmisibles, tales como tuberculosis, leptospirosis y brucelosis (Rovid et al., 2010), las cuales impactan significativamente en la industria porcícola causando grandes pérdidas económicas, debido principalmente a la alta mortalidad, al sacrificio como medida de control de enfermedades infecciosas y a las restricciones en el comercio nacional e internacional de cerdos y sus productos cárnicos (OIE, 2016).
El incremento de la densidad poblacional de cerdos silvestres en el ámbito mundial es indicativo no solo de un mayor número de huéspedes disponibles para la transmisión de enfermedades, sino también de un aumento de la tasa de con- tacto entre ellos (Acevedo et al., 2016), generando problemas en las explotaciones extensivas por aumento de riesgos sanitarios que llevan a pérdidas económicas (Carpinetti et al., 2014). Por lo tanto, priorizar las enfermedades bacterianas zoonóticas re- lacionadas con la interfaz silvestre es relevante, máxime cuando la población porcina en Colombia cuenta con más de seis millones de animales en cerca de 231 mil predios, de los cuales 94.9% son predios de traspatio y los restantes corresponden a predios tecnificados (ICA, 2021), principalmente en Antioquia (35.5%), Cundinamarca (10.6%) y Valle del Cauca (9.0%), departamentos en los cuales se concentra cerca del 55.2% de la población porcina. En estas regiones se reporta salmonelosis, brucelosis y leptospirosis como las enfermedades infecciosas más comunes en cerdos (FAO, 2010).
El objetivo del presente estudio fue priorizar las enfermedades zoonóticas bacterianas en la interfaz cerdos silvestres (Sus scrofa), cerdos domésticos y humanos en Colombia mediante la revisión de sistemas de indexación y resúmenes (SIR), datos del Sistema Mundial de Información Zoosanitaria (WAHIS, s.f.) y el método de priorización semicuantitativo basado en la evidencia.
MATERIALES Y METODOS
Se realizó la búsqueda de información mediante la revisión de sistemas de indexación y resúmenes (SIR): PubMed, Sage Journals, ScienceDirect y Scopus, así como la información reportada por los sistemas de vigilancia de orden nacional e internacional, teniendo criterios de inclusión como: el artículo debe responder a una o más preguntas de cada criterio, la referencia debe haber sido publicada en revistas científicas indexadas, debe existir reportes de la enfermedad en cerdos silvestres-domésticos-humanos y se debe pre- sentar en Colombia. Para esto, se utilizaron palabras clave como Salmonella, Brucella, Mycobacterium, Pasteurella, Leptospira, Yersina enterocolitica, salmonelosis, brucelosis, tuberculosis, pasteurelosis, leptospirosis y yersiniosis en cerdos silvestres-cerdos domésticos entre los años 1984 y 2015, tanto en español como en inglés. Además, se utilizaron los datos del Sistema Mundial de Información Zoosanitaria (WAHIS, s.f.). La escala de ponderación de cada criterio se le adjudicó un coeficiente entre 0 y 7 de acuerdo con su impacto medido con base en la información científica, donde cero es ningún impacto y siete mayor impacto.
Posteriormente, se llevó a cabo el método de priorización semi-cuantitativo basado en evidencia reportado en la literatura (Humblet et al., 2012; Rist et al., 2014; Cito et al., 2015), en el cual se tomaron en cuenta 27 criterios clasificados en cinco categorías (Cuadros 1, 2 y 3). Cada criterio se valoró con 0-7 puntos, correlacionados con su severidad, teniendo una puntuación de 0 los agentes no zoonóticos. Así, la mayor puntuación la tienen los agentes con más impactos, obteniéndose una sumatoria máxima de 189. Finalmente, se realizó la priorización por categoría de los múltiples criterios de enfermedades en Sus scrofa, dividiéndolo en tres grupos: potencial zoonótico alto, medio y bajo, según la sumatoria final de cada enfermedad.
Cuadro 1 Categorías y descripción de criterios de Humblet et al. (2012), Rist et al. (2014) y Cito et al. (2015), según el método de priorización semi-cuantitativa (Parte I)

Cuadro 2.Categorías y descripción de criterios de Humblet et al. (2012), Rist et al. (2014) y Cito et al. (2015), según el método de priorización semi-cuantitativa (Parte II)

Cuadro 3 Categorías y descripción de criterios de Humblet et al. (2012), Rist et al. (2014) y Cito et al. (2015), según el método de priorización semi-cuantitativa (Parte III)
RESULTADOS
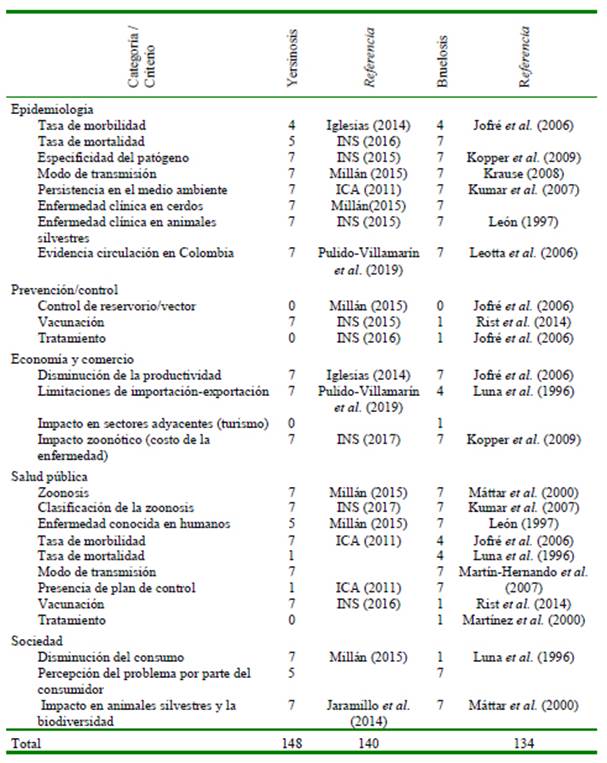
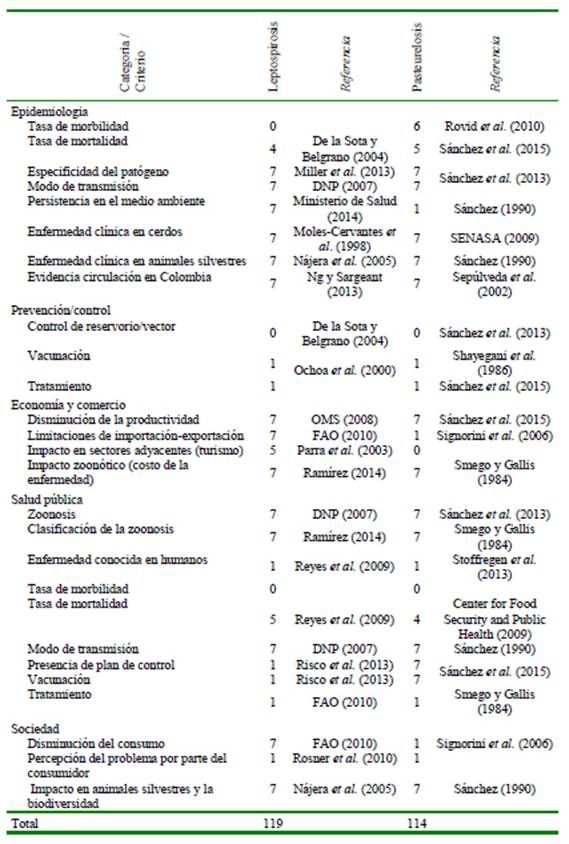
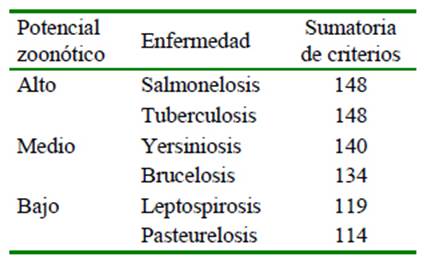
Las dos enfermedades que presentaron un potencial zoonótico alto después de realizar la sumatoria de cada criterio fueron la salmonelosis (148 puntos) y la tuberculosis (148) (Cuadro 4), seguido de yersiniosis (140) y brucelosis (127) con un potencial medio (Cuadro 5) y finalmente, leptospirosis (119) y pasteurelosis (114) con potencial bajo (Cuadros 6). La salmonelosis y tuberculosis, enfermedades priorizadas que presentaron los criterios de puntuación más alta en las categorías de epidemiología, salud pública y sociedad (Cuadro 7), se encuentran directamente relacionadas con una mayor exposición a los factores de riesgo que favorecen la presentación de la enfermedad.
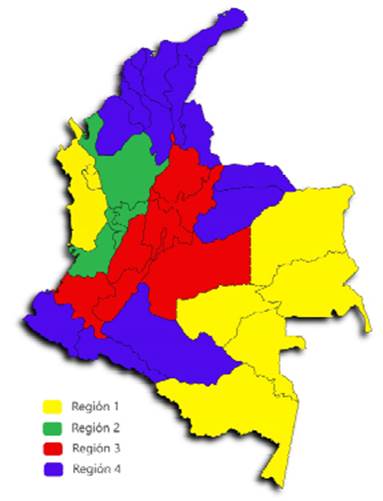
Colombia se encuentra regionalizada según condiciones de producción, mercadeo y topografía (ICA, 2021) en cuatro regiones (Figura 1):
Cuadro 7 Puntaje de criterios según potencial zoonótico cerdos silvestres (Figura 2). Tiene una población de 828 092 animales (16.15% de la población). Es una zona de riesgo epidemiológico.
DISCUSION
La priorización de enfermedades como método para la implementación de políticas públicas, se convierte en una herramienta eficaz para enfocar los esfuerzos de los servicios veterinarios y el sector salud en pro de la disminución de enfermedades de origen zoonótico en la interfaz ecosistema-humano-animal; así como la racionalización de los recursos y su adaptación a contextos
- N.° 1 (Chocó, Amazonas, Murindó y Vigía del Fuerte en Antioquia, San Andrés y Providencia, Guainía, Guaviare, Vaupés y Vichada). Se caracteriza por una baja población porcina con 33 794 animales (0.87% de la población nacional).
N.° 2 (Antioquia, Caldas, Risaralda, Quindío y Valle del Cauca). Cuenta con poblaciones más tecnificadas y núcleos genéticos teniendo una mayor densidad porcina con dos millones de porcinos (50% de la población). Presenta implementación de sistemas sanitarios y de bioseguridad. Es una zona de menor riesgo epidemiológico.
N.° 3 (Cundinamarca, Boyacá, Cauca, Meta, Santander, Tolima y Huila). Concentra el 29% de la población nacional (un millón de animales), presenta sistemas de producción mixtos, con presencia de cerdos silvestres y animales de traspatio, no se manejan esquemas de vacunación estrictos ni se cuentan con tecnologías pro- ductivas. Es una zona de alto riesgo epidemiológico.
N.° 4 (Atlántico, Bolívar, Magdalena, Gua- jira, Cesar, Córdoba, Sucre, Nariño, Norte de Santander, Arauca, Casanare, Caquetá y Putumayo). Presenta alto porcentaje de explotaciones de traspatio (90-95%) con baja práctica de vacunación, presencia de epidemiológicos cambiantes utilizada con éxito por varios países (Rist et al., 2014; OIE, 2016); sin embargo, Krause et al. (2008) mencionan que este método puede no funcionar adecuadamente debido a la dificultad en la definición de criterios, la falta de datos por la insuficiente investigación en el campo y la falta de acuerdos con respecto a un sistema de ponderación general. La colaboración intersectorial es una estrategia que pue- de contribuir a la recopilación de información y monitoreo de tendencias de las enfermedades en poblaciones humanas y animales.
La salmonelosis (148 puntos) y la tuberculosis (148 puntos) fueron las enfermedades con mayor puntuación. En cuanto a la salmonelosis, estudios de prevalencia de anticuerpos de Salmonella spp, entre los años 2001-2004 reportaron 57.8% de seroprevalencia en granjas porcinas intensivas, lo cual demuestra su importancia en el sector pecuario en términos de costos asumidos por la morbimortalidad, tratamientos y el aumento de la probabilidad de resistencia a los antibióticos; así como para los riesgos en la salud pública. La presencia de este patógeno en poblaciones porcinas domésticas destina- das al consumo humano es la principal causante de la enfermedad transmitida por alimentos y la enfermedad diarreica aguda en Colombia (DNP, 2007).

Figura 2 Presencia de cerdos y su interacción en Turbana, Bolívar. Colombia. A. Cerdos silvestres (Sus scrofa); B. Interacción entre cerdo doméstico (centro) y cerdos silvestres (Sus scrofa). Fotos: Diana Benavides Arias
En forma similar, un estudio realizado en 248 predios en 15 departamentos del país evidenció cinco poblaciones porcinas afecta- das por Salmonella spp, con una población de riesgo de 318 animales, una incidencia de 9 porcinos x 100 y una mortalidad de 55 animales x 1000 (ICA, 2011). La importancia de identificar y realizar la adecuada gestión del riesgo de este patógeno en explotaciones porcícolas radica que en que en muchas ocasiones se encuentran animales asintomáticos, que desarrollan enfermedad subclínica, lo que implica la diseminación silenciosa para trabajadores y consumidores. Por lo cual, determinar la prevalencia real de esta enfermedad a partir de pruebas diagnósticas confiables debe ser una prioridad para los productores y los profesionales involucrados en el diagnóstico humano y animal (Varón, 2020).
Además, en 66.5% de cerdos silvestres de Italia (n=255) se encontraron anticuerpos contra Salmonella spp, siendo Salmonella enterica la especie más aislada (24%) (Zottola, 2013). El Instituto Nacional de Salud de Colombia en 2019 publicó el Informe de Evento de Enfermedades Transmitidas por Alimentos indicando que los principales agentes etiológicos de enfermedades transmitidas por alimentos causantes de enfermedades diarreicas ocasionaron alrededor de 230 000 muertes, especialmente por Salmonella enterica no tifoidea, Salmonella Typhi y Taenia solium (INS, 2019a).
En el caso de tuberculosis (148 puntos), los cerdos pueden verse afectados por Mycobacterium tuberculosis, M. bovis y M. avium (Cano-Terriza et al., 2016). En un estudio en cerdos silvestres (Sus scrofa) de España se encontraron lesiones macroscópicas compatibles con tuberculosis en 83.6% (105-127) de los animales y lesiones microscópicas en 8.7% (11 animales), siendo reconocidos por su capacidad de mantener la infección, además de ser un posible reservorio de vida silvestre (Martín-Hernando et al., 2007). En Colombia, hasta la semana epidemiológica 28 de 2016 se notificaron 7287 casos de tuberculosis de todas las formas (INS, 2016) y 12 918 casos en 2015 (INS,2015), siendo de alta notificación respecto a otras enfermedades.
Por otra parte, aunque la leptospirosis fue de potencial zoonótico bajo (119 puntos), en Colombia es una enfermedad bajo vigilancia epidemiológica, notificándose 2718 casos acumulados para el 2019, concentrándose el 28.7% de los reportes en Antioquia, 11.6% en el Valle del Cauca y 11.1% en Tolima, zonas de gran densidad de población porcícola (INS, 2019b). Esto se convierte en un aspecto de gran importancia para las autoridades sanitarias por el incremento de casos en temporada de lluvias e inundaciones (Pulido-Villa Marín et al., 2019). En países en vías de desarrollo de América Latina y el Caribe (ALC) como Colombia, se presenta un elevado número de casos de enfermedades zoonóticas. Marín (2020) reporta los resultados de una encuesta en ministerios de salud de los 33 países de ALC, donde las zoonosis endémicas prioritarias que se notifican con mayor frecuencia son leptospirosis (69%), brucelosis (15%) y salmonelosis (15%).
Finalmente, la pasteurellosis (potencial zoonótico bajo) no es una enfermedad de vigilancia epidemiológica a pesar de producir efectos dermatológicos y pulmonares en personas (Sánchez, 1990; Carriquiriborde et al., 2006; Reyes et al., 2009).
Utilizar métodos de priorización de enfermedades zoonóticas resulta de utilidad para contribuir en la identificación de potenciales riesgos para la salud humana y animal. El impacto de estos patógenos en la interfaz de cerdos silvestres, animales domésticos y se- res humanos tiene consecuencias directas e indirectas en los costos asociados a la producción pecuaria y ejerce presión sobre los sistemas sanitarios.
CONCLUSIONES
La salmonelosis y la tuberculosis fueron las enfermedades con mayor puntuación en la evaluación, según los niveles de severidad planteados en el estudio.
Se destaca la falencia en la vigilancia epidemiológica en las regiones 3 y 4 de Colombia. Departamentos como Bolívar, Cundinamarca y Tolima podrían desempeñar un rol más activo en la prevención y control de estas enfermedades, dado que son zonas de circulación considerable de la bacterias y de mayor riesgo epidemiológico en poblaciones domésticas y silvestres.
Incluir dentro de la notificación obligatoria a especies y serovares de Salmonella como S. Typhimurium en casos de intoxicaciones alimentarias en humanos, ya que la presencia de esta bacteria en especies porcinas domésticas y silvestres es un factor relevante para la trans- misión zoonótica.
Reconocer el papel de la tuberculosis porcina en el mantenimiento de la infección en especies bovinas en el territorio nacional debería ser una prioridad para los entes de control que se encargan de la prevención y erradicación de esta enfermedad en especies de importancia zootécnica en Colombia.












 uBio
uBio