INTRODUCCIÓN
La producción in vitro de embriones (PIVE) en las especies de interés zootécnico es una biotecnología reproductiva utilizada para mejorar el desempeño productivo de los rebaños mediante la producción de animales genéticamente superiores o de elevado mérito económico (Camargo et al., 2006). La PIVE comprende un proceso secuencial de tres eventos en el laboratorio: maduración in vitro de ovocitos (MIV), fecundación in vitro de ovocitos madurados (FIV) y el cultivo in vitro de ovocitos fertilizados (CIV) hasta el estado de blastocisto en el día 7 en el caso del bovino (Silva et al., 2010; Quispe et al., 2018). A través de la MIV el ovocito bovino avanza desde la etapa de diploteno de la profase I, cuando el núcleo del ovocito está en un estado de vesícula germinal, a la metafase II, lo cual implica también un proceso de maduración citoplasmática (Rocha- Frigoni et al., 2016), selección y capacitación de los espermatozoides, y el cultivo posterior de los embriones (Wrenzycki, 2016). Varios factores inherentes al ovocito, al ambiente fisiológico de la hembra en el momen to de ser colectado, al ambiente propio del cultivo celular, como los instrumentos y equipos, los químicos (tipo y composición de los medios de cultivo), microambientales (concentración de gases y temperatura en incubadoras), así como el número de estructuras cultivadas en cada gota y de la experticia de los operadores pueden influir en la eficiencia de la PIVE y contribuir a las diferencias existentes entre embriones producidos in vivo e in vitro (Camargo et al., 2006).
La eficiencia de la PIVE varía entre el 30 y 40% de producción de blastocitos (Ranjbar et al., 2019) y está relacionada con los medios de cultivo que se utilizan (Díaz, 2017). La eficiencia se refleja en la obtención de embriones sin alteraciones morfológicas; y en la expresión génica, porque las condiciones en las que se desarrollan los embriones in vitro no pueden imitar completamente a las in vivo (Camargo et al., 2006). Las condiciones estándar de CIV de embriones aumentan las especies reactivas del oxígeno (ROS), y constituye una de las principales causas del reducido desarrollo embrionario (Rocha-Frigoni et al., 2016). La producción de ROS es un proceso normal que ocurre en la cadena respiratoria mitocondrial de la célula (Rocha-Frigoni et al., 2016). Los organismos vivos poseen factores protectores naturales que contrarrestan los efectos negativos de las ROS, llamados antioxidantes (Mahmoud et al., 2016).
En condiciones fisiológicas normales las ROS y los antioxidantes celulares se encuentran en equilibrio. Las células poseen mecanismos fisiológicos para obstaculizar la formación excesiva de radicales libres (H2O2, O2-, OH., etc.) incluidas las enzimas específicas que controlan los niveles intracelulares (Sovernigo et al., 2017). Los captadores de oxígeno presentes en fluidos foliculares y oviductales protegen el estrés oxidativo de ovocitos y los embriones in vivo, eliminando o reduciendo el efecto de ROS, además de varias enzimas, tales como Cu-Zn superóxido dismutasa (Cu-Zn/SOD), Mn/SOD, catalasas, glutatión-peroxidasa (GSH-Px) y ceruloplasmina, además de las vitaminas A, C y E (García-Díaz et al., 2013). Sin embargo, en condiciones in vitro los niveles de antioxidantes son más bajos que in vivo, porque los ovocitos y embriones no se benefician del sistema de protección antioxidante materna. Las especies reactivas de oxígeno pueden atravesar fácilmente las membranas celulares, alterando la mayoría de las moléculas orgánicas y afectando el desarrollo temprano de los embriones (Khazaei y Aghaz, 2017).
Durante la PIVE los niveles altos de ROS inducen el estrés oxidativo (ES), lo que conlleva al desarrollo embrionario deficiente (Rocha-Frigoni et al., 2016), si no se implementan medidas para reducirlo. El ES es producto del desbalance entre la producción de ROS y el efecto protector del sistema antioxidante, responsable de su neutralización y/o remoción (Tsantarliotou y Sapanidou, 2018). Si en condiciones de cultivo in vitro este sistema es insuficiente para neutralizar las ROS, entonces los efectos perjudiciales sobre la calidad de los gametos y de los embriones es considerablemente mayor (Ranjbar et al., 2019). Esto ocurre porque altera y minimiza la función y supervivencia celular, daña las proteínas, lípidos, DNA y acelera la apoptosis celular (Tsantarliotou y Sapanidou, 2018). Asimismo, los niveles de ROS superiores a los fisiológicos reducen la transferencia de nutrientes y afecta los factores de supervivencia de los ovocitos, desencadenando la apoptosis de las células de la granulosa (Khazaei y Aghaz, 2017). Los embriones de mamíferos producen ROS principalmente a través de la fosforilación oxidativa, lo que implica un aumento gradual en la producción de ROS des- de el embrión bovino de dos células hasta la etapa de mórula tardía. Esto puede atribuirse al consumo de oxígeno, glucosa y captación de piruvato durante el desarrollo del embrión, que luego empieza a disminuir en la etapa de blastocisto debido a la contribución de la glucólisis a la suplementación con ATP y a la inducción de defensa antioxidante (Tsantarliotou y Sapanidou, 2018).
El equilibrio entre las ROS y los mecanismos antioxidantes de defensa celular son esenciales para crear las condiciones favorables para la PIVE (Rocha-Frigoni et al., 2016). Los antioxidantes pueden influenciar en la maduración in vitro de los ovocitos y el consiguiente desarrollo embrionario al ser adicionados al medio de cultivo (Mahmoud et al., 2016). El glutatión (GSH) es un antioxidante que protege a las células contra los efectos nocivos del estrés oxidativo al reducir o eliminar las ROS (Sandal, 2018). El GSH es sintetizado a partir de tres aminoácidos constitutivos: la cisteína, glicina y glutamato (Anchordoquy et al., 2019). El GSH es uno de los sulfhidrilos no proteicos compuestos, un tiol libre que protege el cigoto cultivado de estrés oxidativo (Goel et al., 2017). El GSH juega un rol importante en la maduración de los ovocitos, la fertilización y desarrollo embrionario temprano, pero en general, ha sido poco estudiado durante la PIVE. La adición de antioxidantes (AO) du- rante la MIV reduce los niveles de especies reactivas de oxígeno en el sistema de cultivo al aumentar el contenido intracelular de GSH (Nikoloff et al., 2020). Los AO pueden reducir el estrés oxidativo durante la MIV disminuyendo los niveles de ROS directamente o aumentando los niveles de GSH en los ovocitos, dependiendo del tipo de AO usado (Mukherjee et al., 2014; Sovernigo et al., 2017). Asimismo, el GSH mejora el desarrollo del embrión bovino cuando se encuentra en altas concentraciones durante la maduración in vitro (Anchordoquy et al., 2019).
Se ha comprobado que los compuestos tiol de bajo peso molecular, como la cisteamina (CYS), pueden aumentar el contenido de GSH y la absorción de cisteína por los ovocitos durante la MIV (Sovernigo et al., 2017). La CYS actúa dentro del embrión aumentando la síntesis de glutatión, otro potente AO (Silva et al., 2018). La CYS es un pequeño amino tiol derivado de la degradación de la coenzima A (Gallego-Villar et al., 2017) que actúa como precursor de GSH. Aunque no tiene un efecto directo sobre ROS, contribuye a aumentar los niveles de GSH (Sovernigo et al., 2017) reduciendo la cistina a cisteína y mejorando la síntesis de glutatión (Swami et al., 2017). La cisteamina se agrega a los medios de MIV para mejorar la competencia de desarrollo de los ovocitos (Mahmoud et al., 2016) y promueve el desarrollo temprano de embriones al facilitar la maduración citoplasmática de los ovocitos (Ranjbar et al., 2019). Los compuestos de tiol como la cisteamina tienen diferentes efectos cuando se agregan al medio de cultivo de embriones y depende de la concentración utilizada, la especie y el tipo de ovocito (Mahmoud et al., 2016). Dada la abundante cantidad de información publicada sobre el uso de la cisteamina como antioxidante en la PIVE de embriones en rumiantes, esta revisión de literatura tiene como objetivo hacer una actualización detallada de los conocimientos sobre este interesante tema biotecnológico.
Importancia de la Producción in vitro de Embriones
La producción de embriones in vitro es una biotecnología desarrollada para obtener crías de animales de producción de alto valor genético (Quispe et al., 2018), habiendo contribuido grandemente en la mejora genética de los rebaños bovinos en el mundo, y a disminuir el intervalo generacional (Kasinathan et al., 2015). Mientras que en condiciones normales los bovinos pueden tener máximo una cría por vaca/año, el uso de esta biotecnología ha permitido multiplicar esta cifra. A partir de mediados de la década pasada la producción in vitro de embriones (PIVE) reemplazó progresivamente al sistema de múltiple ovulación y la transferencia de embriones (MOET) (Viana et al., 2018), y para el año 2018, del total de embriones transferibles colectados o producidos en el mundo (n=1 499 367), 31.3% fueron embriones obtenidos in vivo (n=469 967) y 68.7% fueron producidos in vitro (n=1 029 400) (IETS, Embryo Technology Newsletter, 2019).
La producción de embriones transferibles in vitro se debió, en primer lugar, a la implementación de la aspiración folicular guiada por ultrasonido (Ovum pick up - OPU) como procedimiento rutinario para la obtención de ovocitos bovinos, que permitió la recolección de ovocitos de varias vacas donadoras en una jornada de trabajo (Viana et al., 2018), sin someterlas a protocolos de estimulación ovárica o superovulación. En segundo lugar, el aumento de la eficiencia en la producción de embriones in vitro (Watanabe et al., 2017), así como su aplicación a gran escala en establecimientos comerciales bovinos (Morotti et al., 2014; Sánches et al., 2019) afectó positivamente el costo de los servicios relacionados y derivados de esta actividad, convirtiéndola en un negocio rentable, tanto para las compañías prestadoras del servicio como para las empresas ganaderas que se benefician de estas tecnologías (Viana et al., 2018).
La PIVE implica la recolección de ovocitos viables que son obtenidos como complejos ovocito-células del cúmulo (COC), que luego son manipulados en condiciones de laboratorio a través de tres etapas: MIV, FIV y CIV. En general, los COCs se obtienen post mortem de ovarios de matadero, o in vivo, mediante la OPU. El primer procedimiento ha sido usado como modelo experimental para estudiar diversos aspectos relacionados con las diferentes etapas de la PIVE (Álvarez et al., 2006; Manjunatha et al., 2008) y poner a punto la tecnología, a fin de convertirla a una escala comercial (Sanches et al., 2019). Este procedimiento implica que los ovarios deben ser transportados al laboratorio, preferiblemente en un corto periodo. Estudios donde utilizaron ovocitos aspirados de ovarios de matadero y mantenidos en tubos de poliestireno con 400 ml de TCM-199 + HEPES en el aire encontraron que los ovocitos se pueden retener hasta 12 h sin perjudicar el desarrollo embrionario. Leivas (2002) asimismo observó una mejor calidad morfológica en embriones derivados de ovocitos transportados durante 6 h en líquido folicular antes de IVM; en tanto que Rauber et al. (2002) registraron un mayor rendimiento de blastocistos en ovocitos contenidos en lí- quido folicular bovino de folículos grandes (>8 mm) en lugar de pequeños (3-5 mm).
En el laboratorio, los tejidos que rodean el ovario son removidos, y los ovarios son lavados varias veces en solución salina fisiológica. Luego los COC son aspirados de folículos de 2 a 8 mm de diámetro (Kubota y Yang, 1998) o por cortes sucesivos de la corteza ovárica o slicing (Gordon, 2003). La aspiración folicular se hace usualmente con jeringas desechables o con una línea de aspi- ración conectada a una bomba de vacío. En el segundo caso, la OPU permite obtener ovocitos de vacas de alto valor genético, hasta dos veces por semana sin afectar la efectividad de la técnica (Kruip et al., 1994), cuyos embriones producidos in vitro pueden ser transferidos a hembras receptoras. La presión de vacío y el calibre de la aguja usadas en el proceso puede afectar la calidad de los ovocitos obtenidos (Bols et al., 1996). Estudios demuestran que aplicando 80 mmHg se obtuvo una menor proporción de COCs de categoría A y B y de ovocitos maduros comparado con 65 y 50 mmHg (Perea et al., 2017). La calidad de los ovocitos y la competencia para desarrollarse como embriones se afecta cuando la aspiración folicular se efectúa a presiones superiores a 50 mmHg (Ward et al., 2000).
Maduración in vitro
La MIV es el primer paso de una serie de tres etapas que culminan con la producción de embriones transferibles. Eso implica colocar los COCs en una gota de medio de cultivo, en un ambiente a 38.5 ºC, con un 5% CO2 en aire y humedad de saturación, que promuevan su maduración y los prepare para la fecundación (Hernández, 2001). Durante esta fase el ovocito progresa desde un estadio de profase I (vesícula germinal) al de metafase II (MII) de la segunda división meiótica, en un lapso de 20 a 24 horas (Gordon, 2003), con la concomitante extrusión del primer corpúsculo polar. A la vez, se produce un proceso de maduración citoplas-mática caracterizado por el almacenamiento de lípidos, distribución de mitocondrias y ribosomas, reducción de aparatos de Golgi y migración de los gránulos corticales (Heytell et al., 1997). Por otra parte, se desarrolla un sistema de liberación de Ca2+, importante para el reinicio de la meiosis, fertilización y desarrollo del embrión (Damiani et al., 1996). En condiciones adecuadas de maduración in vitro, 85 a 90% de los ovocitos alcanzan la MII; no obstante, la maduración citoplasmática y la adquisición de la capacidad total de desarrollo ovocitario no siempre ocurre de manera exitosa en la misma proporción (Ferré et al., 2020). La calidad de los ovocitos y su capacidad de desarrollo posterior determinan la tasa de producción de blastocistos (Krisher, 2004) y la habilidad de estos para concluir en una gestación exitosa, una vez que son transferidos a hembras receptoras (Sirard et al., 2006). Asimismo, las condiciones in vitro en las que maduran los ovocitos influyen en las etapas subsecuentes de la PIVE (Rizos et al., 2001).
Fecundación in vitro
Una vez que los ovocitos han alcanzado la MII y han experimentado los cambios citoplasmáticos que los capacitan para la fecundación, se les coincuba con espermatozoides por 18-24 horas, en un ambiente a 38.5 ºC, con una atmosfera con 5% CO2 en aire y humedad de máxima (Hernández, 2001). Para ello, los espermatozoides deben ser sometidos previamente a un proceso de lavado para eliminar el líquido seminal y el diluyente, además de separar los espermatozoides móviles y viables de los inmóviles y muertos (Hernández, 2001). Para esto se ha venido utilizando el método de swim up (Parrish y Foote, 1987) y el gradiente de Percoll (Palma, 2001), aunque en la actualidad hay productos comerciales como el Bovipure® y Puresperm® (Ruiz y Astiz, 2010).
Luego debe inducirse la capacitación espermática para que los espermatozoides puedan fecundar al ovocito (Palma, 2001). Varias sustancias han sido utilizadas para inducir la capacitación espermática in vitro, pero la heparina ha demostrado ser muy efectiva, y actualmente es usada en los laboratorios comerciales de fecundación in vitro (FIV) por su potente efecto inductor de la capacitación (Handrow et al., 1982). Por otro lado, se requiere determinar la concentración espermática final por unidad de volumen, en dosis entre 1 y 5 millones de espermatozoides de acuerdo con el método, la raza, la concen- tración de heparina, el tiempo de cocultivo, la aptitud individual del toro (Palma, 2001) y el tipo de semen usado (convencional o sexado) (Ferré et al., 2020). A las 48 horas de iniciada la FIV, la tasa de fecundación puede ser monitoreada por la proporción de estructuras clivadas, que normalmente varía entre 60 y 80% (Palma, 2001).
Cultivo in vitro
Al culminar la FIV, las células del cúmulo son removidas y los presuntos cigotos que han sido incubados por seis días, entre 20 a 40% de embriones alcanzan el estadio de blastocisto (Lonergan y Fair, 2008). Esta baja producción de blastocistos se debe en primer lugar, a la maduración citoplasmática incompleta de los ovocitos y a las condiciones de maduración in vitro insuficientes, que conduce a una activación alterada del genoma embrionario (Sirard et al., 2006). En segundo lugar, a que los embriones necesitan una gran cantidad de sustancias como glicoproteínas, antioxidantes y factores de crecimiento, y la interacción con el epitelio oviductal y endometrio (Lonergan et al., 2016); requeri- mientos que en condiciones in vitro no pueden ser alcanzados en su totalidad.
Los medios de cultivo han ido mejorando con el fin de proveer condiciones cada vez más parecidas a las del oviducto y ambiente uterino, con el propósito de favorecer la segmentación, formación del blastocele y el desarrollo normal del embrión (Hernandez, 2001). En general, los medios de cultivo de embriones son soluciones con 99% de agua ultrapura, bufferada con el sistema HCO3/ CO2, con una osmolaridad entre 270 y 300 mOsm/L, y con una gran cantidad de constituyentes inorgánicos (NaCl, KCl, KH2 PO3, CaCl22 H2O, MgCl26H2O) y orgánicos (piruvato, lactato, glucosa, aminoácidos y otros) que emulan las condiciones del ambiente oviductal y uterino materno (Palma, 2001). Así, el análisis bioquímico del fluido oviductal de la oveja permitió el desarrollo de un medio usado intensamente en ovinos y bovinos, denominado fluido oviductal sintético (SOF) (Tervit et al., 1972) y posteriormente mejorado para bovinos (Holm et al., 1999). Para tratar de compensar las deficiencias de los medios de cultivo in vitro, en términos de constituyentes del fluido oviductal y uterino, se ha adicionado a los medios suero fetal bovino (FSC) o la albúmina sérica bovina (BSA) como fuentes proteicas.
La adición de 0.1, 0.5 o 1% (Mullaart et al., 2015; Murillo et al., 2017), o 2% (Leivas et al., 2011) de FSC al medio de cultivo aumentó la cantidad y calidad de blastocistos producidos. Porcentajes mayores al 10% fueron asociados con efectos degenerativos y con el nacimiento de crías con el síndrome de descendencia grande, que se refiere al aumento del peso de los terneros al nacer, hidropesía del alantoides, abortos, mortalidad perinatal, terneros y placenta de gran tamaño (Farin et al., 2001; Lazzari et al., 2002). La adición de BSA con o sin 10% de FCS en el medio de cultivo produjo tasas de clivaje y porcentajes similares de blastocistos; sin em- bargo, el FSC disminuyó dramáticamente la criotolerancia de los blastocistos luego de la vitrificación (Rizos et al., 2003).
Factores que Influencian la Producción in vitro de Embriones
La producción in vitro de embriones en términos del número y calidad de blastocistos producidos depende de factores inherentes al ovocito, y de los eventos que se desarrollan posteriormente una vez que los ovocitos son colectados del ovario. El primer caso hace referencia a la competencia del ovocito para madurar y desarrollarse como un embrión que alcanza el estadio de blastocisto en el día 7 luego de la FIV. La competencia ovocitaria depende a su vez de numerosos factores, algunos de los cuales son descritos a continuación. En el segundo caso, se deben a los medios de MIV, FIV, CIV usados, los aditivos agregados, las condiciones microambientales de incubación de los ovocitos y embriones, y la experticia en el manejo de las etapas del proceso in vitro.
Origen del ovocito
El origen del ovocito (colectados de ovarios post mortem o mediante OPU) ha tenido resultados controvertidos. Karadjole et al. (2010), colectaron 469 y 250 ovocitos de ovarios de matadero y por OPU respectivamente, y obtuvieron mayor proporción de ovocitos de mayor calidad (grado 1 y 2) de los ovarios de matadero que de los colectados mediante OPU (10.8 y 5.7, respectivamente). No obstante, aunque la tasa de clivaje fue similar entre ambos grupos, una mayor proporción de embriones del grupo OPU alcanzó el estadio de blastocisto en el día 7 y 9, y tuvieron más blastómeros que los del grupo post mortem. En otro estudio se comparó la competencia de ovocitos de búfalas obtenidos por OPU (grupo A) y de ovarios post mortem (grupo B), y de ovarios de vacas post mortem (grupo C), obteniéndose mayor tasa de clivaje en C que en A y B; no obstante, la relación de blastocistos obtenidos y ovocitos madurados fue similar entre A y C, y superior a B (Gasparrini et al., 2003). Por otro lado, Quispe et al. (2018) no encontraron diferencias en el desarrollo embrionario de ovocitos obtenidos de ambas fuentes.
Tamaño y fase de desarrollo folicular
Lonergan et al. (1994) encontraron que la mayor proporción de ovocitos obtenidos de folículos >6 mm tenían más de cinco capas de células de la granulosa que los de menor talla, y que de los primeros se obtuvo casi el doble de blastocistos que, de los obtenidos de folículos menores a 6 mm, aunque la tasa de clivaje y de eclosión de blastocistos fue similar entre ambos grupos. En otro estudio, el número de folículos pequeños (2-5 mm), medios (6-10 mm) y grandes (11-15 mm) fue mayor en la fase de crecimiento que en la de dominancia folicular. Asimismo, en las tres categorías de folículos la tasa de producción de blastocistos fue mayor en los colectados en la fase de crecimiento que en la de dominancia folicular (Machatkova et al., 2004).
Tamaño del ovocito
El tamaño del ovocito parece tener relación con la competencia meiótica, capacidad desarrollo ovocitario y subsiguiente desarrollo embrionario. Fair et al. (1995) encontraron que el diámetro de los ovocitos aumentaba en la medida que aumentaba el diámetro de los folículos (de 98.9 µm en los folículos <1 mm a 117 µm en aquellos >4 mm). Observaron también que la maduración nuclear aumentaba con el incremento del diámetro ovocitario, y los ovocitos desarrollaron por completo la competencia meiótica cuando alcanzaron un diámetro de 110 µm. Posteriormente, Otoi et al. (1997) indicaron que la competencia meiótica se alcanzó en los ovocitos que obtuvieron un diámetro de 115 µm, mientras que la capacidad completa de desarrollo (maduración nuclear y citoplasmática) cuando obtuvieron un diámetro no menor de 120 µm.
Tejido luteal
Según las evidencias, la presencia de un cuerpo lúteo (CL) al momento en que se recuperan los ovocitos parece que tiene influencia en el número y calidad de los ovocitos obtenidos (Moreno et al., 1993; Penitente- Filho et al., 2015). Asimismo, una mayor proporción de blastocistos se desarrollaron con mayor rapidez cuando los ovocitos fueron colectados los días 14 a 16 del ciclo estral que en otros momentos del ciclo estral (Machatková et al., 1995). Recientemente, un estudio demostró que los ovocitos obtenidos de ovarios con un CL, con apariencia y características morfológicas del diestro, fueron más grandes y una mayor proporción de ellos habían culminado el crecimiento y estaban preparados para proseguir con la maduración, que los obtenidos del ovario contralateral sin un CL de la misma vaca, y de los recuperados de vacas sin CL en ambos ovarios (Argudo et al., 2020). El enfoque experimental planteado en este estudio permite suponer que la influencia del tejido luteal en la competencia ovocitaria ocurrió a través de mecanismos intraováricos. Asimismo, en vacas lecheras, la concentración reducida de progesterona durante la primera onda folicular disminuyó la calidad del embrión (Rivera et al., 2011) y la tasa de preñez pos-servicio (Denicol et al., 2012).
Otros factores
Las condiciones del medio ambiente juegan un papel importante en la calidad de ovocitos que se recuperan y en la producción de embriones que se obtienen. En ambientes tropicales y subtropicales, y en los meses más calurosos en los climas templados, las vacas experimentan estrés calórico con mucha frecuencia. En estas condiciones la tasa de producción de blastocistos se ve considerablemente afectada (Al-Katanani et al., 2002). Sin embargo, no todos los grupos genéticos bovinos responden de igual forma a los ambientes de estrés térmico. Las razas Bos indicus producen proporcionalmente mayor cantidad de blastocistos en condiciones de estrés calórico que las razas Bos taurus (Silva et al., 2013; Sales et al., 2015). También, algunas razas Bos taurus adaptadas al trópico, como las criollas y el Senepol, con pelaje de pelo corto y liso, han sido utilizadas para introducir rasgos que mejoran la termotolerancia de otras razas Bos taurus poco adaptadas a las regiones subtropicales y tropicales del planeta (Hansen, 2020). El efecto del estatus nutricional sobre la competencia ovocitaria y la subsecuente producción de embriones también ha sido descrito (Santos et al., 2008).
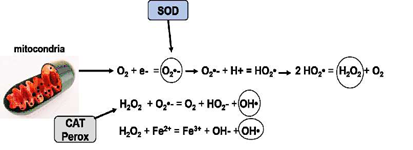
Figura 1 Formación de radicales libres y compuestos oxidantes derivados del oxígeno en la mitocondria. A través de la cadena respiratoria el oxígeno molecular es transformado en anión superóxido (O2•-) al adquirir un electrón. Este al reaccionar con dos protones (H+) se transforma en dióxido de hidrógeno (HO2) y cuando reaccionan dos moléculas de este compuesto se origina el peróxido de hidrógeno (H2O2) más oxígeno. EL peróxido de hidrogeno puede reaccionar con el anión superóxido y generar el radical hidroxilo (OH•) altamente tóxico. A su vez el H2O2 puede reaccionar con el hierro (Fe2+) y originar más radicales hidroxilos. Enzimas como el superóxido dismutasa (SOD) y las catalasas y peroxidasas (CAT, Perox) intervienen catalizando estas reacciones. En el intermedio de estas reacciones otros radicales como el peroxil (ROO•), el alcoxil (RO•) y el óxido nítrico (ON) están presentes.
Especies Reactivas de Oxígeno (ROS)
El metabolismo oxidativo es un proceso mediante el cual el organismo facilita la eliminación de sustancias como fármacos u otros compuestos haciéndolos solubles en agua para mejorar su eliminación a través de la orina. Por otro lado, a nivel celular la participación del oxígeno en la cadena respiratoria mitocondrial induce la producción de energía necesaria para los procesos celulares. Las alteraciones en este proceso metabólico pueden llevar a consecuencias dañinas a nivel celular en diferentes especies animales de metabolismo aeróbico (Cross et al., 1987; Biller-Takahashi et al., 2015; Dong et al., 2017; Ulrich y Jacob, 2019).
Los fenómenos de oxidación y reducción están presentes en los organismos aeróbicos como indispensables en la obtención de energía. El oxígeno molecular representa uno de los oxidantes más potentes que puede inducir el estrés oxidativo. Durante el metabolismo oxidativo se producen varios radicales libres (RL) altamente oxidantes que se conocen como especies reactivas de oxígeno (ROS) que son el resultado del metabolismo normal de la célula y que juegan también un papel importante en varias vías metabólicas. Varios componentes del ROS son esenciales para la defensa a infecciones ya que son potentes bactericidas y pueden destruir organismos patógenos (Cross et al., 1987; Biller-Takahashi et al., 2015; Dong et al., 2017). La producción de ROS se localiza principalmente en la mitocondria, en los peroxisomas, en el citoplasma y en la membrana celular (Halliwell y Gutteridge, 1999). El proceso de transformar al oxígeno molecular (poco reactivo) a ROS (altamente reactivas) involucra la transferencia de un electrón o la absorción de energía por esta molécula. De esta manera se producen RL como el anión superóxido (O2•-), el radical hidroxilo (HO•), el radical peroxil (ROO•), el radical alcoxil (RO•) y el óxido nítrico (ON) el cual también puede formarse del metabolismo del nitrógeno. También se producen compuestos no radicales como el peróxido de hidrogeno (H2O2), el ácido hidrocloroso (HClO), y compuestos unidos a metales de transición como el Cu y el Fe (Halliwell y Gutteridge, 1999; Sorg, 2004; Barreiros et al., 2006; Ulrich y Jacob, 2019) (Figura 1).
Entre los ROS, el radical hidroxilo (HO•) es el más dañino, porque hay una gran dificultad en sacarlo de las células por su muy corta vida media. Este RL se forma en el cuerpo por reacción del H O con los metales de transición y por hidrolisis del agua por exposición a radiaciones ionizantes. No existe ningún antioxidante capaz de prevenir la acción del HO•, siendo solo posible inhibir su formación o reparar los daños causados por este (Halliwell et al., 1995; Barreiros et al., 2006) (Figura 1).
El radical anión superóxido (O2 •-) suele estar inactivo, y en medios acuosos produce una molécula de H O y una molécula de oxígeno por dismutación, acción inducida por la SOD. Este RL forma parte de varias reacciones químicas con importantes funciones biológicas, como la reducción de la producción de radicales HO•, al reducir los quelatos de Fe, así como el Fe2+ liberado de las proteínas de almacenamiento (ferritina y aconitasa) y las sulfoproteínas de hierro, además de reaccionar con el radical HO• produciendo oxígeno atómico (estado excitado) y reaccionar con el ON produciendo peroxinitrito (ONOO•) (Babior, 1997; Halliwell, 2000; Barreiros et al., 2006). El radical superóxido, a pesar de sus efectos nocivos, tiene una función importante para la defensa inmunológica, siendo usado por las células fagocitarias, los linfocitos y los fibroblastospara destruir patógenos. El O2•- producido en las células puede ser eliminado por la enzima SOD, que cataliza la dismutación de dos moléculas de O2• - en oxígeno y H2O2; sin embargo, cuando no hay eliminación enzimática (peroxidasas y catalasa), esta última molécula puede conducir a la formación de radicales OH• (Babior, 1997; Halliwell, 2000, Barreiros et al., 2006; Li et al., 2016; Dong et al., 2017).
El H2O2 (peróxido de hidrogeno) es un compuesto no radical poco reactivo que puede difundirse fácilmente a través de las membranas celulares y, en consecuencia, promover la formación del radical OH• después de unirse con los metales de transición (Fe, Cu), que suelen estar presentes en el interior de la célula. Esta molécula se genera por la dismutación del O2•- por las enzimas oxidasas, o incluso por la oxidación de los ácidos grasos. El peróxido de hidrógeno en la matriz mitocondrial se produce en abundancia durante el proceso de reducción del O2, pero puede ser eliminado parcialmente por la catalasa, las enzimas glutatión peroxidasa y las peroxidasas unidas a la tioredoxina, o puede ser liberado más adelante en el citoplasma de la célula. En los fagocitos, el H2O2 es un precursor de los ácidos hipoalógenos que son fuertes oxidantes contra los patógenos, pero también actúa de manera deletérea sobre las moléculas del propio organismo (Husain et al., 1987; Vogt, 1995; Halliwell, 2000).
Los radicales libres tienen diferentes tipos de media vida y grados de reactividad. En general son muy inestables y pueden inducir oxidaciones no dependientes de enzimas en varios compuestos celulares tales como proteínas, carbohidratos, lípidos, ácidos nucleicos. (Halliwell, 2009; Buonocore et al., 2010; Hamanaka y Chandel, 2010). La formación de estos RL tiene varios orígenes: 1) el metabolismo oxidativo mitocondrial, a través del transporte de electrones en la cadena respiratoria en donde ocurre la formación de las ROS (Barreiros et al., 2006); 2) la «explosión oxidativa» (del inglés oxidative burst) que ocurre en células del sistema inmunitario (neutrófilos, monocitos/macrófagos, células dendríticas, linfocitos B y T) como estrategia para combatir patógenos oxidando los compuestos de los microorganismos y llevándolos a su destruc- ción (Park, 2003; Cathcart, 2004; Klebanoff, 2005; Dale et al., 2008; Biller-Takahashi et al., 2013); y 3) factores inductores de las ROS provenientes del ambiente.
Estrés Oxidativo
El estrés oxidativo (EO) es una condición que refiere al desequilibrio entre los niveles de las ROS y sus antioxidantes. Las ROS pueden aumentar y dañar lípidos, proteínas y el ADN. El EO ha sido vinculado a una gran variedad de enfermedades; sin embargo, las moléculas de las ROS también actúan en la defensa inmunológica, así como en la señalización de las vías celulares y en el mantenimiento de las funciones fisiológicas (Wood et al., 2003; Schieber y Chandel, 2014). Las propiedades químicas de las ROS y los RL les dan reactividad a diferentes objetivos biológicos, y cuando están en exceso pueden causar la peroxidación de los lípidos de la membrana, el deterioro de las proteínas en los tejidos, de las membranas, las enzimas, los carbohidratos y el ADN (Cross et al., 1987; Kiley y Storz, 2004; Finkel, 2011; Dong et al., 2017). Los RL son átomos o grupos de átomos altamente reactivos que tienen un electrón no apareado en su último orbital, por lo que se los define como inestables. La inestabilidad hace que puedan unirse de forma no específica con otras moléculas. Los RL pueden formarse por absorción de la radia- ción ultravioleta o luz visible, por redox o por catálisis enzimática (Ferreira y Matsubara, 1997).
Estrés Oxidativo en la Producción in vitro de Embriones
Uno de los problemas básicos en los sistemas de PIVE es la elevada generación de ROS y el consecuente EO que experimentan los ovocitos (Soto-Heras y Paramio, 2020) que compromete su competencia para desarrollarse a blastocistos luego de la FIV (Ba- rros et al., 2019). Una razón fundamental para que esto ocurra es que la tensión de oxígeno en el oviducto de los mamíferos es entre 5 y 7 puntos porcentuales menor que la presente en el aire atmosférico, que es de alrededor de 20% (Amin et al., 2014; Ng et al., 2018). Los ovocitos están expuestos al aire ambiental durante la colecta, manipulación y maduración, lo cual altera la homeostasis oxidativa (Amin et al., 2014; Barros et al., 2019).
La exposición de embriones bovinos de 2-16 células a 20% de oxígeno redujo en más de 10% la producción de blastocistos en el día 7, disminuyó la criotolerancia y la expresión de Rnf2 (un factor de transcripción clave que regula muchos genes antioxidantes en células de mamíferos) y aumentó la producción de ROS en comparación a los expuestos a 5% de oxígeno (Amin et al., 2014). Otras fuentes potenciales de EO son los cambios de temperatura y exposición a la luz visible durante la manipulación de ovocitos en un laboratorio (Soto-Heras y Paramio, 2020). Asimismo, la remoción del ovocito del interior de folículo impide que los antioxidantes presentes el fluido folicular ejerzan su acción para conservar la homeostasis oxidativa (Soto-Heras y Paramio, 2020).
Sistema Antioxidante Celular
El organismo, ante el desequilibrio de la producción de los RL, presenta una estrate- gia para inhibir su formación o promover reacciones químicas para reducir la alta reactividad de estos compuestos a través de componentes antioxidantes, como las enzimas o los cofactores, obtenidos por la propia célula (fuente endógena) o a través de la dieta (fuente exógena). Los antioxidantes son sustancias que retrasan o impiden de manera sig- nificativa la oxidación de un sustrato oxidable (Sorg, 2004; Wang et al., 2013; Franco y Martínez-Pinilla, 2017). Los antioxidantes producidos por el cuerpo actúan enzimáticamente disminuyendo el exceso de RL a través de enzimas como la SOD, la catalasa (CAT) y la glutatión peroxidasa (GPx) y también de componentes no enzimáticos como el GSH, los péptidos de histidina, las proteínas ligadas al hierro (transferrina y ferritina), el ácido dihidrolipoico y la ubiquinona (CoQH2) (Biller y Takahashi, 2018). En algunos antioxidantes dietéticos como α-tocoferol (vi- tamina E), β-caroteno (pro-vitamina A), ácido ascórbico (vitamina C), micronutrientes (selenio) y compuestos fenólicos, como flavonoides y poliflavonoides se ha demostrado su efectividad en la protección celular contra los elementos oxidantes (Halliwell et al., 1995; Pietta, 2000; Albuquerque et al., 2017).
La SOD se encuentra en el citoplasma (Cu2+- SOD y Zn2+-SOD) y en las mitocondrias (Mn2+-SOD), y actúa sobre el O2•- transformándose en H2O2, evitando la acumulación de O2•-, que es altamente reactivo y perjudicial para la célula. El H2O2 producido puede ser eliminado por las catalasas, la GPx y las peroxidasas unidas a la tioredoxina, o puede ser liberado más adelante en el citoplasma de las células (Lambeth, 2004; Brand, 2010; Schieber y Chandel, 2014; Li et al., 2016). La CAT (derivada de las mitocondrias y los peroxisomas) cataliza la descomposición del H2O2 en H2O y O2, la que es producida en abundancia por los fagocitos, y mantiene el equilibrio ideal de la formación y eliminación de las ROS, esencial para el funcionamiento del sistema de defensa innato.
La modulación de la producción de CAT es importante para muchos procesos, como la proliferación, la diferenciación, la migración celular y la apoptosis (Underhill y Ozinsky, 2002; Oost et al., 2003; Malhotra y Kaufman, 2007; Veal et al., 2007; Zamocky et al., 2008; Wang et al., 2013). El H2O2 también puede ser neutralizado por la GPx citosólica o la mitocondrial en presencia de GSH. El GSH también contribuye a la eliminación de los componentes electrofílicos a través de la reacción con la glutatión-S- transferasa. El sistema antioxidante basado en el GSH actúa en presencia de selenio, que es un micronutriente muy importante (Kieliszek y Blazejak, 2013; Brigelius-Flohe y Maiorino, 2013). El GPx desempeña un papel importante en la prevención de la peroxidación de los lípidos, ya que elimina el H2O2 y, por consiguiente, protege las membranas del daño por peroxidación (Sies, 1986; Gaté et al., 1999; Oost et al., 2003; Scandalios, 2005; Monteiro et al., 2006).
El ácido ascórbico o la vitamina C nor- malmente aparece en el cuerpo en forma de ascorbato y es un excelente antioxidante in vivo, ya que puede ser oxidado por la mayoría de los RL en solución acuosa, y convertido en sustancias poco reactivas. La vitamina C actúa uniéndose a las ROS y restaurando la concentración de los RL a través de la donación de H+ (protones) en las membranas celulares actuando con la vitamina E, regenerándola después de la interacción con las ROS. La vitamina C también actúa como agente reductor, principalmente en metales de transición disminuyendo los iones de Fe y Cu que reaccionan con el H2O2 para formar el radical OH• (Buettner, 1993; Babior, 1997). La vitamina E, in vivo, es un potente inhibidor de la peroxidación lipídica. Actúa como un donador de H+ para el radical peroxil (ROO•), interrumpiendo la reacción en cadena de la formación de los RL. La donación del H+ lleva a la pérdida de la función de la vitamina E; sin embargo, esta puede ser regenerada con la vitamina C (Storey, 1996; Theriault et al., 1999; Monteiro et al., 2006). El selenio (Se) es un micronutriente esencial que forma parte integral de varias enzimas antioxidantes como la GPx, la yodotironina deyodinasa, la tiorredoxina reductasa y la selenofosfato sintetasa. Las Se-enzimas están incluidas en el sistema de defensa antioxidante (Hsu y Guo, 2002; Biller-Takahashi et al., 2015; Chien et al., 2003).
Los antioxidantes enzimáticos y no enzimáticos son esenciales para mantener el equilibrio entre la producción y la eliminación de los RL. Los antioxidantes son una defensa biológica importante contra el estrés oxidativo, participan en la desintoxicación de las células, y son muy importantes para comprender los efectos deletéreos de los RL (Bainy, 1996; Doyotte et al., 1997; Ahmad et al., 2000; Oruc et al., 2004).
Uso de Antioxidantes en la Producción in vitro de Embriones
Con el fin de reducir el estrés oxidativo que experimentan ovocitos y embriones durante la maduración ovocitaria y desarrollo embrionario in vitro se han probado numerosos antioxidantes, entre ellos quercetina, cisteamina, carnitina, vitamina C y resveratrol. Se obtuvo reducción (p<0.05) en ROS en los grupos de quercetina (27.5 ± 3.4), vitamina C (27.1 ± 3.0) y resveratrol (28.1 ± 4.7) comparado con cisteamina (34.9 ± 4.5), carnitina (34.6 ± 3.8) y control (sin antioxidante; 36.5 ± 5.2) (Sovernigo et al., 2017). Los niveles de GSH fueron mayores (p<0.05) en los gru- pos de ovocitos tratados con cisteamina (63.5 ± 5.5) y carnitina (60.8 ± 4.4) que en quercetina (52.7 ± 5.1), vitamina C (53.0 ± 3.8), y resveratrol (53.1 ± 4.4). Si bien la maduración nuclear, la tasa de clivaje y la de blastocistos eclosionados no varió entre grupos, el por- centaje de blastocistos fue mayor en los gru- pos tratados con antioxidantes (varió entre 52.1 y 54.2%) que en el grupo control (47.2 ± 2.7%, p<0.05) (Sovernigo et al., 2017).
An Q et al. (2019) encontraron que la suplementación del medio de maduración de ovocitos con melatonina redujo eficazmente el estrés oxidativo, disminuyó los niveles de apoptosis temprana, recuperó la integridad de las mitocondrias, mejoró el ensamblaje del huso y la alineación cromosómica en los ovocitos, mejorando además el desarrollo posterior de embriones clonados in vitro.
Otra sustancia, el anetol, compuesto orgánico derivado de la planta Croton zehntneri, fue usado en concentraciones de 30, 300 y 2000 µg/ml para evaluar su capacidad antioxidante durante la maduración de ovocitos bovinos, encontrando que el porcentaje de metafase II fue similar entre tratamientos, en tanto que la concentración de 300 µg mejoró significativamente la tasa de clivaje y de producción de embriones (Sá et al., 2019). Asimismo, estos autores encontraron que el anetol no redujo la producción de ROS, la concentración indicada incrementó los niveles del poder antioxidante reductor férrico y el potencial de la membrana mitocondrial, demostrando su capacidad para regular el balance de redox y mejorar la función mitocondrial en los ovocitos y embriones.
Por otra parte, Santos et al. (2019) evaluaron la capacidad antioxidante del aceite esencial de Syzygium aromaticum (EOSA) en cuatro concentraciones (0, 10, 15, 20 µg/ml) y la compararon con la cisteamina (100 µM) sin encontrar diferencia en la tasa de maduración ovocitaria ni en la reducción de los ROS. Sin embargo, los ovocitos tratados con 10 y 20 µg/ml de EOSA y con cisteamina tuvieron menor potencial de membrana mitocondrial que el grupo control, además de mejorar la producción de blastocistos y el número de blastómeros.
Cisteamina (CYS)
Características químicas
La CYS es una molécula simple de aminotiol que se utiliza para tratar la cistinosis nefropática (Elmonem et al., 2016). Esta molécula también es conocida como 2- aminoetanoetiol, thioetanolamina y compuesto 60-23-1, entre otros. Su peso molecular es de 77.15 g/mol y su fórmula química es HSCH CH NH. La CYS es una amina que se deriva de una etilamina y está compuesta por un esqueleto de etano sustituido por un grupo tiol en el C-1 y un grupo amino en el C- 2; es decir es una amina y un tiol (Figura 2) (National Center for Biotechnology Information, 2020). La CYS se encuentra en los tejidos del músculo, bazo y páncreas en el humano, incluso se ha detectado en la orina, y a nivel de célula se le encuentra principal- mente en el citoplasma participando en va- rias reacciones enzimáticas; es así que el ácido pantoténico y la CYS pueden biosintetizarse a partir de la panteteína mediante la acción de la enzima pantetheinasa (Cavallini et al., 1963). Además, la CYS puede convertirse en hipotaurina, lo que está mediado por la enzima 2-aminoetanotiol dioxigenasa (Emmet, 1958). En los seres humanos, la CYS participa en la vía de la biosíntesis del pantotenato y el CoA y en la vía del metabolismo de la taurina y la hipotaurina (Emmet, 1958; Cavallini et al., 1963; Hamilton et al., 1979; Morakinyo et al., 2012). En el Cuadro 1 se resumen las propiedades químicas de la cisteamina.
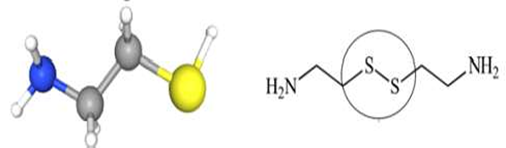
Figura 2 Estructura de la cisteamina. La fórmula química es HSCH2CH2NH2. Es una amina que se deriva de una etilamina y está compuesta por un esqueleto de etano sustituido por un grupo tiol (círculo) en el C-1 y un grupo amino en el C-2. Fuente. National Center for Biotechnology Information (2020).
Mecanismos de acción
El efecto antioxidante de la CYS se debe al grupo tiol de la molécula. Además, la CYS promueve el transporte de cisteína al interior de las células, favoreciendo la sínte- sis de glutatión. A través de su grupo tiol, la CYS elimina de la célula al O2•- y al H2O2, especialmente cuando está totalmente ionizado (Ulrich y Jacobs, 2019). La eliminación del protón del grupo sulfidrilo aumenta la reactividad del grupo tiol (Ulrich y Jacob, 2019). La oxidación de los grupos tiol de la CYS por el O2•- puede disminuir las defensas contra otros grupos de oxidantes y alterar el balance redox a un estado más oxidativo (Winterbourn y Metodieva, 1999). La CYS puede además inhibir la actividad de la transglutaminasa 2 (TG2) al formar un disulfuro mixto (Folk, 1980; Lorand y Conrad, 1984; Gentile y Cooper, 2004; Jeitner et al., 2018).
La TG2 ha sido asociada a varias enfermedades humanas incluyendo los procesos infecciosos y el estrés oxidativo (Szondy et al., 2017). La CYS también disminuye la lipoperoxidación intralisosomal relacionada con la arterioesclerosis A este respecto, la consiguiente acumulación de cistina en los lisosomas de todas las células del cuerpo conduce a disfunción progresiva de múltiples órganos por incremento del estrés oxidativo incluyendo al endotelio vascular. El aumento de la concentración lisosomal de cistina se asocia al aumento de la apoptosis celular y del estrés oxidativo, y con alteraciones del metabolismo del glutatión y ácido araquidónico (Levtchenko et al., 2005; Ariceta, 2015). La CYS reacciona con la cistina para formar el disulfuro mixto de cisteamina y cisteína, que puede salir del lisosoma a través del sistema de transporte de lisina/arginina (Jézégou et al., 2012), por ende, la extracción de la cistina por la CYS constituye un efecto indirecto antioxidante. Además, por efectos directos antioxidantes CYS puede prevenir la oxidación intralisosomal de las lipoproteínas de baja densidad (Ahmad y David, 2019) (Figura 3).
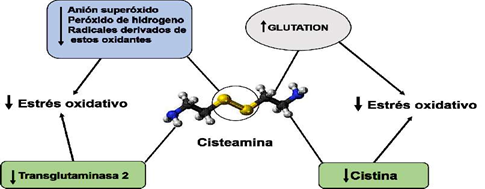
Figura 3 Mecanismos antioxidantes de la cisteamina. La cisteamina puede tener mecanismos de acción directos o indirectos para disminuir el estrés oxidativo. A través del grupo tiol (círculo) la cisteamina puede interactuar con el anión superóxido y el peróxido de hidrógeno disminuyendo sus efectos oxidantes y la concentración de los radicales oxidantes que se derivan de ellos. Por otro lado, puede inducir aumento en la concen- tración de glutatión que es un poderoso agente antioxidante. A través de efectos indi- rectos la cisteamina puede disminuir el estrés oxidativo inhibiendo compuestos como la transglutaminasa 2 y la cistina que están involucrados en el estrés oxidativo. Fuente: Adaptada de Cystamine 3D ball.png. (Wikimedia Commons)
Efecto en las células reproductivas
El uso de la CYS para mejorar las condiciones de las células de la reproducción de mamíferos se ha documentado. La CYS mejora la maduración in vitro de ovocitos por mecanismos mediados por el aumento del glutatión (GSH) intra ovocito y disminución de ROS (Zhenwei y Xianhua, 2019). De la misma manera, la suplementación con CYS del medio de cultivo para la maduración in vitro de ovocitos aumentó significativamente el nivel de GSH de los ovocitos de primates Macaca con cúmulos intactos y redujo la incidencia de la formación de fertilización anormal, efecto que no se observó en los ovocitos desnudos (Curnow et al., 2010).
También se ha demostrado que la adición de CYS en el medio de cultivo de ovocitos bovinos mejoró la fertilidad, la competencia en materia de desarrollo y la criotolerancia después de la vitrificación, probablemente debido al aumento de la síntesis de GSH durante el proceso de maduración in vitro (Oyamada y Fukui, 2004). Mahmoud et al. (2016) señalan que la CYS en el medio de maduración mejora la maduración nuclear de los ovocitos de búfalo, aunque no tuvo un efecto positivo en la criotolerancia durante la vitrificación. Estos resultados sugieren que el uso de la CYS mejora las condiciones de las células germinales de mamíferos. El mecanismo de acción sería posiblemente por su acción antioxidante al promover el incremento de un potente antioxidante como el GSH. También se ha demostrado su efecto benéfico en células reproductivas de pollos, donde disminuyó la peroxidación lipídica en espermatozoides mejorando la fertilidad (Thananurak et al., 2020). Por otro lado, se encontró que el tratamiento de macrófagos cultivados con CYS redujo la generación ce- lular de las ROS (Okamura et al., 2014).
Uso de la Cisteamina en la Producción in vitro de Embriones en Rumiantes
Se describen los efectos que tiene la CYS en la PIVE en bovinos, bubalinos, caprinos y ovinos. En el caso de bovinos se tienen cinco trabajos que fueron presentados en la Conferencia Anual de la Sociedad Internacional de Tecnología de Embriones en New Orleans, EEUU, 2019, cuyos resúme- nes se publicaron en la revista Reproduction, Fertility and Development. Como muestra la Figura 4, el interés sobre este tema en rumiantes ha ido aumentando y desde 2015 se han publicado 19 artículos, que representan el 33.3% de los encontrados y publicados en los últimos 27 años. Es importante señalar que el primer artículo publicado sobre el efecto de la CYS en la PIVE en bovinos fue publicado por Takahashi et al. (1993), y sus resultados son presentados más adelante en esta revisión.
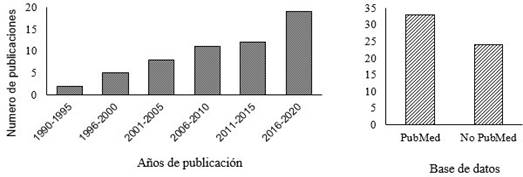
Figura 4 Artículos publicados sobre el efecto de la cisteamina en la producción in vitro de embriones en rumiantes. Fuente: base de datos PubMed y Google Scholar
Efectos de la cisteamina en la producción in vitro de embriones en bovinos
Adición en el medio de maduración
Algunos de los primeros artículos que demuestra el rol antioxidante de la CYS en la PIVE fueron publicados por de Matos et al. (1995, 1996, 2000, 2002) usando varios enfo- ques experimentales. La adición de 25 µM de CYS en la MIV fue suficiente para mejorar la producción de blastocistos, y tuvo un rendimiento de embriones similar a 50 y 100 µM. Asimismo, se encontró que la concentración de GSH, la tasa de clivaje y de blastocistos fue menor en los ovocitos cultivados con CYS y butionina sulfoximina (BSO) que solo con CYS y que la tasa eclosión de blastocistos luego de la criopreservación no varió entre el grupo CYS y el control (de Matos et al., 2002).
En otro estudio más reciente la suplementación de 50 µg mL-1 de CYS mejoró la tasa de maduración de ovocitos en comparación con niveles superiores (100 µg ml-1) o menores (0 µg ml-1) (Guo et al., 2009). Asimismo, la adición de B-mercaptoethanol, cisteína y cistina al medio de maduración incrementó significativamente la producción de GSH y de blastocistos en el día 7 con respecto al control, confirmando el efecto antioxidante de estos compuestos thiol (de Matos et al., 2000).
La adición de 0.5, 5, 50 y 500 µM de CYS no tuvo efecto en la tasa MIV ni de FIV, pero una concentración de 5 µM aumentó significativamente la producción de blastocistos con respecto al control (Geshi et al., 1999). Aparentemente, 500 µM de CYS en la MIV tuvo un efecto nocivo en los ovocitos porque, aunque generó el mayor contenido ovocitario de GSH y, por lo tanto, de actividad contra el estrés oxidativo, redujo por debajo del control la tasa de desarrollo de blastocistos (Geshi et al. 1999). En concordancia con este hallazgo, la adición de 10 mM CYS al medio de maduración redujo cerca de 6 y 10 veces las tasas de clivaje y de blastocistos, respectivamente, en comparación a concentraciones menores (0.1, 0.5, 1 mM) (Canel et al., 2015), y este efecto perjudicial se observó tanto en un ambiente bajo (5%) como alto (20%) de oxígeno (Canel et al., 2018).
No obstante, las evidencias del efecto beneficioso de la CYS, algunos estudios no encontraron mejoras en la tasa de fertilización y/o de clivaje (Kelly et al., 2005; Karadjole et al., 2006; Silva et al., 2010; Gottardi et al., 2012; Merton et al., 2013; Canel, 2015; Ranjbar et al., 2019), aunque hubo mejoras en la tasa de producción de blastocistos o en el número total de blastómeros (Karadjole et al., 2006; Balasubramanian y Rho, 2007; Merton et al., 2013; Anchordoquy et al., 2015; Quintanilla et al., 2015). Sin embargo, otros estudios no observaron efectos beneficiosos de la CYS en la producción de blastocistos o de blastocistos eclosionados cuando se adiciona en la MIV (Kelly et al., 2005; Silva et al., 2010; Adona et al., 2011; Gottardi et al., 2012; Canel et al., 2015; Ranjbar et al., 2019).
Figura 5 Blastocistos luego de la ICSI en el día 7 de cultivo in vitro. Cys 1 ICSI: los ovocitos fueron MIV con 1 mM Cys antes de la inyección de esperma. Cys 0.1 ICSI + co-cultivo: los ovocitos se MIV con Cys 0.1 mM y los espermatozoides se co-incubaron con COC durante e»3 h antes de la inyección de esperma. Cys 0.1 ICSI: los ovocitos fueron MIV con Cys 0.1 mM antes de la inyección de esperma (control). Cys 1 ICSI + co-cultivo: los ovocitos fueron MIV con Cys 1 mM y los espermatozoides se co-incubaron con COC durante e»3 h antes de la inyección de esperma. 40X (Tomado de Canel et al., 2018).
En otro interesante enfoque experimental, la adición de 100 µM de CYS al medio de maduración mitigó el efecto dañino del enfriamiento por 30 min a 0 °C de embriones de dos células (30-34 h pos-fertilización) con respecto a los no enfriados, en términos de porcentajes de blastocistos y número de blastómeras por embrión (Balasubramanian y Rho, 2007). Asimismo, la adición de CYS en la MIV de ovocitos que luego fueron vitrificados/calentados, fertilizados y los presuntos embriones cultivados, aparentemente les confirió algún tipo de crioprotección dado que se obtuvo una mayor proporción en el estadio de blastocisto en el día 8, en comparación a los vitrificados no suplementados con CYS (38.5 vs 5.0%, respectivamente; p<0.001) (Canel et al., 2015). Por el contrario, la presencia de CYS durante la maduración no mejoró la tasa de reexpansión y de eclosión de blastocistos derivados de ovocitos post mortem luego de la congelación y descongelación (Merton et al., 2013), ni afectó la tasa de preñez de hembras receptoras transferidas con embriones in vitro de ovocitos obtenido por OPU (Merton et al., 2013).
Merton et al. (2013) encontraron que si bien la tasa de clivaje de ovocitos derivados de matadero madurados con la adición de CYS fue similar al control (sin CYS), la de aquellos obtenidos mediante OPU fue significativamente mayor. Adicionalmente, la adición de CYS mejoró la producción de blastocistos en el día 7 en ambos grupos de ovocitos, con la particularidad que en los derivados de OPU se obtuvieron 1.6 veces más embriones transferibles si la CYS estuvo presente en la MIV. Por otro lado, aunque no se observaron efectos de la adición de CYS en MIV de ovocitos que fueron fecundados in vitro de forma convencional, los que maduraron con 1 mM de CYS y que fueron sujetos a inyección intracitoplasmática de espermatozoides (ICSI), previamente coincubados con COC por 3 h lograron desarrollarse a blastocisto en una proporción mayor que los no incubados con COC o que maduraron con mayores concentraciones de CYS (Canel et al., 2015; Figura 5).
Cuadro 2 Efectos de la cisteamina (50 M) en ausencia o presencia de butionina sulfoximida (BSO; 5 mM) y cistina (0.3 mM) durante la MIV sobre el desarrollo posterior del embrión (Gasparrini et al., 2003, 2006)
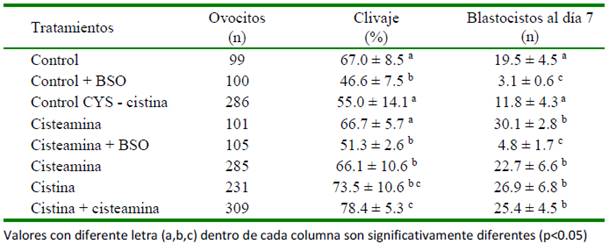
Cuadro 3 Efecto de dos antioxidantes en combinación con cisteamina (CYS) en la tasa de clivaje y producción de blastocistos (Fuente: 1El Shima et al., 2017 y 2El Sokary et al., 2017)
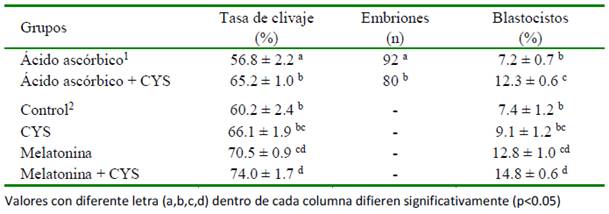
Cuadro 4 Efecto de la suplementación de cisteamina en el medio de maduración (100 M) y de cultivo (200 M) sobre la tasa de clivaje y subsecuente desarrollo embrionario (Modificado de De et al., 2011)
Recientemente, Chowdhury et al. (2020) incubaron COCs por 22 h con ARN secuenciador en presencia y ausencia de CYS, observando que 59 genes se expresaron diferencialmente en ambos grupos de ovocitos, donde el grupo tratado con CYS tenía 36 genes sobreregulados y 23 subregulados. El prime grupo de genes favorece un mayor desarrollo embrionario, mien- tras que los genes que se subregularon parecían afectarlo.
Adición en el medio de fecundación o de cultivo in vitro
Takahashi et al. (1993) compararon el efecto de dos compuestos thiol, CYS y B- mercaptoethanol (B-ME), los cuales fueron agregados al medio de cultivo en dos concentraciones (10 y 50 µM en ambos casos) luego que los embriones alcanzaron el estadio de 6-8 células, encontrando que las dos concentraciones de antioxidantes produjeron proporcionalmente más blastocistos y blastocistos expandidos que el grupo control. Asimismo, la concentración de 50 µM resultó en un mayor incremento de GSH en CYS que en B-ME y en el grupo control (p<0.01).
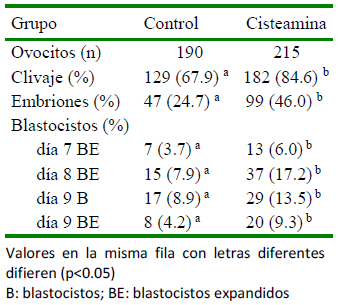
La adición de 100 µM de CYS al medio MIV y luego 0 (0/0; 100/0), 25 (100/25), 50 (100/50) y 100 (100/100) µM de CYS al medio CIV resultó en una tasa de desarrollo de blastocistos similar entre tratamientos, que luego mejoró significativamente en la tasa de eclosión de blastocistos en el grupo CYS 100/50 con respecto al control (0/0; p<0.005) (de Matos et al., 2002). La adición de CYS al medio de cultivo de embriones no incrementó el porcentaje de blastocistos ex- pandidos con respecto a adicionarlo únicamente en el medio de maduración (83.3 vs 72.7%; p>0.05) (de Matos et al., 2002), hallazgo que también fue observado por Merton et al. (2013). Por el contrario, Silva et al. (2010) observaron que la suplementación de 150 µM de CYS al medio FIV y CIV mejoró significativamente los porcentajes de blastocistos en el día 7 y de blastocistos eclosionados en el día 9, con respecto al con- trol (no CYS) o a los COC madurados en presencia de CYS.
Efectos de la cisteamina en la producción in vitro de embriones en bubalinos
Adición en el medio de maduración
Gasparrini et al. (2000, 2003, 2006) demostraron beneficio de adicionar CYS en la MIV de ovocitos de búfala. En un trabajo inicial probaron cuatro concentraciones de CYS (0, 50, 100 y 200 µM/l) sin encontrar mejoras en el porcentaje de clivaje con respecto al control, aunque la suplementación con 50 µM/l incrementó la proporción de mórulas compactas y blastocistos, y de blastocistos transferibles (Gasparrini et al., 2000). Luego, en ovocitos suplementados con CYS, BSO o CYS+BSO demostró que la presencia de CYS incrementó significativamente la concentración de GSH por ovocito con relación a los ovocitos inmaduros y a los madurados en comparación con los otros grupos (Gasparrini et al., 2003). Asimismo, al igual que en el estudio anterior, la adición de CYS al medio MIV no mejoró la tasa de clivaje, pero aumentó 1.5 veces el porcentaje de blastocistos en el día 7 (p<0.01; Gasparrini et al., 2003). Sin embargo, en un reporte posterior la CYS incrementó significativamente el porcentaje de clivaje con respecto al control, y la combinación de CYS y cistina potenció el efecto beneficioso sobre este parámetro, aunque no hubo diferencia significativa en la producción de blastocistos (Gasparrini et al., 2006; Cuadro 2).
La suplementación del medio de MIV con IGF-1 + CYS, IGF-1 + B-ME, EGF + CYS, EGF + B-ME no modificó la tasa de maduración con respecto al control (sin fac- tores de crecimiento y antioxidantes); sin embargo, IGF-1 + CYS incrementó la tasa de clivaje (71.9%) con respecto a los demás tratamientos (IGF-1 + B-ME: 45.2%; EGF + B-ME: 46.4%), pero no respecto al control (63.8%) y EGF + CYS (60.7%); asimismo, la tasa de blastocistos fue significativamente superior en los grupos tratados con IGF-1 + CYS o IGF-1 + B-ME que en los demás gru- pos (Singhal et al., 2009).
La incubación de ovocitos con 0 o 50 mM de CYS y posteriormente vitrificados/calentados mostró que los que fueron madurados con CYS experimentaron una tasa de maduración mayor que los no expuestos al antioxidante, aunque esta diferencia se desvaneció luego de la criopreservación y ambos grupos tuvieron igual proporción de ovocitos viables (Mahmoud et al., 2016). La misma concentración de CYS en el medio de MIV resultó en una mayor tasa de formación de GSH, de maduración, de penetración de espermatozoides y de formación de pronúcleos masculinos con respecto al grupo control, así como también formación de más mórulas compactas y de blastocistos (Ocampo y Ocampo, 2015).
El Cuadro 3 resume los resultados de dos publicaciones en las que se usan antioxidantes en la maduración de ovocitos bubalinos, donde la CYS potencia el efecto antioxidante de los otros compuestos (El Shima et al., 2017; El Sokary et al., 2017).
Adición en el medio de fecundación o de cultivo in vitro
La adición de CYS al medio de MIV (50 µM) y de CIV (100 µM) fue usada como estrategia experimental para evaluar su efecto sobre el daño en el ADN, y sobre la tasa de clivaje y de producción de blastocitos (Mukherjee et al., 2010). En comparación a los controles, la suplementación con CYS aumentó (p<0.01) la tasa de clivaje y la proporción de ovocitos que se desarrollaron hasta el estadio de 8-16 células. El daño de ADN fue menor de menor magnitud en el grupo CYS que en los controles de 8 a 16 (19.3 ± 4.24 vs 72.0 ± 5.22%), pero no en los embriones en estadio de dos células (11.7 ± 5.63 vs 20.8 ± 5.49%), ni en los ovocitos maduros (5.3 ± 3.43 vs 10.3 ± 4.73%).
En otro estudio se suplementaron los medios MIV o CIV con 0, 50, 100 o 200 µM de CYS. La adición de 50 µm de cisteamina en el medio MIV aumentó significativamente el porcentaje y la tasa de eclosión de blastocistos, pero no afectó la de clivaje ni el número de células por embrión (Anand et al., 2008). No obstante, una concentración de 200 µM redujo significativamente el rendimiento de los blastocistos, pero no en el número de células por embrión, tal como se observó en ovocitos bovinos tratados con altas concentraciones de CYS (Geshi et al., 1999; Canel et al., 2015). Por otro lado, la suplementación de medio MIV con 50 µm y de medio CIV con 100 µm de cisteamina aumentó al doble el porcentaje de blastocistos y de blastocisto que eclosionaron (p<0,01), pero no tuvieron efecto sobre la tasa de clivaje o el número de células por embrión (Anand et al., 2008). El efecto antioxidante de la CYS adicionada en el medio de MIV (50 µM) y CIV (100 µM) se confirmó mejorando la tasa de blastocistos y, además, porque incrementó la expresión de genes anti-apoptosis y disminuyó los que la promueven (Elamaran et al., 2012).
Efectos de la cisteamina en la producción in vitro de embriones en caprinos
Adición en el medio de maduración
Urdaneta et al. (2004), utilizando 400 mM de CYS en el medio de MIV y 1 nM de GSH en el medio de FIV observaron un incremento en el porcentaje de ovocitos que alcanzaron la MII comparado con los no suplementados (82.7 vs 53.6%, respectivamen- te). La CYS incrementó los porcentajes de ovocitos con pronúcleo, de ovocitos fertilizados y de embriones totales con respecto al control, y la adición de GSH al medio de FIV potenció el efecto de las CYS; no obstante, no hubo mejora en el porcentaje de blastocistos obtenidos. Por otro lado, Zhou et al. (2008) trabajaron con varias concentraciones de CYS en el medio MIV (0 a 500 mM), siendo la de 100 mM la más efectiva en la producción de blastocistos y número de células/blastocisto proveniente de ovocitos que maduraron con y sin células del cúmulo. En este sentido, De et al. (2011) utilizando también la concentración de CYS de 100 mM en el medio MIV de ovocitos caprinos incrementaron significativamente la tasa de clivaje, los porcentajes de embriones totales y los de blastocistos que eclosionaron a los 7, 8 y 9 días luego de la FIV.
Por otro lado, la concentración de 100 mM de CYS en el medio MIV, usada como control para evaluar le efectividad de la melatonina como antioxidante, mostró que fue tan efectiva como la melatonina, ya que la tasa de clivaje y la producción de blastocistos fue similar entre ambos grupos, y solo el número de células del trofoectodermo y de la masa celular de los blastocistos fue significativamente menor en CYS que en el grupo suplementado con melatonina (Soto- Heras et al., 2018). Asimismo, según An et al. (2018), la adición de 100 mM de CYS al medio MIV mejoró la tasa de fertilización y duplicó el porcentaje de blastocistos comparado con la no adición de CYS al medio de maduración.
Adición en el medio de fecundación o de cultivo in vitro
De et al. (2011) encontraron que la con- centración más efectiva de CYS adicionada al medio CIV obteniendo un porcentaje de clivaje no menos de nueve puntos porcentuales que en las otras concentraciones y el control (p<0.05), además de obtener una mayor proporción de ovocitos desarrollados hasta blastocistos luego de la FIV. En el Cuadro 4 se presentan los resultados sobre la PIVE luego de agregar 100 mM de CYS en el medio MIV y 200 mM en el CIV. No obstante, Kharche et al. (2016) no encontró un efecto benéfico en la tasa de clivaje ni en el desarrollo de mórulas o blastocistos al adicionar 100 mM de CYS al CIV con relación al control. De otra parte, la suplementación de 50 mM de CYS sola o combinada con IGF-1 duplicaron la proporción de blastocistos obtenidos (Goel et al., 2017).
Efectos de la cisteamina en la producción in vitro de embriones en ovinos
Adición en el medio de maduración
De Matos et al. (2002) probaron varias concentraciones de CYS en el medio MIV (0, 50, 100, 200 mM) de ovinos y observaron que, aunque el porcentaje de clivaje fue similar entre los grupos, la concentración de 200 mM fue más efectiva para mejorar el porcentaje de blastocistos en comparación con otras concentraciones de b-ME. Además, la concentración de GSH aumentó significativamente. Sin embargo, la maduración de ovocitos ovinos en otros medios (Fluido Oviductal Sintético, SOF y Charles Rosencrans, CR-1) con y sin CYS no modificó la tasa de clivaje (Enginler et al., 2015) ni la producción de blastocistos combinada o no con células oviductales (Enginler et al., 2016).
Al evaluar el efecto del factor de crecimiento epidérmico (EGF), el factor de crecimiento similar a la insulina I (IGF-I) y la cisteamina (CYS; 100 mM) en un medio de maduración definido (medio de cultivo bási- co + alcohol polivinílico), semidefinido (medio de cultivo básico + albúmina sérica bovina) e indefinido (medio de cultivo básico + suero fetal bovino) sobre la tasa de clivaje y la capacidad de desarrollo embrionario de ovocitos de oveja, pudo comprobarse que la adición de CYS al medio definido suplementado con EGF e IGF-I mejoró la formación de blastocistos en comparación con el medio sin CYS. Asimismo, la combinación de EGF + IGF-I + y CYS en el medio indefinido resultó en una mayor proporción de clivaje y mayor producción de mórulas y blastocistos que el medio definido + EGF + IGF-I + CYS o el medio semidefinido + EGF + IGF-I + CYS (Shabankareh y Zandi, 2010). En otro estudio, la adición de IGF-I + EGF al medio de maduración, con o sin CYS, aumentó la tasa de clivaje en comparación al control y los grupos de CYS + IGF-I, sin influenciar la tasa de blastocistos o de blastocistos que eclosionaron (Kelly et al., 2008). Sin embargo, aunque la CYS no mejoró la tasa de maduración respecto al control, y fue estadísticamente inferior al grupo que maduró con EGF (Sofi et al., 2011; Wani et al., 2012), el porcentaje de mórulas fue similar entre ambos tratamientos y significativamente mayor que el grupo que maduró sin CYS y EGF (Wani et al., 2012).
Cuadro 5 Efectos de diferentes concentraciones de cisteamina (CYS) sobre la producción de glutatión (GSH), y tasa de maduración, clivaje o blastocistos en rumiantes.
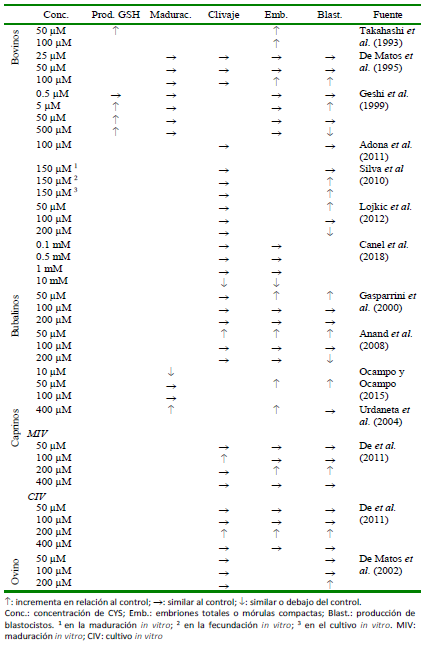
En el Cuadro 5 se presenta un resumen de las concentraciones de CYS más utilizadas y sus efectos en las tasas de maduración, clivaje, producción de embriones y de blastocistos.
CONCLUSIONES
Las evidencias documentadas en este trabajo demuestran que a través de distintos enfoques experimentales, la CYS tiene un potente efecto antioxidante indirecto, estimulando las síntesis de GSH por parte del ovocito. En algunos casos su presencia en el medio de maduración estimuló la tasa de maduración nuclear y la de clivaje, pero el efecto más evidente en la mayoría de los artículos revisados fue sobre la producción total de embriones y de blastocistos, que con mucha frecuencia superó significativa- mente la del grupo no suplementado con CYS. En los bovinos, 100 mM en el medio de maduración parece ser una concentración efectiva, seguido de con- centraciones de 5 y 50 mM.
Concentraciones más altas (200, 500 mM) en los bovinos y bubalinos parecen tener un efecto adverso sobre la maduración ovocitaria y desarrollo embrionario.
En pequeños rumiantes, concentraciones de 100 y 200 mM fueron efectivas para mejorar la producción de embriones comparado con el control, aunque hay estudios que no obtuvieron mejora alguna.
Se comprobó que la CYS actúa en forma sinérgica con factores de crecimiento y que fue tan efectiva como otros antioxidantes para incrementar la produc ción de embriones.












 uBio
uBio