INTRODUCCIÓN
La acuicultura es una actividad amplia mente diversificada y difundida en el mundo. Consiste en el cultivo mediante diferentes sistemas y técnicas de vegetales y animales acuáticos destinados al consumo humano, a los acuarios y también al poblamiento y repoblamiento de especies nativas en los cuerpos de agua con fines comerciales (pesquero o deportivo) o ambientales (Gómez et al., 1997; Luchini, 1998). La intensificación de los cultivos para obtener grandes volúmenes de producción conlleva a establecer un ambiente estresante para los organismos. Las altas densidades de población, la mala calidad nutricional y del medio acuático y la falta de medidas de bioseguridad se encuentran entre los principales problemas de la acuicultura (Rot y Yanong, 2003; Zamhariand y Yong, 2017; Choi et al., 2019). Estas condiciones favorecen la inmunosupresión de los organismos acuáticos, lo que incrementa la propagación de infecciones bacterianas, parasitarias, fúngicas y virales (Harikrishnan et al., 2010; Valladão et al., 2015). Las enfermedades infecciosas son el problema más grave para la industria de la acuicultura, generando grandes pérdidas económicas (Udomkusonsri et al., 2007; Bulfon et al., 2013; Zamhariand y Yong, 2017). Entre estas, uno de los principales factores responsables de la mortalidad de las especies cultiva- das es la infección fúngica (Meyer, 1991; Chukanhom et al., 2005; Emara et al., 2020), las cuales demandan un tratamiento largo y costoso (Prieto et al., 2005).
Esta susceptibilidad de organismos acuáticos que se encuentran en sistemas productivos, principalmente en pisciculturas, determinó que se utilicen antimicrobianos, antifúngicos y desinfectantes, ya sea en el alimento balanceado, en forma de baños o en las instalaciones, para la prevención y el tratamiento de las enfermedades. No obstante, la utilización de muchas de estas sustancias conduce a generar resistencia de los agentes patógenos o a acumular residuos en los tejidos de los peces o en el ambiente (Cabello, 2006; Seyfried et al., 2010; Reverter et al., 2017). Esta situación, junto con la necesidad de métodos de control de enfermedades en acuicultura llevó a los productores e investigadores a buscar otras formas de terapia que fueran más rentables y compatibles con el medio ambiente. De este modo, las plantas medicinales surgen como una alternativa por su comprobada acción ante enfermedades de diversa etiología. Por esta razón, en esta revisión se compila y discute la bibliografía existente sobre las enfermedades fúngicas más comunes en los peces, anfibios y crustáceos, se enfatiza en las que afectan a las ovas de los organismos en cultivo y se analizan los antimicóticos naturales utilizados in vitro e in vivo en acuicultura.
ENFERMEDADES MICÓTICAS EN ACUICULTURA
Entre los organismos que causan las llamadas micosis en acuicultura se encuentran los Hyphomycetes, Oomycetes y Mesomycetozoea. En los últimos años, con el advenimiento de la biología molecular, muchos de estos grupos han cambiado de posición taxonómica y actualmente solo los Hyphomycetes pertenecen al reino Fungi. Los Oomycetes fueron considerados protistas, luego fueron tratados como pseudohongos e incorporados al Reino Chromista (Kirk et al., 2001). En la actualidad conforman el Reino Straminipila por la naturaleza de la pared y de sus flagelos, además, de las diferencias a nivel de las organelas y las diferentes vías metabólicas de síntesis (Dick, 2001; Choi et al., 2019). Los Mesomycetozoea también son considerados un phylum de protistas que se halla filogenéticamente cercano al punto de divergencia entre animales y hongos (Ragan et al., 1996; Mendoza et al., 2002).
Hyphomycetes (Fungi imperfecti)
Los hifomicetes son un grupo de hongos anamorfos (forma asexual) ( Rot y Yanong, 2003) que se caracterizan por formar micelio estéril o micelio con conidióforos en los que se producen conidios (esporas que se desarrollan en la reproducción asexual) (Ramaiah, 2006). Los más frecuentes e importantes en acuicultura se describen en el Cuadro 1. Además, se han hallado:
Candida albicans (C.P. Robin) Berkhout 1923 en adultos y alevines de varias especies, han sido aisladas del contenido intestinal, riñón caudal y del alimento (Noga, 2010).
Lecythophora mutabilis (J.F.H. Beyma) W. Gams & McGinnis fue observada por Dykstra et al. (2001) en peces zebra (Danio rerio [Hamilton]) de laboratorio. La mortalidad fue alta y los hongos emergían por la boca, el poro anal y el opérculo.
Penicillium corylophilum (Dierckx) y Cladosporium sphaerospermum Penz fueron aislados del riñón caudal y la ve- jiga natatoria de Lutjnus campechanus (Poey) capturados en la naturaleza (Arkush et al., 2003). Los peces afectados presentaron distención de la vejiga natatoria e infiltración fúngica significativa en los riñones caudales (Rot y Yanong, 2003).
Especies de Paecilomyces sp (Bainier) se han aislado de especies de tilapia silvestres y cultivadas. Los peces presentaban erosiones en las aletas con hemorragias externas, y granulomas en las vísceras (Rand et al., 2000).
La infección por hifomicetes, al igual que con otras infecciones fúngicas, se suelen iniciar por desequilibrios nutricionales, alimentos contaminados, hacinamiento y cambios en la temperatura del agua (Rot y Yanong, 2003).
Oomycetes
Las infecciones producidas por oomicetes se encuentran en todo el mundo y afectan a los organismos acuáticos en todos los estadios de su ciclo de vida (Reynolds, 1988; Hussein et al., 2001; Johnson et al., 2002; Rot y Yanong, 2003; Bertan et al., 2019). Su incidencia suele ser mayor en la etapa embrionaria y pueden ocasionar una mortalidad del 80 al 100% (Rahman et al., 2017). Se denominan comúnmente mohos acuáticos, ya que son componentes comunes de la biota acuática que se alimentan de materia orgánica en descomposición (Peyghan et al., 2019). En general, se les considera invasores secundarios o patógenos oportunistas que atacan al huésped cuando la integridad de las barre- ras externas se ve alterada (Choudhury et al., 2005; Pacheco Marino et al., 2009).
La enfermedad causada por este grupo de microorganismos se denomina comúnmente saprolegniosis. Con este término se incluye a infecciones causadas por varios géneros del orden Saprolegniales ( Rot y Yanong, 2003; Chukanhom y Hatai, 2004; Caruana et al., 2012; Singh et al., 2013; Emara et al., 2020).
Dentro de los oomicetes se han registrado miembros de los géneros Saprolegnia sp (Nees), Achlya sp (Ness), Aphanomyces sp de Bary, Calyptralegnia Coker, Dictyuchus sp Leitgeb, Thraustotheca sp Humph- rey, Leptolegnia sp de Bary, Pythiopsis sp de Bary, Leptomitus sp C. Agardh y Branchiomyces sp (Plehn) como causantes de infecciones en condiciones naturales, de cautiverio o inducidas experimentalmente (Choudhury et al., 2005; Ramaiah, 2006; Pacheco Marino et al., 2009; Choi et al., 2019). Solo Saprolegnia sp, Achlya sp, Aphanomyces sp y Branchiomyces sp adquieren relevancia como patógenos en acuicultura (Cuadros 2 y 3).
Mesomycetozoea
La mayoría de las especies de los mesomicetozoos se encuentran en ambientes acuáticos, tanto de agua dulce como marinos (Glockling et al., 2013). Muchos de ellos son parásitos de invertebrados, peces, anfibios, aves y mamíferos (Mendoza et al., 2002; Glockling et al., 2013). En las últimas décadas ha preocupado la alta mortalidad que provocan en peces y en las poblaciones de ranas (Pascolini et al., 2003; Gozlan et al., 2005, 2009; Pereira et al., 2005; Di Rosa et al., 2007; Andreou et al., 2012; Plaul et al., 2018).
En este phylum se encuentran tres géneros importantes en acuicultura: Ichthyophonus sp (Plehn & Mulsow), Dermocystidium sp (Pérez) y Sphaerotheceum sp (Frieder). Las especies de estos géneros presentan diferentes morfologías y ciclos de vida (Mendoza et al., 2002) (Cuadros 4).
INFECCIONES FÚNGICAS FRECUENTES EN OVAS
Los procedimientos de manejo que se realizan durante las etapas de incubación, cría y engorde en acuicultura son importantes para el rendimiento final del producto (Hussein et al., 2001). Una de las etapas cruciales en las granjas es la incubación, dado que en esta etapa suele haber un alto grado de mortalidad.
Saprolegniosis
La saprolegniosis en ovas es una infección bastante común durante las primeras etapas del desarrollo embrionario de peces y anfibios (Noga, 2010; Hussein y Hatai, 2002; Ruthig y Provost-Javier, 2012; van Den Berg et al., 2013; Huang et al., 2015). La enfermedad causa un alto porcentaje de mortalidad en las granjas de cultivo de especies de agua dulce y salobre (Rot y Yanong, 2003; Alsafah y Al-Faragi, 2017). Las ovas son muy susceptibles durante la incubación debido a la calidad del agua, la manipulación y a la alta densidad de huevos (Moreira y Barata, 2005). La invasión fúngica es promovida por las ovas no fertilizadas o dañadas que actúan como medio de asentamiento y crecimiento de las zoosporas, lo que resulta en la colonización y propagación de la infección a ovas viables cercanas (Meyer, 1991; Bruno y Wood, 1999). La infección afecta al corion y, por lo tanto, al intercambio de gases, provocando la muerte de los embriones (Rot y Yanong, 2003). Para el control de la infección se requiere la eliminación regular de las ovas infestadas (Ñahuincopa Vergara, 2017).
La saprolegniosis suele ser causada por especies de los géneros Saprolegnia y Achlya (Czeczuga y Woronowicz 1993; Czeczuga et al., 1995; Kitancharoen y Hatai, 1998). Se han identificado varias especies que afectan a las ovas con un alto nivel de patogenicidad: S. diclina, A. klebsiana y Allomyces arbuscula (EJ Butler) (Chukanhom y Hatai, 2004), S. parasitica (Singh et al., 2013), A. americana (Sati, 1991; Mastan, 2015) y A. bisexualis (Panchai et al., 2014).
Fusariosis
Dos especies fúngicas, F. semitectum y F. solani exhiben capacidad infectiva en ensayos realizados in vitro en ovas del pejerrey O. bonaerensis. Las observaciones microscópicas revelaron la presencia de micelio en la periferia de las ovas aunque no se observó colonización del tejido embrionario. La infección se produjo en el corion, lo que provocó la mortalidad de los embriones (Pacheco Marino et al., 2011).
ANTIMICÓTICOS UTILIZADOS ENACUICULTURA
Se han estudiado diversos productos químicos para la profilaxis, desinfección y control de las micosis, sobre todo las causadas por saprolegniales (Prabhuji et al., 1983). Los más utilizados han sido el verde de malaquita, formalina, peróxido de hidrógeno, sulfato de cobre, permanganato de potasio, cloruro de sodio, yodo y ácido acético (Ñahuincopa Vergara, 2017).
El verde malaquita es el fungicida de mayor eficacia para el tratamiento de las micosis, debido a que inhibe la germinación de las zoosporas y el crecimiento de las hifas (Ñahuincopa Vergara, 2017). Sin embargo, el uso de este compuesto se encuentra limitado e incluso prohibido en muchos países desde 2002 (Emara et al., 2020) por algunos efectos secundarios como toxicidad (Pirbalouti et al., 2009; Huang et al., 2015; Ñahuincopa Vergara, 2017), presencia de residuos con actividad cancerígena (e.g. leucomalaquita) que pueden persistir en los tejidos de los organismos acuáticos durante mucho tiempo (Culp et al., 1999; Borisutpeth et al., 2014; Huang et al., 2015), persistencia en el medio ambiente (Pirbalouti et al., 2009) e impacto agudo en los ecosistemas acuáticos (Schreier et al., 1996), efecto inmunosu- presor en peces tratados repetidamente (Prost y Sopinska, 1989) y efectos teratogénicos o mutagénicos (Culp et al., 1999; Chukanhom et al., 2005; Borisutpeth et al., 2014; Alsafah y Al-Faragi, 2017).
El formaldehído y la formalina fueron aprobados por la Food and Drug Administration (FDA) del gobierno de los Estados Unidos como oomiceticidas, pero debido a los efectos y persistencia en el medio ambiente su uso está prohibido para la práctica de la acuicultura (Pirbalouti et al., 2009). Además, son potencialmente perjudiciales para la salud de los trabajadores (Alsafah y Al-Faragi, 2017).
Las formulaciones de peróxido de hidrógeno, ácido acético, povidona yodada, bronopol (Pyceze®) y ozono han sido efectivos para controlar la saprolegniosis, pero solo a altas concentraciones, lo que los hace imprácticos (Gieseker et al., 2006; Oono et al., 2008; Fuangsawat et al., 2011). Además, el peróxido de hidrógeno cuando se halla con- centrado es cáustico, pudiendo provocar daño tisular local (Burka et al., 1997; Kitancharoen et al., 1997).
En las pisciculturas, los baños de sal son tratamientos muy usados de manera preventiva y para infestaciones superficiales. Su desventaja radica en que los cristales decantan en el fondo de los estanques y no entran en contacto con los peces.
Para inhibir el crecimiento de saprolegniales se han realizado ensayos con herbicidas, entre ellos el Diquat, que resultó eficaz en los huevos de trucha arco iris infectados con Saprolegnia sp (Schreck et al., 1991).
Las sustancias probadas in vitro como permanganato de potasio (Sherif y Abdel- Hakim, 2016), hipoclorito de sodio (Khomvilai et al., 2005), dióxido de cloro (Prasatporn et al., 2010), quitosano (Min et al., 1994) y la fibra de cobre (Miura et al., 2005) resultaron eficaces. Otras alternativas fueron ácido peracético (Marchand et al., 2012; Straus et al., 2012a,b), D-glucanos (Kiseleva et al., 2014), sustancias húmicas (Meinelt et al., 2007) e irradiación al agua que ingresa a los estanques con altas dosis de rayos UV (Ben Khemis et al., 2016).
Dado el escaso conocimiento de las condiciones sanitarias de los organismos que se cultivan en acuicultura, los piscicultores consideran la quimioterapia como la única solución contra las enfermedades de los peces. Esto puede provocar el uso indiscriminado de compuestos quimioterapéuticos para prevenir las enfermedades, bioacumulación de residuos en el medio ambiente y en los organismos acuáticos e inducir resistencia del patógeno (Sarter et al., 2007). Como consecuencia de estas actividades, se requiere utilizar una dosis más alta o desarrollar nuevos productos químicos para reemplazar aquellos a los que los hongos son resistentes (Ilondu et al., 2010).
Por ello, dadas las prohibiciones de algunos productos químicos y la poca practicidad de otros, es fundamental la búsqueda de nuevos antimicóticos de origen natural que no tengan efectos nocivos en los organismos, en sus huevos, en la salud humana ni en los ecosistemas (Chakroff, 1983; Hussein et al., 2002; Fuangsawat et al., 2011; Ñahuincopa Vergara, 2017). Las dos ramas de la investigación que surgen para controlar la infección por hongos es el control biológico y los extractos de plantas (Hussein et al., 2001; Hussein y Hatai, 2002; Chukanhom et al. 2005).
ACTIVIDAD BIOLÓGICA DE LAS PLANTAS
Las plantas vasculares poseen numerosos metabolitos o compuestos químicos en sus tejidos que cumplen diversas funciones a lo largo de la vida. Los metabolitos primarios son estrictamente necesarios para poder crecer y desarrollarse adecuadamente. Los metabolitos secundarios mejoran la calidad de vida del organismo. Entre estos últimos se pueden mencionar las fitohormonas, los compuestos aromáticos, los fito-esteroles y varios compuestos químicos beneficiosos para la supervivencia, como por ejemplo, los alcaloides, flavonoides o cumarinas (Ávalos García y Pérez-Urria Carril, 2009). Los aceites esenciales, son metabolitos secundarios que se encuentran en numerosas plantas, sobre todo en las de ambientes mediterráneos con altas amplitudes térmicas, poseen un efecto tampón sobre la temperatura, y además poseen una función antifúngica y antibacteriana. Actualmente, los aceites esenciales son reconocidos como principios activos, o sea, sustancias químicas o mezcla de sustancias con un efecto farmacológico específico utilizados en medicina humana (Farmacopea Argentina, 2013).
El ser humano desde sus orígenes ha utilizado diversas especies de plantas como «plantas medicinales». Algunas de ellas poseen efectos sobre los sistemas digestivo, circulatorio y respiratorio, otras ayudan a frenar el ataque de diversos patógenos y enfermedades infecciosas al presentar efectos antiparasitario, insecticida, fungicida y/o bactericida. Según datos de la Organización Mundial de la Salud (OMS), el 80% de la población mundial recurre a la medicina tradicional para atender sus necesidades primarias de asistencia médica. Dichas terapias se basan principalmente en el consumo directo de plantas, por lo que su estudio es un objetivo prioritario para numerosas instituciones internacionales y declarado de interés por la OMS en 1987 (Pochettino, 2015).
Un claro ejemplo de estos metabolitos secundarios, muy utilizado en la actualidad, es el eugenol, un aceite esencial que producen los pimpollos del árbol del clavo Syzygium aromaticum (L) Merr. & Perry, que tiene propiedades insecticidas y fungicidas, además de analgésicas. En algunos países se le utiliza como droga oficial en la práctica de la odontología (Bruneton et al., 1991). También es utilizada en acuicultura como anestésico de peces (García-Gómez et al., 2002; Silveira, 2006; Plaul et al., 2018).
La quinina es un alcaloide extraído de la corteza del árbol de la quina, Cinchona officinalis L, muy usado para el tratamiento de la malaria (Cóndor Cuyubamba et al., 2009), y el ascaridol, un antiparasitario, que se encuentra en tallos y hojas de paico Dysphania ambrosioides (L) Mosyakin & Clemans (Estrada-Cely et al., 2012). En el caso de los compuestos activos antifúngicos que han sido utilizados en acuicultura se puede mencionar al aceite esencial tymol, obtenido de hojas y flores de tomillo, Thymus vulgaris L. Šegviæ Klariæ et al. (2007) y Gormez y Diler (2014) han demostrado un efecto inhibidor sobre Saprolegnia parasitica Than. El carvacrol, obtenido de las hojas de orégano, Origanum vulgare L y de otras especies, presentó resultados efectivos sobre S. parasitica (Perrucci et al., 1995; Tampieri et al., 2003; Gormez y Diler, 2014). Compuestos como magnoliol y honokiol, obtenidos del árbol de magnolia, Magnolia officinalis Rehder & EH Wilson dieron resultados in vitro altamente positivos al inhibir el crecimiento de S. parasitica (Hu et al., 2019).
Otro compuesto, tymoquinona, extraído de la planta Nigella sativa L, resultó efectivo contra Saprolegnia sp, pero altamente tóxico para algunas especies de peces como los salmónidos (Hussein et al., 2002; Mostafa et al., 2020). Estudios realizados por Aly y Mohamed (2010) y Caruana et al. (2012) en Echinacea purpurea (L) Moench demostraron efectos inmunoestimulantes y antifúngicos en peces de acuario. Yao et al. (2017) aislaron los compuestos reina y aloe- emodina de Rheum palmatum L, una tradicional hierba medicinal china, con actividad antifúngica in vitro contra Saprolegnia sp. Así mismo, el azufre presente en las moléculas de la fracción liposoluble (aleína) e hidrosoluble (alicina) de Allium sativum L fresco resultó altamente efectivo contra S. parasitica (Auró y Ocampo, 2003).
Los posibles mecanismos de acción de estos componentes activos podrían ser la de- gradación de la pared celular o el daño en las proteínas de la membrana citoplasmática, con la consecuente pérdida de contenido celular (Burt, 2004).
PLANTAS DE USO FRECUENTE COMO ANTIMICÓTICOS
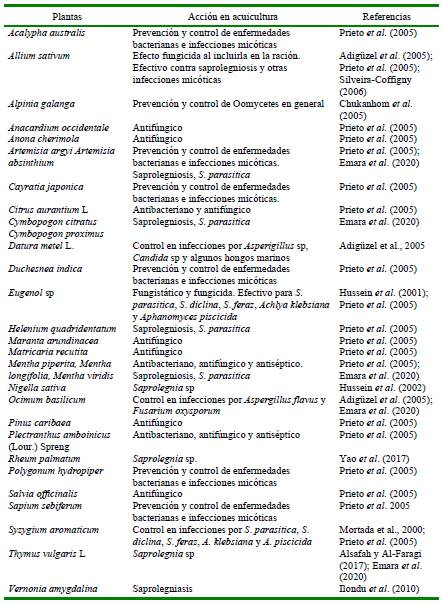
En las últimas décadas, varios ensayos demostraron que en acuicultura, los extractos de plantas podrían ser eficaces contra las infecciones fúngicas (Cuadro 5) (Hussein et al., 2002; Mortada et al., 2000; Adigüzel et al., 2005; Chukanhom et al., 2005; Prieto et al., 2005; Silveira-Coffigny, 2006; Ilondu et al., 2010; Alsafah y Al-Faragi, 2017; Yao et al., 2017; Emara et al., 2020).
Durante la aplicación de los extractos se debe identificar la concentración máxima de estos compuestos naturales que los organismos en las diferentes etapas de su ciclo de vida pueden tolerar sin sufrir efectos adversos. Para el tratamiento de las ovas, es importante evaluar la toxicidad y el efecto que estos compuestos producen en la tasa de eclosión y durante el desarrollo de las larvas (Caruana et al., 2012).
Varios investigadores han evaluado la eficacia de los productos naturales como agentes fungicidas en ovas de peces en sistemas de acuicultura (Tampieri et al., 2003; Chukanhom et al., 2005; Khosravi et al., 2012; Li y Liu, 2015; Zeng et al., 2019). Los aceites esenciales de Aegle sp (L) Corréa, Ageratum sp L non Mill, Cymbopogon nardus (L) Rendile, Cymbopogon citratus (DC) Stapf, Cymbopogon martinii (Roxb.) W Watson, Eucalyptus sp L’Hér, Geranium sp L, Citrus x sinensis Osbeck, Pogostemon cablin Benth, Mentha sp L, Allium sp L, Syzigium aromaticum (L) Merr. & Perry, Rheum sp L, Juglans regia L, Litsea cubeba (Lour.) Pers., Scutellaria L y Sophora flavescens Aiton resultaron eficaces contra cepas fúngicas, principalmente en especies de Saprolegnia sp aisladas en ovas de peces (Pattnaik et al., 1996; Keene et al., 1998; Ñahuincopa Vergara, 2017; Zeng et al., 2019). Incluso han salido al mercado productos basados en aceites esenciales: Saprofin®, probado en ovas fertilizadas infectadas con Saprolegnia sp, contiene una mezcla de Schinus sp L, Cryptocarya alba (Molina) Looser y Eucalyptus dives Schauer; S-7 Shui Mei Jing y F-9 Shui Mei Jing, ambos a base de Sophora flavescens Aiton y Rumicis aquatici L, comercializados para el control de la saprolegniosis en camarón y la desinfección de larvas el primero y el control de saprolegniosis en peces y sus ovas el segundo (Prieto et al., 2005).
Khosravi et al. (2012) demostraron tanto in vitro como in vivo que los aceites esenciales de Zataria multiflora Boiss. Diagn. Pl. Orient, Geranium sp L, y Eucalyptus camaldulensis Dehnh poseen propiedades fungistáticas contra S. parasitica en ovas de trucha arcoíris Oncorhynchus mykiss Walbaum. Cao et al. (2014) controlaron mediante el extracto de las raíces de Sanguisorba sp L la infección provocada por Saprolegnia australis Elliot durante la incubación de peces.
Los estudios realizados sobre la tasa de supervivencia de las ovas y eclosión arrojaron resultados positivos mediante uso de extracto de Eucalyptus sp en ovas de Rutilus frisii Nordmann (Najafi y Zamini, 2013), de Allium sativum L y Artemisia sieberi Besser durante las etapas de eclosión y larva de O. mykiss (Amani Denji et al., 2020). Hallazgos similares en ovas de trucha arcoíris fueron realizados por Mousavi et al. (2009) con una combinación de aceites esenciales de Thymus vulgaris L, Salvia officinalis L, Eucalyptus globulus Labill y Mentha piperita L. Los extractos de Eucalyptus sp, T. vulgaris y Geranium sp tuvieron efectos positivos sobre la tasa de supervivencia de las larvas de trucha arcoíris (Sharif-Rohani et al., 2006).
Si bien los trabajos mencionados evaluaron los efectos de los aceites naturales, estos pueden variar de acuerdo con las características de cada zona. La cantidad y calidad de los principios activos de las plantas dependen de varios factores, entre ellos el lugar de cultivo, el clima, la edad, la forma de extracción y la época de cosecha (Prieto et al., 2005).
VENTAJAS Y DESVENTAJAS DE LOS EXTRACTOS NATURALES
La fitoterapia surge como una alternativa efectiva para el control de las enfermedades e infecciones en acuicultura (Valladão et al., 2015; Reverter et al., 2017). La ventaja de los productos naturales es la baja toxicidad en las dosis adecuadas; que son biodegradables y sin efectos adversos para el medio ambiente; la fácil disponibilidad, la cual puede adecuarse para cada región y, por lo tanto, un menor costo económico de las materias primas. Presentan un amplio margen de seguridad y una gran eficacia en el cultivo de organismos acuáticos. Además, pueden administrarse de diferentes formas; es decir, durante la ingesta, de manera inyectable o diluirse directamente en el agua.
En acuicultura, las plantas y sus extractos son utilizadas por los productores, principalmente orientales, desde hace muchos años. En occidente, la fitoterapia comenzó a practicarse en los últimos años, pero todavía hay mucho desconocimiento por parte de los productores. Los estudios sobre los impactos negativos que puedan tener estas sustancias en los cultivos de organismos acuáticos aún son escasos. Es necesario establecer el modo de acción de los principios activos de las plantas y la manera más adecuada para una administración eficaz y segura. La mayoría de las plantas utilizadas en fitomedicina son terrestres, por lo tanto, resulta primordial conocer si algunas de ellas causan efectos indeseables y/o toxicidad en los organismos acuáticos.
PERSPECTIVA / CONCLUSIÓN
En esta revisión se han compilado las enfermedades fúngicas más frecuentes en los organismos acuáticos y los estudios realizados en fitomedicina para evaluar la eficacia de los productos naturales como agentes fungicidas en ovas. La utilización de la fitoterapia presenta un potencial prometedor en acuicultura como sustituto de la quimioterapia, pero todavía queda un largo camino por recorrer. Es necesario realizar estudios más específicos de los principios activos, determinar las dosis mínimas y las dosis letales, conocer las especies a las que se les aplicará la terapia y su susceptibilidad. Además, es necesario establecer la duración de la dosis para que sea efectiva y el modo de administración adecuado para cada organismo. Por otro lado, es importante establecer los principios activos que pudiesen ser tóxicos tanto para los animales acuáticos como nocivos para el consumo humano.
Por todo lo dicho, la investigación y el mejoramiento de las terapias a base de plantas en la salud de los organismos acuáticos es un desafío conjunto entre médicos veterinarios, biólogos, piscicultores y servicios de extensión de la acuicultura.












 uBio
uBio