INTRODUCCIÓN
El avance científico en el mejoramiento genético de cuyes (Chauca, 2007; Rubio, 2018) y en la nutrición (Sánchez-Silva et al., 2014; Cano et al., 2016; Paredes y Goicochea, 2021) está conllevando a que los animales intensifiquen sus procesos metabólicos y alcancen mayores pesos al mercado (Camino e Hidalgo, 2014), lo cual implica mayores de- safíos al tracto gastrointestinal.
Al aplicar un destete precoz, los animales son expuestos a una serie de factores estresores ambientales que impactan sobre la estructura y función del intestino (Yin et al., 2014), generando cambios a nivel morfológico y fisiológico en el intestino que conllevan a alterar el consumo de alimento y el proceso digestivo (Boudry et al., 2004). En ese proceso, la estructura intestinal sufre el acortamiento y fusión de vellosidades, propiciando disminución de la superficie de digestión y absorción de nutrientes (Reis de Souza et al., 2012; Pluske et al., 2018). Por el contrario, cuando la afectación es menor, tanto el número de células como el tamaño de las vellosidades serán mayores; en consecuencia, el área disponible para la digestión y para la absorción, también será mayor (Dibner y Richards, 2004).
En especies de crecimiento rápido como el cerdo, la falta de consumo de alimento sólido durante la lactancia conlleva a bajo consumo de alimento luego del destete, de manera que los animales no cubren sus requerimientos de proteína y energía, dificultando su crecimiento inicial (Choudhury et al., 2021). En este sentido, es práctica común el uso de aditivos en la dieta para mantener la integridad intestinal de los animales jóvenes y obtener mejores resultados productivos, entre ellos está la glutamina (Sakamoto et al., 2011; Teixeira et al., 2014)
La glutamina y el ácido glutámico son clasificados como aminoácidos no esenciales en los mamíferos (Wu et al., 2013). La glutamina se encuentra en la leche materna y luego de ser absorbida por los enterocitos del intestino delgado, se convierte en la principal fuente energética para la división celu- lar (Yi et al., 2005; Watford, 2008). En cerdos se ha demostrado que previene los daños en la estructura de la mucosa intestinal, manteniendo su integridad (Janeczko et al., 2007; Cabrera et al., 2013) y mejorando el desempeño productivo de los lechones (Zou et al., 2006; Marcussi et al., 2014) y de conejos (Chamorro et al., 2009). Asimismo, se reporta similar respuesta de la mucosa intestinal en aves (Maiorka et al., 2000; Sakamoto et al., 2011), así como a nivel productivo y económico (Castañeda, 2017). La glutamina también ha demostrado que aumenta la repuesta inmune humoral y celular (Soltan, 2009; Perna et al., 2019), la secreción intestinal de inmuno-globulina A (Ren et al., 2016) y promueve la mejora del metabolismo energético de los lípidos en el hígado de animales recién destetados (Qi et al., 2020).
El ácido glutámico o glutamato, además de actuar como fuente energética de los enterocitos (Cabrera et al., 2013), es el sustrato para la síntesis de proteínas y se metaboliza para producir glucosa a través de gluconeogénesis hepática (Watford, 2008; Ji et al., 2019), o se convierte en otros aminoácidos no esenciales en el intestino (Burrin y Stoll, 2009).
La influencia de los probióticos y ácidos orgánicos en las dietas sobre el desarrollo y mantenimiento de la estructura intestinal de cuyes ha sido evaluada (Vallejos et al., 2015; Puente et al., 2019); sin embargo, aún no se conoce de qué manera el destete precoz influye en las estructura morfológica y actividad enzimática intestinal y como la glutamina podría influir en esta fase. La glutamina ha demostrado afectar el comportamiento productivo posdestete (Sánchez, 2019), como en todo el periodo de cría de animales para el mercado (Bazán, 2020). Considerando el elevado potencial de crecimiento de los nuevos genotipos mejorados de los cuyes, es de inferir que estos no estén expresando su capacidad de respuesta al alimento como consecuencia del efecto del destete. Ante esto, el objetivo de esta investigación fue evaluar el efecto de la adición de glutamina y ácido glutámico (AminoGut®) en dietas de cuyes, destetados a los 15 días de edad, sobre la estructura intestinal y la actividad de las enzimas digestivas intestinales, así como sobre el comportamiento productivo y económico.
MATERIALES Y MÉTODOS
Ubicación del Estudio
La cría de los animales se llevó a cabo en la unidad experimental de cuyes de la Universidad Privada Antenor Orrego (UPAO), ubicada en el Campus II, sector Barraza, distrito Laredo, región La Libertad, Perú. La colecta de muestras y medición de estructura y actividad enzimática intestinal se realizaron en los Laboratorios de Fisiología Animal y de Proteómica, respectivamente, de la UPAO, Trujillo, La Libertad. La zona presenta condiciones climáticas de costa y se encuentra a 20 msnm.
Instalaciones, Animales y Alimentación
Los cuyes fueron alojados en pozas de 0.50 m2, dentro de un galpón construido a base de material noble, ventanas con malla de metal y techado con Eternit. Las pozas estuvieron equipadas con comederos y bebederos de arcilla. El estudio se llevó a cabo de acuerdo con los protocolos establecidos por el comité de bioética institucional y autorizado mediante Resolución Nº 221-2019-UPAO.
Se emplearon 100 cuyes de ambos sexos, de la raza Perú, con 15 días de edad, recién destetados y peso promedio de 358.8 + 27.5 g, procedentes de una granja comercial de la localidad de Trujillo. Los animales fueron pesados semanalmente utilizando una balanza electrónica de 5 kg (± 2 g) de capacidad. Al ingreso al local de experimentación, cuatro animales fueron sacrificados para evaluar estructura y actividad enzimática intestinal en el día del destete. Con los 96 animales restantes se formaron grupos de seis que fue- ron distribuidos en los tratamientos.
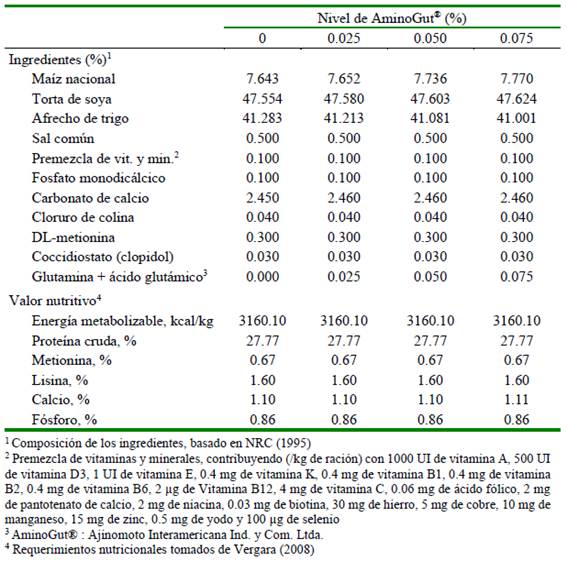
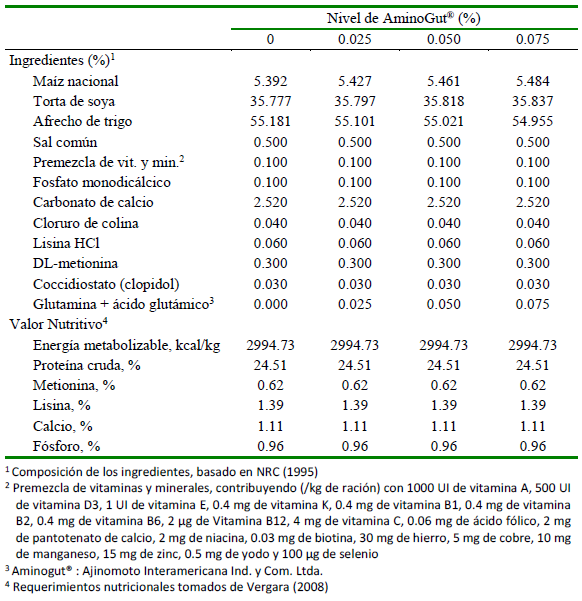
El suministro de alimento fue de acuerdo con los tratamientos y se realizó dos veces al día. El alimento fue a base de concentrado con complemento de forraje verde (FV). La proporción de materia seca del alimento concentrado y del FV fue del 60 y 40%, respectivamente. El alimento concentrado se formuló para complementar los aportes del forraje (alfalfa) a fin de cubrir las necesidades nutricionales de los animales para cada fase, de acuerdo con las recomendaciones del NRC (1995). Los animales fueron alimentados desde el destete hasta los 74 días de edad, considerándose las fases de inicio (15 a 32 días) y crecimiento (33 a 74). Las dietas para cada fase y de acuerdo con los tratamientos se presentan en los cuadros 1 y 2.
La alfalfa utilizada provino de las áreas de cultivo del mismo campus II, cortada al inicio de la floración (55 días de edad) y ofrecida en forma entera. El análisis proximal reportó 24% de materia seca, 19.9% de proteína bruta, 24.4% de fibra cruda, 3.3% de extracto etéreo, 7.8% de ceniza y 44.6% de extracto no nitrogenado en base seca. El consumo de alfalfa fue cuantificado diariamente, pesándose la cantidad ofrecida por la mañana y el residuo a la mañana siguiente. La medición del consumo de concentrado fue semanal.
Tratamientos
Los tratamientos se definieron con la adición de los niveles de 0, 0.025, 0.050, 0.075% del producto comercial AminoGut® en la dieta de cuyes. Este es producido por Ajinomoto Interamericana Ind. y Com. Ltda. y contiene L-ácido glutámico y L-glutamina en concentraciones de 10%.
Se evaluó el consumo de alimento (sumando las cantidades consumidas de materia seca del forraje y concentrado), la ganancia de peso diaria (por diferencia entre el peso final de la fase y el peso inicial de la misma, dividida entre el número de días) y la conversión alimenticia (relacionando el consumo entre la ganancia de peso) como variables de performance. Asimismo, como variables de estructura intestinal se consideraron la altura de vellosidades, profundidad de criptas de Lieberkühn y relación vellosidad/cripta. Además, la actividad de las enzimas intestinales maltasa (EC 3.2.1.20) y sacarasa (EC 3.2.1.48).
Como variables económicas se consideraron el beneficio económico y la rentabilidad. El beneficio económico fue obtenido por la diferencia entre los ingresos por la venta del cuy y el costo total/animal. En el costo total se consideraron el costo de la alimentación, precio del cuy al inicio del experimento y otros gastos (20% del costo total). Los ingresos por venta del cuy se determinaron como producto del peso vivo de los animales por el precio de venta/kg de cuy; la rentabilidad se calculó en función del beneficio económico relacionado al costo total/animal.
Muestras de Tejido
Se sacrificaron cuatro animales al destete y cuatro por tratamiento a los 5 y 8 días de iniciado el experimento y se colectaron muestras de intestino delgado para evaluar la estructura intestinal y la actividad de las enzimas digestivas. Para ello, los cuyes fueron insensibilizados previo al desangrado por la vena yugular utilizando pentobarbital sódico a dosis 30-40 mg/kg vía intravenosa. Luego se realizó una incisión longitudinal ventral, se extrajo el intestino y se tomaron cuatro segmentos (2 de 3 cm y 2 de 8 cm) de la porción central del intestino delgado (yeyuno).
Cuadro 2 Composición del alimento concentrado para cuyes en la fase de crecimiento (33 a 74 días de edad)
Para determinar la estructura intestinal, dos segmentos de 3 cm de intestino fueron lavados con solución salina helada (NaCl 0.9%), abiertos en sentido longitudinal y colocados en solución de formol 10%. Para la actividad enzimática, dos segmentos de 8 cm de intestino fueron lavados con solución salina helada (NaCl 0.9%), empaquetados en papel aluminio, colocados en nitrógeno líquido y luego en freezer a -70 oC para su conservación hasta su procesamiento.
Medición de Estructura Intestinal
La confección de las láminas histológicas se realizó deshidratando el tejido en concentraciones crecientes de alcohol etílico e incluidas en parafina (Al-Doaiss et al., 2019). La tinción se hizo con hematoxilina y eosina. Cada lámina quedó constituida por cinco cortes longitudinales semiseriados de 5 µm de espesor. Las láminas se observaron en un microscopio Primostar (10X) con cámara digital incorporada y conectado a una computadora y se utilizó el software ZEN Blue v. 2.0 de Zeiss Imaging software, que permite capturar las imágenes y realizar las mediciones. Se obtuvo un promedio de 20 mediciones por lámina.
Para la altura de las vellosidades se midió desde el ápice de la vellosidad hasta la región de transición vellosidad-cripta; para la profundidad de criptas, el segmento de medida fue establecido entre la región de transición hasta el fondo de la cripta, donde se ubican las células de Paneth. Las medidas se expresaron en micrómetros (µm). La relación vellosidad/cripta se obtuvo por división entre la altura de las vellosidades y la profundidad de las criptas.
Actividad Enzimática
La mucosa del segmento colectado fue separada mediante raspado, depositada en tubos de ensayo dispuestos dentro de una caja de poliestireno expandido (Tecnopor) con hielo picado en condiciones de refrigeración, pesada en balanza de precisión de 0.01 mg y homogenizada en homogenizador Witeg HG15A. Para la homogenización, se utilizó una solución tampón Tris, HCl 2 mM, pH 7.1 conteniendo manitol 50 mM (Collington et al., 1990), en proporción de 1:15 (p:v). El homogenizado fue centrifugado a 1000 g por 15 min a 4 ºC y separado el líquido sobrenadante, al que se le denominó extracto bru to de mucosa (EBM).
La actividad de las enzimas sacarasa (EC 3.2.1.48 Sucrosa α-D-Glucohydrolase) y maltasa (EC 3.2.1.20 α-Glucosidase) fueron determinadas por la medición de la glucosa liberada en la hidrólisis de los sustratos sacarosa y maltosa, respectivamente, por las enzimas presentes en el EBM. Los reactivos, sacarosa, maltosa y glucosa utilizados fueron del laboratorio Merck. Las condiciones del medio de reacción en las que se desarrollaron los análisis fueron solución tampón fosfato 0.2M, pH 6.5 conteniendo EDTA 5 mM con- teniendo el sustrato sacarosa o maltosa 0.1M en volumen final de 1 ml, siguiendo la meto- dología de Kidder y Manners (1980) y adaptada por Castillo (1999).
El procedimiento de la actividad enzimática para liberar glucosa comenzó cuando 0.8 ml de cada sustrato (solución de sacarosa o maltosa) fue mezclado con 0.2 ml de EBM, incubado a 37 ºC por 60 min, interrumpida la reacción con agua en ebullición y centrifugado en Spin I por 1 min bajo refrigeración. El dosaje de glucosa liberada en el medio de reacción fue realizado utilizando un kit comercial (Glicemia enzimática®, Wiener Lab), donde 20 µl del sobrenadante obtenido anteriormente fue adicionado a 2.0 ml del reactivo del kit e incubado a 37 ºC por 10 min. Finalmente, la absorbancia fue determinada a 500 nm. Para cada muestra se realizaron controles para determinar la hidrólisis espontánea de los sustratos; para ello, las enzimas contenidas en el EBM fueron inactivadas con agua hirviendo antes de ser mezcladas con los sustratos.
Concentraciones conocidas de glucosa (0, 1, 2, 3, 4, y 5 mg/ml) fueron medidas para- lelamente para construir una curva patrón y cuantificar la glucosa liberada por la respectiva enzima. Una unidad de actividad de la sacarasa o de la maltasa (UA) fue definida como la cantidad de enzima que hidroliza 1 mmol de sustrato/minuto, en las condiciones descritas para los análisis.
Análisis Estadístico
Se utilizó un diseño completo al azar, con cuatro tratamientos (0, 0.025, 0.050, 0.075% de inclusión del producto comercial AminoGut® en la dieta) y cuatro repeticiones. Las unidades experimentales estuvieron compuestas por seis animales al inicio del experimento. Los resultados de las variables evaluadas se analizaron mediante el análisis de variancia de regresión, usando el programa estadístico R v. 4.0.2.
RESULTADOS
Comportamiento Productivo
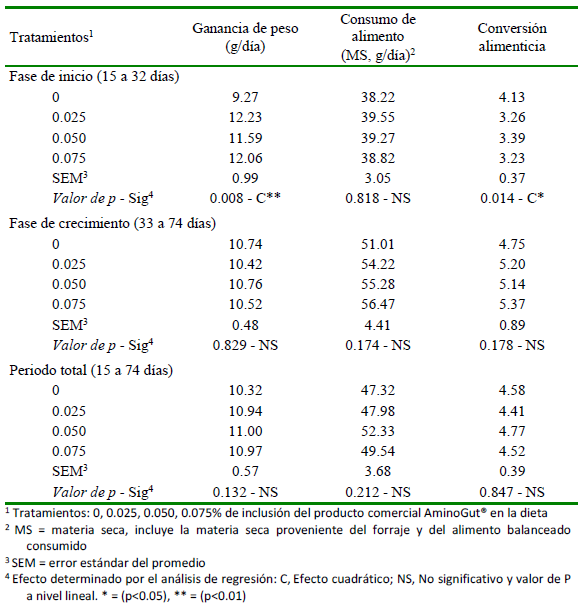
La adicción de glutamina y ácido glutámico contenido en el producto comercial AminoGut® y adicionado a la dieta solo afectó la ganancia de peso y la conversión alimenticia de la fase de inicio (Cuadro 3).
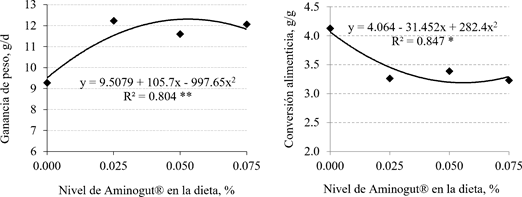
En la figura 1 (a y b), se observa que la ganancia de peso y conversión alimenticia presentaron un comportamiento cuadrático, encontrándose una mejor respuesta a través de los niveles estimados de 0.053% y 0.056% de Aminogut® en la dieta con un R2 de 80.4 y 84.7%, respectivamente, de acuerdo al modelo adoptado.
Estructura Intestinal yActividad Enzimática
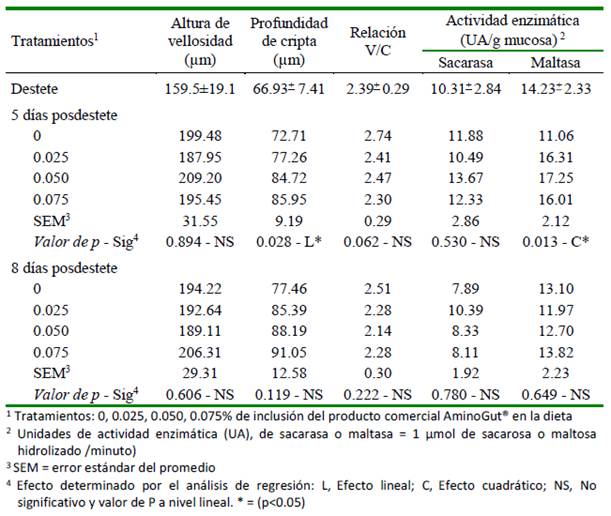
La altura de las vellosidades (V), profundidad de las criptas (C), relación V/C y actividad enzimática de sacarasa y maltasa se muestran en el Cuadro 4. La adición de AminoGut® (glutamina y ácido glutámico) en la dieta favoreció un incremento en la profundidad de cripta y en la actividad de maltasa a los cinco días del destete.
La profundidad de cripta presentó un comportamiento lineal de mayor profundidad conforme aumentó el nivel de glutamina y ácido glutámico en la dieta, en tanto que, la actividad de la enzima maltasa tuvo un comportamiento cuadrático a los cinco días del destete, encontrándose una mejor respuesta con el nivel estimado de 0.048% de AminoGut® en la dieta y debiéndose esta respuesta en 99.03% de acuerdo con el modelo adoptado (Figura 2).
Evaluación Económica
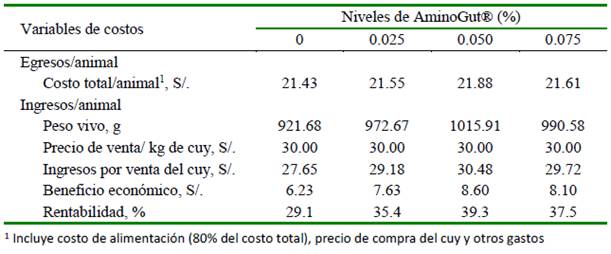
Los cuyes que recibieron dietas con los mayores niveles de inclusión de glutamina y ácido glutámico presentaron mayores beneficios y rentabilidad económica (Cuadro 5), debido principalmente al mayor peso vivo alcanzados al final del experimento.
DISCUSIÓN
Respuesta Productiva y Económica
La adición de AminoGut® tuvo resultados favorables en la fase de inicio de la crianza. Tanto la ganancia de peso como la con- versión alimenticia mostraron un comportamiento cuadrático en función de los niveles utilizados (Cuadro 3), aunque los niveles de consumo de alimento no se mostraron diferentes en la fase de crecimiento ni en el global de la crianza. Estos resultados corroboran reportes de las bondades de la presencia de la glutamina y ácido glutámico en las dietas de los cuyes recién destetados (Sánchez, 2019; Bazán, 2020) y en cerdos posdetete (Teixeira et al., 2014), e incluso en aves (Soltan, 2009; Sakamoto et al., 2011; Castañeda, 2017). Estas mejoras podrían estar asociadas, además de las funciones que cumplen la glutamina y el ácido glutámico en la mucosa intestinal (Cabrera et al., 2013), al papel que cumplen en el metabolismo energético a nivel de hígado (Qi et al., 2020). Sin embargo, los niveles de uso con las que se presentan las mejores respuestas son muy variables.
Cuadro 4 Altura de la vellosidad intestinal (V), profundidad de criptas (C), relación V/C y actividad enzimática (UA) de sacarasa (EC 3.2.1.48) y maltasa (EC 3.2.1.20), medidos en la mucosa intestinal de cuyes suplementados con AminoGut®, evaluados al destete y posdestete
En la fase de inicio (15-32 días), la mayor ganancia diaria de peso (GDP) estimada (12.3 g/día) con 0.053% de inclusión de AminoGut® en la dieta y la mejor conversión alimenticia (CA) de 3.19 con 0.056% de inclusión (Figura 1), evidencian una respuesta de tendencia cuadrática, en el rango de adición del aditivo en la dieta; a diferencia del comportamiento lineal para GDP obtenido por Sánchez (2019) con los mismos niveles de inclusión y por Bazán (2020) con mayores niveles (0.0 a 0.6% de AminoGut®), demostrando que mayores niveles de glutamina y ácido glutámico en la dieta generaban mayor GDP. No obstante, las grandes variaciones de respuesta entre investigaciones podrían estar asociadas a la composición de las dietas y a factores propios del medio donde se desarrolla la crianza, entre otros.
Por otro lado, los valores GDP del presente estudio fueron ligeramente inferiores a los 13.5 g/día reportado por Guevara et al. (2016) con alimentación de forraje y concentrado en la etapa de crecimiento; pero incluso se reportan valores aún mayores de 16.9 a 17.5 g/día (Aliaga et al., 2009; Carbajal, 2015). De igual modo, la CA de este estudio se encuentra por encima de las reportadas por Aliaga et al. (2009) y Camino e Hidalgo (2014), similares a los reportes de Carbajal (2015) y Paredes y Goicochea (2021) y, por debajo de las reportadas por Sánchez-Silva et al. (2014) y Cano et al. (2016); diferencias atribuibles a la gran variedad de genotipos de cuyes con mayor o menor grado de mejora genética.
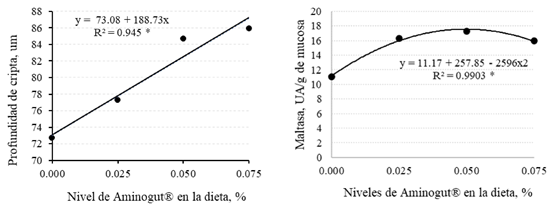
Figura 2 Profundidad de cripta y actividad de la maltasa en función de los niveles de AminoGut® en la dieta de cuyes, evaluado a los cinco días del destete. * = (p<0.05)
La falta de respuesta significativa en la fase de crecimiento (33-74 días) puede deberse a que, en animales adultos, la glutamina es menos requerida, tal como fue demostrado en aves (Sakamoto et al., 2011). Sin embargo, el beneficio económico y la rentabilidad (Cuadro 5) fueron mayores en todos los tratamientos que recibieron glutamina y ácido glutámico en la dieta, en relación al grupo que no los recibió. Los tratamientos con 0.05 y 0.075% de AminoGut® mostraron 10.3 y 8.4% más de rentabilidad, respectivamente, pues los mayores costos totales/animal se vieron compensados con mayores pesos de los animales. En este sentido, Carbajal (2015) y Bazán (2020) obtuvieron mayores beneficios económicos con el aumento de la glutamina y ácido glutámico en la dieta, en tanto que en el estudio de Sánchez (2019) no se logró una mayor rentabilidad con el uso de estos compuestos.
Estructura Intestinal y Actividad Enzimática
La mayor altura de vellosidades y profundidad de cripta y mayor relación vellosidad/ cripta, encontrados en los días 5 y 8 del inicio de la dieta con AminoGut® que los valores encontrados en el día del destete (Cuadro 4), es un claro indicativo de la respuesta intestinal (Dibner y Richards, 2004). En la mucosa intestinal, la renovación celular está definida por procesos de mitosis, migración y descamación de los enterocitos que recubren la mucosa; sin embargo, factores como, el estado nutricional del animal y agentes tróficos de la dieta (Pluske et al., 2018) pueden estimular el desarrollo de la mucosa intestinal, favoreciendo el proceso de mitosis en la región de la cripta, conllevando a aumento del ADN y de los enterocitos (Maiorka et al., 2000; Marcussi et al., 2014).
Cuadro 5 Análisis económico de cuyes que recibieron glutamina y ácido glutámico (AminoGut®) en la dieta durante la crianza (15-74 días de edad)
La evaluación en el día 5 del destete mostró que la adición de glutamina y ácido glutámico en la dieta generó un efecto lineal de aumento en la profundidad de cripta con el aumento de glutamina en la dieta (Cuadro 4), el mismo que podría interpretarse como estímulo para generar mayor división celular (Yi et al., 2005; Chamorro et al., 2009; Ji et al., 2019), y estímulo en la inmunidad y salud intestinal (Perna et al., 2019), debido a su alto grado de asociación entre estas dos variables (r2 = 94.5%, Figura 2); sin embargo, esta mayor producción de enterocitos no con- llevó a mostrar un efecto similar en la altura de vellosidades, como si ocurre en otras especies (Sakamoto et al., 2011; Marcussi et al., 2014; Cabrera et al., 2013).
En forma similar, en el día 5 del destete, la actividad de la enzima maltasa mostró un comportamiento cuadrático en función de los niveles del suplemento en la dieta (Cuadro 4). La máxima respuesta con el nivel de 0.048% de inclusión podría asociarse a una mayor integridad de las vellosidades intestinales (Ren et al., 2016; Wang et al., 2020), garantizando la presencia de enterocitos maduros con mayor actividad enzimática; sin embargo, los resultados no siempre son correlacionados. Cabrera et al. (2013) de- mostraron que la glutamina en la dieta pro- movió mayor altura de vellosidades, pero la actividad de la enzima maltasa no se vio influenciada.
CONCLUSIONES
La suplementación de glutamina y ácido glutámico en la dieta de cuyes favoreció el comportamiento productivo en la fase de inicio, más no así en la fase de crecimiento ni en el global del engorde de los cuyes. No obstante, se observó un beneficio económico.
La profundidad de cripta y actividad de maltasa mostraron respuesta a la suplementación de glutamina y acido glutámico en la dieta a los cinco días del destete.
Financiamiento:
Proyecto de investigación financiado con fondos FAIN-UPAO












 uBio
uBio