INTRODUCCIÓN
El camarón Cryphiops caementarius habita en los ríos de la vertiente occidental de los Andes, desde Lambayeque en Perú (Méndez, 1981) hasta Valparaíso en Chile (Moscoso, 2012). En Perú, la especie se ex- trae de los ríos Pativilca, Cañete y Mala en Lima, así como en Ocoña, Majes-Camaná y Tambo en Arequipa (Zacarías y Yépez, 2015). El volumen de extracción en 2018 fue de 1141 t (PRODUCE, 2019), cantidad superior a los años previos, dada la importancia de esta especie en la gastronomía. En estudios sobre nutrición se han utilizado dietas suplementadas con sal (Ramírez et al., 2018), lecitina (Acosta et al., 2018), ensilado (Terrones y Reyes, 2018), levadura (Cabrera et al., 2019) y zeolita (Senmache y Reyes, 2020). Asimismo, se conoce el desarrollo embrionario y el efecto de la temperatura y salinidad (Reyes et al., 2008, 2009; Fuentes et al., 2010), la interrelación entre la muda, ovario y embrión (Reyes, 2014), los índices reproductivos (Medina et al., 2019) y la condición reproductiva tanto en el laboratorio (Bazán et al., 2009) como en el ambiente natural (Incio et al., 2020). El esfuerzo y el rendimiento reproductivo son estrategias de los crustáceos relacionados con la distribución de la energía para la reproducción (Clarke et al., 1991), pero esto se desconoce en el camarón y menos aún con una dieta a base de poliquetos y durante desoves sucesivos. Sin embargo, se sabe que la especie posee gran potencial reproductivo cuando se mantienen condiciones ambientales y nutricionales adecuadas (Reyes, 2014).
Los poliquetos poseen ácidos grasos como el ácido eicosapentanoico (EPA), ácido docosahexanoico (DHA) y el ácido araquidónico (ARA), así como aminoácidos (Wang et al., 2019; Wairata et al., 2020). El EPA, DHA y ARA son esenciales para la reproducción (Palmer et al., 2014). El ARA está involucrado en la síntesis de prostaglandinas que participan en la maduración y peso del huevo y la fecundidad de los crustáceos (Meunpol et al., 2010; Kangpanich et al., 2016). Además, el poliqueto Nereis diversicolor tiene altos niveles de 17β-estradiol y progesterona (Mouneyrac et al., 2006), que estimulan la reproducción de peces y crustáceos (Nguyen et al., 2012; Wang et al., 2019). Por ello, los poliquetos frescos en la dieta estimulan la maduración de Penaeus monodon (Hoa et al., 2009) y de igual manera sucede con los extractos de poliquetos en la dieta de P. japonicus (Nguyen et al., 2012). Las dietas artificiales a base de poliquetos, calamares y moluscos frescos también mejoran los índices de reproducción en peneidos, aunque su valor nutricional varía con las especies, la estación y los estados de vida (Chimsung, 2014).
El uso de poliquetos extraídos de sustratos naturales para una dieta comercial ocasionaría desequilibrio ambiental, ya que estos se alimentan de detritus y de pequeños bentos, o sirven de alimento para peces, crustáceos e incluso aves (Mandario, 2018). Además, cuando los poliquetos son importados se tiene el riego del ingreso de patógenos (Pombo et al., 2020); por ello es mejor cultivarlos (Asghari et al., 2017), aunque es preferible los de sustratos de origen antrópico. Los poliquetos marinos son organismos bentónicos tanto de la infauna como de la epifauna (Elías et al., 2021). En el mar, la fauna sedentaria y sésil coloniza rápidamente estructuras de todo tipo, como las del cultivo de moluscos bivalvos y que conforman el biofouling (Bannister et al., 2019). Las empresas que cultivan concha de abanico (Argopecten purpuratus) en Perú produjeron recientemente 31 890 t (PRODUCE, 2019) de los cuales entre el 10 y 20% es biofouling (Royer et al., 2006) y de estos, los poliquetos representan alrededor del 1% pero con variaciones estacionales (Loayza y Tresierra, 2014). Sin embargo, el biofouling se desecha y se acumula cerca de las playas, donde contamina el ambiente.
Los poliquetos que habitan las estructuras de cultivos marinos en la zona litoral de Ancash (Perú) pertenecen a los géneros Neanthes, Halosydna, Hydroides, Nereis, Polydora y Steggoa (Loayza y Tresierra, 2014). Sus componentes nutricionales y hor- monales no se conocen, pero de acuerdo con el conocido de otros poliquetos (Chimsung, 2014; Asghari et al., 2017; Wang et al., 2019), es probable que estimulen la reproducción continua de todo organismo que lo consuma; además, de tener mayor preferencia que las dietas artificiales (Huang et al., 2005). Por consiguiente, el objetivo fue evaluar el efecto de dietas con poliquetos en el desempeño reproductivo de hembras del camarón C. caementarius durante desoves sucesivos.
MATERIALES Y MÉTODOS
Camarones
Los camarones fueron colectados el 7 de diciembre de 2019 en el río Pativilca, cerca del centro poblado Huayto (10°39’50’’ S, 77°39’22’’ W) (Lima, Perú) y transportados en sistema individual (Reyes, 2016) durante 5 h hasta el laboratorio. La especie Cryphiops caementarius se reconoció mediante clave taxonómica (Méndez, 1981). El sexo de la hembra se verificó por la presencia de un gonóporo en cada coxopodito del tercer par de periópodos. Los camarones fueron aclimatados durante 10 días y alimentados con dieta basal.
Los camarones seleccionados (n = 54) no tenían masa embrionaria, presentaban los ovarios inmaduros (Ovario I o II) y los apén- dices cefalotorácicos completos. Los camarones medían entre 5.70 a 6.10 cm de longitud total (desde la escotadura postorbital hasta el extremo posterior del telson) medidos con vernier digital Truper (± 0.01 mm) y de 5.0 a 6.0 g de peso húmedo determinado en balanza digital ADAM AQT 600 (± 0.1 g). En este estudio, se ha tenido en cuenta la legislación peruana vigente (Ley 27265, Ley de Protección a los Animales Domésticos y a los Animales Silvestres Mantenidos en Cautiverio).
Sistema de Maduración
El sistema de maduración del camarón consistió en nueve tanques de fibra de vidrio (0.60 x 0.40 x 0.45 m, 100 L) cada uno con seis recipientes de cultivo individual, instalados en dos grupos de tres niveles (Acosta et al., 2018). En cada recipiente de cultivo hubo un camarón y en cada tanque seis camarones, y como cada tratamiento consistió en tres tanques (repeticiones) hubo 18 camarones por tratamiento. En este sistema, los camarones se mantuvieron durante 90 días. Los tratamientos dietarios fueron: una dieta basal, una dieta con solo poliquetos frescos y una dieta basal suplementada con harina de poliquetos.
Dieta Basal
La dieta basal fue elaborada con insumos locales (Cuadro 1), cuya composición proximal fue de 30% de proteína total, 8.1% de lípidos totales y 4.6% de fibra, con 2600 kcal/g (Reyes, 2016). La dieta se preparó según el procedimiento de Guevara (2003).
Dietas con Poliquetos
Los poliquetos fueron colectados dos veces por semana (noviembre 2019 a marzo 2020) durante la limpieza de las linternas de cultivo suspendido de A. purpuratus de empresas y concesiones de la Bahía de Samanco (Ancash, Perú). Los poliquetos fueron transportados en cajas de poliestireno expandido (20 L) con gel pack congelado. En el laboratorio fueron reconocidos como Neanthes succinea (50%), Halosydna brevisetosa (30%) y Nereis pelagica (20%), según claves taxonómicas (Banse y Hobson, 1974; De León, 1999). Los poliquetos frescos fueron lavados con agua destilada, cortados en trozos (~5 mm2), envueltos en papel de aluminio y congelados (-2 °C) hasta por tres días para uso como alimento fresco (Bazán et al., 2009). Una parte de los poliquetos fueron secados (45 ºC por 48 h) en estufa y la harina (18%) se mezcló con la dieta basal (Hoa et al., 2009).
Alimentación
El nivel de alimentación con la dieta basal y con la dieta suplementada con poliquetos fue del 8% del peso húmedo (Cornejo et al., 2015) y con los poliquetos frescos fue del 15% del peso húmedo (Bazán et al., 2009). En el primer mes, los camarones fueron alimentados dos veces al día (30% a las 07:30 y 70% a las 19:00 h), pero de acuerdo con el comportamiento alimentario diurno de las hembras, se decidió alimentar con una ración por día (19:00 h) durante los dos meses siguientes.
Maduración y Desove
El desarrollo del ovario de los camarones se observó a través del cefalotórax y por razones prácticas se consideraron los estados de ovario inmaduro (ovario I o II), en maduración intermedia (ovario III) y ovario maduro (ovario IV) (Reyes, 2014). Para detectar la proximidad del desove, se verificó que los camarones estuviesen con ovario maduro y que haya muda reproductiva, en estas condiciones la hembra desova al día siguiente (Reyes, 2014). El peso de la hembra con y sin masa de huevos se determinó con balanza digital ADAM AQT 600 (± 0.1 g). La masa de huevos recién desovados de ca- marón fue extraída con pinzas y colocada en una caja Petri. Una parte de los huevos (n=20) fue extendido con agujas de punta roma para realiza la medición del eje mayor (L) y el eje menor (l) de los huevos con el uso de un ocular micrométrico instalado en el microscopio compuesto.
Se determinó el volumen (V) de los huevos: V (mm3) = (ð * L * l2) / 6. El índice somático de la masa de huevos (ISM) fue calculado según Shailender et al. (2012): ISM (%) = (Peso de masa de huevos/Peso total del camarón) * 100. La tasa de desove (TD) se determinó según Reyes (2011): TD = (N.° hembras ovígeras/N.° total de hembras) * 100. Además, se calculó el periodo entre desoves y la frecuencia de desoves.
Fecundidad
La fecundidad para cada desove se calculó de tres submuestras de huevos, la que fue pesada en balanza analítica digital AG 221LX (± 0.001 g), luego se extendió en una caja Petri y se fotografió (Huawei Y72018 de 13 megapíxeles). Se contaron los huevos en la foto digital y se calculó la fecundidad absoluta (N.° de huevos/hembra) = [(Wo - Wno) * Nh] / Wh (Bazán et al., 2009), don- de Nh es el número de huevos en la muestra, Wo es el peso de la hembra con masa de huevos, Wno es el peso de la hembra sin masa de huevos y Wh es el peso de la muestra de huevos.
Esfuerzo y Rendimiento Reproductivo
El esfuerzo reproductivo (ER) y el rendimiento reproductivo (RR) se estimaron para cada desove. El ER (la biomasa total de huevos producidos por una hembra) se calculó como el número de huevos multiplicado por el volumen de huevos (Kolding y Fenchel, 1981) y para expresarlo en miligramos se tuvo en cuenta que la densidad de los huevos recién desovados es aproximadamente igual a la del agua (1 g cm-3) (Janas y Mañkucka, 2010). El RR se calculó con la versión modificada de Janas y Mañkucka (2010) donde el RR = (ER/masa húmeda de la hembra) *100.
Análisis Químico de Dietas y Huevos
El análisis químico proximal de las dietas comprendió proteína cruda (UNE-EN ISO 5983-2 Parte 2 Dic. 2006 con factor de 6.25), grasa total (UNE 64021 1970), cenizas (UNE 64019 1971) y humedad (UNE 64015 1971). La composición de ácidos grasos de los huevos recién desovados colectados de manera acumulativa de cada ca marón, según los tratamientos dietarios, se determinó, por duplicado. Los huevos fueron inmediatamente secados (60 ºC por 24 h) en estufa y luego refrigerados (~2 ºC) hasta su análisis. El perfil de ácidos grasos se determinó con el Método de AOAC (2005) (991.39 Determinación de esteres de ácidos grasos) en un cromatógrafo de gases Shimadzu.
Calidad del Agua
Los desechos sólidos acumulados en los tanques se extrajeron mediante sifón, antes de cada alimentación. La renovación del agua de cada tanque fue del 30% y dos veces por semana, previo análisis de los parámetros físicos y químicos. La temperatura del agua se registró con termómetro digital (± 0.1ºC), el oxígeno disuelto con Oxímetro digital YSI 500 (± 0.01 mg/l) y el pH con pH-metro Phep 5 HANNA (± 0.1 unidades) semanalmente. El amonio total y los nitritos se analizaron cada 15 días con el kit colorimétrico Sera GmbH (± 0.1 mg/l).
Análisis Estadístico
La normalidad de los datos se analizó con la prueba de Shapiro-Wilk. Además, se aplicó la prueba de Levene para conocer si hay igualdad de varianza. Los datos se expresaron como media ± desviación estándar. Las diferencias entre las medias de los tratamientos se determinaron por análisis de varianza de una vía y con la prueba de Tukey (p<0.05) y también con la prueba de Dunnett (p<0.05) para comparar los resultados del primer desove con los siguientes desoves. Todos los análisis se realizaron con el programa estadístico SPSS v. 25 para Windows.
RESULTADOS
Las dietas con poliquetos tuvieron mayor concentración de proteínas y grasa, pero menor contenido de cenizas que la dieta basal (Cuadro 2).
Cuadro 2 Composición química proximal (%) de dietas empleadas en la alimentación de hembras de Cryphiops caementarius

Las hembras de C. caementarius supervivieron (100%) durante el periodo experimental. Las hembras con ovario inmaduro (ovario I-II) alimentadas con poliquetos frescos permanecieron menor tiempo (7.22± 0.35 días) en este estado de maduración, y fueron diferentes (p<0.05) que aquellas alimentadas con la dieta basal suplementada con poliquetos (9.28 ± 0.35 días) y con el basal (10.39 ± 0.51 días) (Figura 1A). En cambio, cuando alcanzaron la maduración intermedia (ovario III) el tiempo de maduración disminuyó en aquellas alimentadas con poliquetos (5.83 ± 0.44 días y 5.89 ± 0.26 días), las cuales fueron menores (p<0.05) que con el basal (8.11 ± 0.59 días). De manera similar sucedió con las hembras con ovarios maduros (ovario IV) donde el tiempo en completar la maduración cuando se alimentaron con poliquetos (4.11 ± 0.26 días y 4.44 ± 0.10 días) fue menor (p<0.05) que con el basal (5.95 ± 0.63 días) (Figura 1A). Las hembras alimentadas con poliquetos frescos y con la dieta suplementada con poliquetos maduraron en solo 17.16 ± 1.38 días y 19.61 ± 2.16 días, respectivamente, siendo menor (p<0.05) que con el basal (24.44 ± 1.99 días) (Figura 1B).

Figura 1 Maduración del ovario de Cryphiops caementarius alimentadas con tres dietas durante 90 días. A) Desarrollo de cada estado del ovario. B) Periodo de maduración del ovario

Figura 2 Fecundidad (N.° de huevos / hembra) durante desoves sucesivos de Cryphiops caementarius alimentadas con tres dietas durante 90 días. Letras diferentes sobre las columnas en un mismo desove indica diferencia significativa (Tukey p<0.05). El asterisco indica diferencia significativa con el primer desove (Dunnett p<0.05)
Las hembras alimentadas con poliquetos frescos y con la dieta basal más poliquetos realizaron cuatro desoves sucesivos, de los cuales solo el último sucedió a una tasa de 55 y 38%, respectivamente. En cambio, con la dieta basal solo hubo tres desoves en el periodo en estudio, siendo el último el que ocurrió a una tasa de 22%.
La fecundidad en el primer desove fue alta y similar en las hembras alimentadas con poliquetos (4007 y 3472 huevos), pero diferentes (p<0.05) con el basal (2165 huevos). En los siguientes desoves, la fecundidad disminuyó en 25% en las hembras que se alimentaron con poliquetos y solo en el cuarto desove, la fecundidad de las hembras alimentadas con poliquetos frescos disminuyó a 36% y fue diferente (p<0.05) con el primer desove (Figura 2).
El volumen de los huevos recién desovados fue similar (p>0.05) en las hembras alimentadas con las tres dietas (0.069 -0.072 mm3) (Figura 3A). El ISM fue mayor (p<0.05) en el primer desove de las hembras alimentadas con poliquetos, en relación con las alimentadas con el basal. En cambio, en los siguientes desoves, el ISM fue similar entre tratamientos, aunque mayor tendencia se observó en las hembras alimentadas con poliquetos. Sin embargo, el ISM disminuyó cerca del 50 y 60% al cuarto desove en relación con el primer desove (Figura 3B).
El ER del primer desove de las hembras alimentadas con poliquetos fue alto (323.54 y 269.01 mg), en relación con el basal (180.08 mg), pero disminuyó en alrededor del 32% hasta el tercer desove sucesivo y en 50% en el cuarto desove (Figura 4A). El RR del primer desove de las alimentadas con poliquetos también fue alto (5.82 y 5.43%), pero las alimentadas con la dieta basal suplementada con poliquetos fue similar que con el basal (3.84%). El ER disminuyó en los siguientes desoves alrededor de 35, 50 y 60% en el segundo, tercer y cuarto desove, respectivamente (Figura 4B).

Figura 3 A) Volumen de huevo. B) Índice somático de la masa de huevos (ISM) durante desoves sucesivos de Cryphiops caementarius alimentadas con tres dietas durante 90 días. Letras diferentes sobre las columnas en un mismo desove indica diferencia significativa (Tukey p<0.05). El asterisco indica diferencia significativa con el primer desove (Dunnett p<0.05)
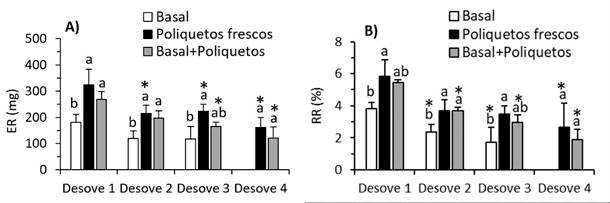
Figura 4 A) Esfuerzo reproductivo (ER). B) Rendimiento reproductivo (RR) durante desoves sucesivos de Cryphiops caementarius alimentadas con tres dietas durante 90 días. Letras diferentes sobre las columnas en un mismo desove indica diferencia significa- tiva (Tukey p<0.05). El asterisco indica diferencia significativa con el primer desove (Dunnett p<0.05)
Los huevos recién desovados de las hembras alimentadas con poliquetos frescos tuvieron mayor contenido de ácidos grasos con relación al de las otras dietas; excepto el ácido palmítico, que fue similar con aquellas alimentadas con la dieta basal suplementada con poliquetos (Cuadro 3).
Cuadro 3 Contenido de ácidos grasos (%) de huevos recién desovados de Cryphiops caementarius alimentadas con diferentes dietas

Los parámetros de calidad del agua en el sistema de maduración del camarón fueron similares (p>0.05) entre tratamientos. La temperatura se mantuvo entre 20.78 y 21.86 °C, la concentración de oxígeno varió entre 4.59 y 4.73 mg/l. El pH varió entre 6.80 a 6.91. El amonio total estuvo entre 0.005 y 0.008 mg/l y los nitritos entre 0.25 y 0.33 mg/l.
DISCUSIÓN
En el presente estudio se demuestra que las hembras C. caementarius alimentadas con poliquetos frescos y con la dieta basal suplementada con harina de poliquetos aceleraron la maduración del ovario, ocasionaron mayor frecuencia y tasa de desove, produjeron mayor número de huevos, y tuvieron alto esfuerzo y rendimiento reproductivo, durante cuatro desoves sucesivos, en contraste con las que consumieron la dieta basal. Esto se debe a que las dietas con poliquetos tuvieron una mayor contribución nutricional en proteína y grasa que la dieta basal, con lo que incrementó el desempeño reproductivo del camarón, como sucede en P. japonicus (Binh et al., 2008), aunque en P. monodon es debido a las hormonas sexuales de los poliquetos (Meunpol et al., 2010).
La dieta con poliquetos frescos ocasionó que el ovario de C. caementarius se desarrollara desde el inicio de la maduración y en menor tiempo, en comparación con las otras dietas. Esto sugiere la participación de los componentes nutricionales (en proteína y grasa) de los poliquetos y probablemente de sus hormonas reproductivas que, aunque no fueron analizadas, inducen la reproducción en otras especies de crustáceos. Nereis diversicolor posee 17β-estradiol y progesterona (Mouneyrac et al., 2006), Perinereis sp posee prostaglandina que induce la vitelogénesis y el desove en P. monodon (Meunpol et al., 2010) y también contiene vitelogenina que aumenta con el desarrollo ovárico en Litopenaeus vannamei (Ruan et al., 2020). En cambio, con la dieta basal suplementada con harina de poliquetos, el ovario de C. caementarius se desarrolló desde la maduración intermedia, similar a lo que sucede con la dieta con poliquetos frescos, lo que sugiere que la harina de poliquetos mezclada y procesada con otros insumos, debe haber reducido o atenuado a los nutrientes y probablemente también a las hormonas reproductivas. Los reproductores de P. monodon requieren dietas con más de 45% de proteína y con al menos 10% de lípidos (Chimsung, 2014), así como de hormonas para cada etapa del desarrollo ovárico (Meunpol et al., 2010). Por otro lado, los poliquetos poseen ácidos grasos de cadena larga (ácido linolénico, ácido linoleico y DHA) necesarios para estimular la maduración del ovario de Scylla paramamosain (Tantikitti et al., 2015). Se desprende la conveniencia de realizar el análisis de las hormonas reproductivas y del perfil de ácidos grasos de las dietas para entender su contribución en el desempeño reproductivo del camarón.
En cambio, la dieta basal ocasionó de- mora en la maduración del ovario de C. caementarius en comparación con las dietas experimentales, aun cuando las condiciones ambientales fueron las del inicio de la estación reproductiva, cuyos parámetros de calidad del agua de los tratamientos fueron similares al del hábitat del camarón (Zacarías y Yépez, 2015) y a las de otras investigaciones previas (Ramírez et al., 2018; Terrones y Reyes, 2018). Esto indica que los camarones estuvieron en buenas condiciones. Similares resultados se obtienen con Pseudonereis sp en C. caementarius (Bazán et al., 2009) y con Marphys amoribidii en Lysmata amboinensis (Omar et al., 2020). Sin embargo, la dieta basal debe ser reformulada o bien suplementada con más del 18% de harina de poliquetos y evaluar sus efectos en la reproducción del camarón. El reemplazo del 50% de las dietas naturales con pellets con L. vannamei mantienen los índices reproductivos deseables (Ghorbani et al., 2017). También es recomendable emplear mayor contenido de proteínas y de ácidos grasos esenciales, como ha sido sugerido en S. paramamosain (Tantikitti et al., 2015) y Macrobrachium rosenbergii (Kangpanich et al., 2016).
El desove continuo ocurre en M. rosenbergii (Cavalli et al., 2001), M. acanthurus (Tamburus et al., 2012), M. amazonicum (Ventura et al., 2019), entre otros. C. caementarius soporta dos procesos reproductivos sucesivos en laboratorio y en periodo de baja reproducción (abril-agosto) (Reyes, 2014), pero en la investigación, las dietas con poliquetos mantuvieron cuatro desoves sucesivos, y con la dieta basal hubo solo tres desoves durante la época reproductiva (diciembre-marzo). Estos resultados constituyen otra evidencia del efecto positivo de los componentes nutricionales de los poliquetos (frescos o en harina) sobre la maduración y desove continuo del camarón, que permitirá incrementar la prole, previa evaluación de su calidad, toda vez que en Neoca- ridina davidi, los múltiples desoves afectan la composición bioquímica y el contenido de energía de los huevos (Tropea y López, 2015).
El volumen de los huevos recién desovados de C. caementarius (0.072-0.082 mm3) fue similar (p>0.05) entre tratamientos y durante los desoves sucesivos, lo que indica que las dietas con poliquetos no influyeron en el tamaño de los huevos del camarón, como ha sido informado previamente cuando se alimenta con Pseudonereis sp (Bazán et al., 2009) y fueron similares con las de las hembras ovígeras del ambiente natural (Reyes et al., 2009) y con M. acanthurus (Tamburus et al., 2012). Por otro lado, las hembras de M. amazonicum invierten más energía en la reproducción sin reducir el volumen de huevos para promover la fertilidad y lograr mayor capacidad de super- vivencia (Meireles et al., 2013). En cambio, el volumen del huevo en N. davidi es similar en desoves sucesivos, pero disminuye su calidad bioquímica (Tropea y López, 2015), lo que es necesario evaluar en el camarón.
Las hembras de C. caementarius alimentadas con las dietas con poliquetos produjeron huevos con alto contenido de ácidos palmítico, esteárico y oleico, en relación con aquellas con la dieta basal, lo que indica la importancia de estos nutrientes para el desarrollo embrionario. Aunque no se determinaron los ácidos grasos de los poliquetos, sin embargo, en Perinereis helleri el ácido palmítico (12.38%) es mayor que el ácido esteárico (3.48%) y el ácido oleico (1.15%) (Palmer et al., 2014); lo contrario sucede en P. nuntia con los mismos ácidos grasos (6.41, 7.13 y 8.24%, respectivamente) (Asghari et al., 2017). El contenido de ácidos grasos de estas especies de poliquetos fue bastante menor que el obtenido en los huevos recién desovados del camarón, lo que sugiere la capacidad de los camarones de asimilar y acumular ácidos grasos para la maduración y el desarrollo embrionario. Los ácidos palmítico, esteárico y oleico son dominantes en todas las etapas ováricas de S. olivacea, y el primer ácido graso es rico en energía para el desarrollo de embriones y larvas (Ghazali et al., 2017). Sin embargo, es necesario evaluar el contenido de los ácidos grasos altamente insaturados (EPA, DHA, ARA) de los poliquetos y de las dietas que permita entender la contribución de estos nutrientes en la calidad de los embriones y larvas del camarón.
La fecundidad de C. caementarius en el primer desove fue mayor (p<0.05) cuando se alimentaron con poliquetos, en relación con el basal, luego disminuyeron en los desoves sucesivos, pero se mantuvo dicha relación. Esto sugiere que las dietas con poliquetos contribuyeron con la proliferación de ovocitos en los procesos reproductivos continuos. En un estudio previo, la mayor fecundidad se obtiene con Pseudonereis sp (Bazán et al., 2009). En la investigación, las dietas con poliquetos contribuyeron con mantener alta fecundidad, lo que es otra evidencia de los nutrientes y probablemente de hormonas reproductivas que estimulan y mantienen el proceso reproductivo, como en P. monodon con las prostaglandinas de Perinereis sp (Meunpol et al., 2010) y con la vitelogenina (Ruan et al., 2020), así como de los ácidos grasos esenciales en M. rosenbergii (Kangpanich et al., 2016). Sin embargo, la disminución de la fecundidad con los desoves sucesivos indica agotamiento energético de la hembra, que no pudo ser compensada con ninguna de las dietas empleadas. Las hembras de M. amazonicum canalizan energía hacia el desarrollo gonadal y para la incubación de huevos, con un presupuesto energético de alrededor del 80% (Augusto y Masui, 2014).
En M. rosenbergii, el aporte de altos niveles de ácidos grasos saturados en la dieta es convertido en formas monoinsaturadas que se almacenan en el hepatopáncreas o se transportan al ovario y finalmente a los huevos para proporcionar energía (Cavalli et al., 1999). En M. amazonicum, la cantidad total de vitelo disponible para los huevos aumenta al mejorar la dieta (Ribeiro et al., 2012), aunque en N. davidi el contenido de lípidos y, consecuentemente, el contenido de energía del huevo disminuye en el cuarto y quinto desove (Tropea y López, 2015). En el presente estudio, la disminución del ISM duran- te los desoves sucesivos de las hembras de todos los tratamientos fue indicador del agotamiento de nutrientes en el ovario y de la disminución la producción de huevos. El ISM inicial de C. caementarius fue cercano al de M. rosenbergii (10.9 a 11.5%) (Shailender et al., 2012).
En especies de Gammarus, el ER es constante (Kolding y Fenchel, 1981) y también sucede en Palaemon elegans (Janas y Mañkucka, 2010). Sin embargo, el ER de las hembras de C. caementarius alimentadas con poliquetos fue alto durante los desoves sucesivos, en relación con la dieta basal, pero en todos disminuyó. Esto es otra evidencia de la acumulación de mayor cantidad de nutrientes en los huevos del camarón alimentados con poliquetos. Así mismo, el máximo RR (5.82 y 5.43%) obtenido en el primer desove es cercano al de M. amazonicum (7.4%, Pantaleão et al. 2018), aunque menor a otros palaemónidos (10-21%, Zimmermann et al., 2015), lo que indica que es una especie dependiente. En cambio, la disminución del RR con los desoves sucesivos (hasta aprox. 2%) fue menor a M. tenellum quien destina entre 4 a 16% del peso corporal en la producción de huevos (Vargas-Ceballos et al., 2012). Sin embargo, esta variación del RR indica la plasticidad que tiene C. caementarius para acu- mular nutrientes y energía en aras de producir prole de calidad. En P. elegans el alto valor del RR se relaciona con el mayor tamaño del huevo y con la calidad de la descendencia (Janas y Mañkucka, 2010), de igual manera sucede en M. amazonicum (Meireles et al., 2013). Sin embargo, en Nemato- palaemon schmitti el RR no varía con el tamaño de las hembras debido a características intrínsecas (Torres et al., 2017).
Los poliquetos empleados en la investigación se encuentran en el biofouling marino y el empleo como alimento vivo o como harina es indispensable para incrementar el desempeño reproductivo de hembras C. cae- mentarius. Esto significa que se ha generado una alternativa de aprovechamiento comercial de estos poliquetos que contribuirá a disminuir la contaminación ambiental en los lugares marinos donde se produce biofouling.
CONCLUSIONES
Las hembras de C. caementarius alimentadas durante 90 días con poliquetos frescos (Neanthes succinea, Halosyd-na brevisetosa y Nereis pelagica) o como harina en la dieta basal maduraron en 17.16 y 19.61 días, respectivamente, y lograron cuatro desoves sucesivos.
La fecundidad en el primer desove es alta (p<0.05) en las hembras alimenta- das con poliquetos (4007 y 3472 huevos), pero disminuye en los desoves sucesivos, al igual que con el esfuerzo y rendimiento reproductivo.












 uBio
uBio 


