INTRODUCCIÓN
La población de ganado bovino en Colombia en 2019 fue de 28 245 262 cabezas (ICA, 2020), de los cuales cerca del 50% corresponden a bovinos Bos indicus concentrados en regiones de amplia tradición ganadera en el país como Casanare y Meta que cuentan con el segundo y cuarto lugar del inventario bovino, respectivamente (FEDEGAN, 2019). Dadas las condiciones ambientales donde se desarrolla la ganadería de carne en Colombia, los bovinos tipo cebú son un excelente recurso genético por su grado de adaptación a los sistemas productivos en el trópico. Sin embargo, pese al incremento de este tipo de animales (Utsunomiya et al., 2019), los toros Bos indicus no superan las cualidades reproductivas de los toros Bos taurus (Aponte et al., 2005), como el rápido desarrollo testicular y la pubertad temprana, habiendo reportes donde los machos Brahman (Bos indicus) alcanzaron la pubertad entre los 16 y 17 meses de edad (Silva-Mena, 1997); sin embargo, la moderada a alta heredabilidad de las características testiculares (Evans et al., 1999) abre la posibilidad de realizar una efectiva selección en los toros reproductores.
De hecho, la correcta selección de los toros reproductores puede aportar el 85% de la eficiencia reproductiva del hato (Menegassi et al., 2011). Entonces es fundamental aplicar metodologías adecuadas para evaluar y mejorar el desempeño de los toros bajo condiciones de monta natural, a fin de lograr que un toro establezca la preñez en más de 25 hembras sanas en una temporada de reproducción de 65 a 70 días, pues toros no seleccionados pueden llegar a presentar entre 20 y 40% de fertilidad reducida (Kastelic et al., 2012). Por lo tanto, los toros deben seleccionarse para producir un alto número de terneros (Holroyd et al., 2002), y para esto, de- ben exhibir actividad sexual intensa durante un periodo corto (por ejemplo, 30 horas).
Uno de los parámetros más asociados a la fertilidad es la circunferencia escrotal. Además, es un indicador consistente de la pubertad (Vargas et al., 1998), y tiene correlación con otras variables de fertilidad como el porcentaje de espermatozoides normales y la concentración espermática (Siddiqui et al., 2008; Fortes et al., 2012b). Además, existen prácticas más eficientes para evaluar la fertilidad del toro como la evaluación de la salud reproductiva (Breeding Soundness Examination - BSE) (Chacon et al., 1999; Chenoweth, 2002; Garcia-Paloma, 2015).
La evaluación del potencial reproductivo del toro se puede acompañar con la generación de indicadores de selección de toros fértiles (Boligon et al., 2010; Corbet et al., 2013). La limitada generación de información sobre la fertilidad puede afectar la estimación de valores genéticos como criterio de selección; sin embargo, las actuales herramientas genéticas permiten identificar regiones genómicas asociadas con rasgos involucrados a las características reproductivas en el toro (Hawken et al., 2012; Fortes et al., 2013) y emplearlas como criterios de selección, inclusive desde el primer mes de vida (Fortes et al., 2012a). Ante esto, el objetivo del estudio fue evaluar variables asociadas a la fertilidad de toros Brahman durante un año en dos temporadas de monta e identificar genes asociados a estas características que pudieran ser empleadas como criterio de selección.
MATERIALES Y MÉTODOS
Localización
El estudio se realizó en nueve fincas de los departamentos de Meta y Casanare, pertenecientes a la Orinoquia de Colombia. La zona presenta temperaturas entre 23 y 37 °C, humedad relativa de 76% y de carácter monomodal, con una época de lluvias de abril a noviembre y una época seca de diciembre a abril (www.ideam.gov.co). La topografía de la región es plana con suelos tipo arcillosos y pobres en minerales. La región se encuentra clasificada como de clima ecuatorial monsoon (Kottek et al., 2006).
Selección y Manejo de Animales
Se seleccionaron 18 toros Brahman, entre 5 y 8 años de edad, nacidos y criados en la región. Estos animales, clasificados como élite por contar con registro de pureza expedido por la asociación de la raza en Colombia. Se incluyeron en el estudio por tener un excelente historial reproductivo (registros reproductivos de los hatos) y mostrar un temperamento dócil durante la colecta de mate- rial seminal en las fincas. El sistema de alimentación fue al pastoreo con praderas de Brachiaria decumbens y B. humidicola, con acceso a sal mineralizada y agua a voluntad.
Se evaluaron 4852 vacas Bos indicus a través de la condición corporal y la medición de las estructuras ováricas (tamaño de los folículos), las cuales debían superar 9.6 mm de diámetro para asegurar que las vacas no se encontraban en anestro (Ruiz-Cortés y Olivera-Angel, 1999), seleccionándose 1800 vacas. Estas se manejaron en lotes de monta con relación toro:vaca 1:50 durante tres meses, seguida de dos meses de descanso. La relación toro:vaca y los tiempos de monta y descanso son superiores a los empleados en la región con relaciones toro vaca que oscilan entre 1:25 a 1:30, dos meses de monta y un mes de descanso.
La primera temporada de monta se realizó entre abril y junio, época caracterizada por un aumento en las precipitaciones (434 mm y 76% de humedad relativa) (www.- ideam.gov.co), seguida de una temporada de descanso de dos meses. La segunda temporada de monta fue entre septiembre y noviembre, con 268 mm de precipitación y 55% de humedad relativa. La precipitación fue de 21 mm y la humedad relativa de 32% en el último periodo de descanso (www.ideam.- gov.co).
Evaluación de la Salud Reproductiva
A cada toro se le realizó la evaluación de la salud reproductiva (BSE), siguiendo las normas de la Sociedad de Teriogenología (Chenoweth et al., 1992). La primera evaluación BSE permitió la selección de los animales, y luego a los toros seleccionados se les hizo el BSE antes del primer y segundo periodo de monta, así como al finalizar el segundo periodo de descanso.
En cada BSE se examinaron los testículos, los epidídimos (cabeza, cuerpo y cola) y el cordón espermático mediante palpación. En los casos que se determinaba presencia de líquido o de material diferente a la textura testicular se realizó ecografía testicular. La circunferencia escrotal (CE) se cuantificó con cinta métrica escrotal en la parte más ancha del diámetro testicular (Higdon et al., 2000).
En cuanto a la evaluación de la calidad seminal incluida en el BSE, se realizó una colecta de semen a cada toro por visita y temporada. En cada colecta se evaluó la presencia de contaminantes en el semen, aunque la respuesta de los toros y su temperamento permitió obtener un semen de alta calidad en todas las colectas. Los toros se inmovilizaron en un brete ganadero y el semen fue colectado mediante electroeyaculación (Ideal® ElectroJac®6, Neogen Animal Safety, USA). Se generó un estímulo intermitente que iba en aumento hasta que se logró la eyaculación (Palmer, 2005; Whitlock et al., 2012). Se midió el volumen seminal y la concentración de espermatozoides en el eyaculado se cuantificó con un fotómetro (Photometer SDM 1, Minitube, Alemania).
El semen fue observado con un microscopio binocular con contraste de fase (Olympus BX, Japón) y plancha térmica a 37 ºC para determinar la motilidad progresiva individual y masal, morfología espermática, así como el vigor y viabilidad espermática. Para la motilidad progresiva individual, se colocó una gota de semen de 3-4 mm de diámetro en un portaobjetos temperado (35-37 ºC) y y cubierta con un cubreobjetos. La muestra se observó con el microscopio de contraste de fase 400x y se estimó el porcentaje de células con movimientos progresivos, el cual debe estar por encima del 30% (Kastelic et al., 2012). Para la motilidad masal se analizó en una gota de semen de 5 a 10 mm de diámetro, colocada sobre un portaobjeto (35-37 ºC) sin cubreobjeto. Se observó la concentración, el porcentaje de espermatozoides con movimiento progresivo y la velocidad de movimiento de los espermatozoides y se cuantificó el movimiento ondulatorio del semen (Alexander, 2008).
La evaluación de las anormalidades morfológicas y la viabilidad espermática se realizaron mediante la coloración con eosina- nigrosina y se expresaron en porcentaje. Las anormalidades mayores no deben sobrepasar del 15-20% de los defectos observados. El vigor espermático se evaluó en una escala de 0 a 5, con una puntuación de 5 cuando se observan movimientos rápidos y vigorosos de los espermatozoides, y 0 cuando no se observa movimiento (Kastelic et al., 2012).
Con la información obtenida del BSE y la evaluación del semen se generó la clasificación andrológica por puntos (CAP) para cada toro (Fonseca et al., 1997). Las características que se incluyeron en el CAP fueron vigor, motilidad progresiva individual, anormalidades mayores y la circunferencia escrotal (Lopes et al., 2009). En este trabajo se tomaron en cuenta las cinco libertades de los animales del Farm Animal Welfare Council (1992) y del principio de las 3Rs de Rusel y Burch (1959).
Análisis Molecular
Se colectaron muestras de sangre de los toros mediante punción en la vena coccígea para la extracción de ADN con kit comerciales y el genotipado con el chip comercial Genomic Profiler Bovine LD GGP-LD (GeneSeek®) en el Laboratorio de Genética Molecular del Centro de Investigación Tibaitatá de AGROSAVIA, Colombia (www.agrosavia.co). La base de datos genómica contenía la información de 26 151 polimorfismos de nucleótido simple (SNPs), pero únicamente se consideraron aquellos con posición conocida en autosomas en la versión del genoma bovino UMD3.1. disponible en Ensembl (https://oct2018.- archive.ensembl.org/Bos_taurus/Info/ Annotation). Adicionalmente, se consideraron SNPs donde el alelo de menor frecuencia (MAF) superior a 0.05 y call rate mayor de 95% y que se alejaron del equilibrio Hardy Weinberg (p<0.0001). Finalmente, se generó una base de datos con 19 790 SNPs. La depuración de la base de datos se realizó con el programa PLINK (Purcell et al., 2007)
Análisis Estadístico
Luego de evaluar la información respecto a la presencia de datos atípicos, se aplicaron modelos lineales de medidas repetidas para determinar la incidencia del efecto aleatorio de individuo y los efectos fijos de temporada (lluvia, seca) y estado reproductivo (monta, descanso) en las variables circunferencia escrotal (CE), clasificación andrológica por puntos (CAP), porcentaje de espermatozoides normales (EspNorm), concentración espermática (ConcEsper) y motilidad espermática (MotEsper).
El modelo empleado fue yijk = m + ai + bj + tk + eijk donde, yijk corresponde a las medidas de las variables CE, CAP, EspNorm, ConceEsper y MotEsper en los individuos; m corresponde a la media general; a y b hacen referencia a los efectos temporada y estado reproductivo; tk es el efecto aleatorio del individuo y eijk es el error experimental.
Las medias mínimo-cuadráticas de las variables según el efecto fueron comparadas con la prueba Tukey-Kramer con el paquete Lsmeans del programa R (R Core Team, 2018). Posteriormente, se aplicó un modelo lineal que incluyó los efectos fijos significativos para la variable correspondiente y el efecto de los genotipos observados en cada SNP para identificar posibles variantes del genoma que pudieran incidir en las características evaluadas y que estuvieran relacionadas con la ubicación de genes de interés. Considerando la muestra de 18 toros con genotipo, se evaluó la estructura y diferenciación genética de los individuos mediante un análisis de componentes principales, aunque aspectos como el desequilibrio de ligamiento que mostró una tendencia plana y las frecuencias alélicas limitaron la detección de variantes raras. Luego de realizar los análisis de regresión, se emplearon las pruebas de comparación múltiple de BonFerroni (BF = 0.05/19 789 = 2.53 x10-6) y False Discovery Rate (FDR) para determinar la significancia de los SNP y bus- car menor presencia de falsos positivos. Además, se realizaron representaciones gráficas de la significancia de los SNP acorde a su posición en el genoma (manhatan plot).
La implementación del modelo lineal, las pruebas de comparación múltiple y los gráficos se realizaron con el programa R (R Core Team, 2018). Por último, con la anotación del genoma bovino disponible en Ensembl (www.ensembl.org) se identificaron los genes ubicados en un área de 200 kb alrededor (upstream y downstream) de los SNPs con significancia estadística. Se buscaron las funciones biológicas de los genes mediante análisis de ontologías (www.geneontology.org) y se revisó su participación en rutas metabólicas.
RESULTADOS Y DISCUSIÓN
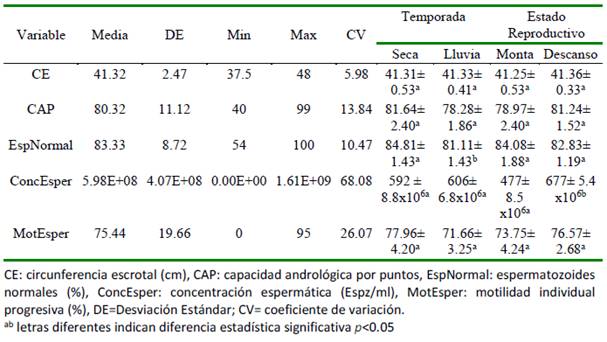
Los resultados descriptivos de las variables en estudio se presentan en el Cuadro 1. Solo los niveles de los efectos temporada (clima) y el estado reproductivo (monta o descanso) generaron diferencias estadísticas significativas (p<0.05) en las variables espermatozoides normales y concentración de espermatozoides, respectivamente. La circunferencia escrotal mayor de 37.5 cm observada en este estudio clasifica a los toros como muy buenos según la clasificación del Colegio Brasileiro de Reproducción Animal (CBRA, 2013), y con medidas similares a las reportadas por Céspedes (2013). Esta medida no presentó cambios importantes en el tiempo (CV=5.98) que pudieran ser asociados a condiciones ambientales o de manejo por las temporadas de monta (Cuadro 1).
La medida de la capacidad andrológica por puntos (CAP = 80.32 ± 11.12) correspondió a una clasificación de muy bueno (Fonseca et al., 1997), siendo valores menos homogéneos que los presentados con la circunferencia escrotal (CV= 13.84). No obstante, es importante correlacionar esta medida con la tasa de preñez debido a que se ha reportado que no hay influencia del valor del CAP con respecto a la tasa de preñez (Lopes et al., 2009).
El porcentaje de espermatozoides normales es adecuado dentro del CAP y superior al requerido como indicador de la calidad seminal (CBRA 2013), aunque el valor mínimo se encuentra por debajo de lo aceptable (Cuadro 1). La concentración de espermatozoides superó los 250 y 350 millones de espermatozoides por mililitro reportado por Kastelic et al. (2012) y la CBRA (2013), respectivamente. Sin embargo, hay una alta heterogeneidad en los valores de la variable (CV= 68.08) causada por el estado reproductivo del animal (descanso o monta), al grado de observar azoospermia (Cuadro 1). Evaluar la concentración espermática permitiría identificar si el toro requiere recuperación para los próximos BSE, causada por el exceso de servicio sexual y las condiciones ambientales (Vejarano et al., 2005; Ruíz-Sesma et al., 2010).
A pesar de que los factores ambientales como la reducción de las lluvias o la temperatura juegan un papel relevante en los parámetros espermáticos (Igna et al., 2010), la respuesta individual al estrés térmico puede ser diferente; por ejemplo, Staalhammar et al. (1989) reportaron una concentración más alta y mayor número de espermatozoides durante la época de verano, mientras que Mathevon et al. (1998) los encontraron en invierno. En este estudio, la concentración espermática fue más afectada por el estado reproductivo que por la temporada (Cuadro 1), similar a lo observado en otros reportes (Brito et al., 2002). La producción de esperma y la calidad del semen en ambientes tropicales disminuyen durante la temporada de calor en toros Bos taurus y mestizos en comparación con toros Bos indicus (Fields et al., 1979; Kumi-Diaka et al., 1981). Las condiciones de verano (mayor temperatura ambiental, la humedad relativa y radiación solar) aumentan la carga térmica en los animales y causan una disminución significativa en el potencial de producción, pudiendo incluso ser perjudiciales para la salud del animal (Majic Balic et al., 2012).
El efecto perjudicial de la alta temperatura ambiental sobre la calidad del semen y la fertilidad del macho puede atribuirse a las vías hipotálamo-hipofisarias o al efecto directo de la temperatura sobre la función testicular y epididimaria (Pineda, 2003). La temperatura ambiental elevada durante el verano pue- de aumentar la temperatura testicular, la tasa metabólica y los requerimientos de oxígeno (Gadea et al., 2004). Si el metabolismo intensificado no es seguido por un flujo sanguíneo mejorado, el tejido testicular se vuelve hipóxico, lo que resulta en una producción excesiva de especies reactivas de oxígeno (ROS) y peroxidación lipídica, estrés oxidativo y disminución de la motilidad de los espermatozoides (Nichi et al., 2006).
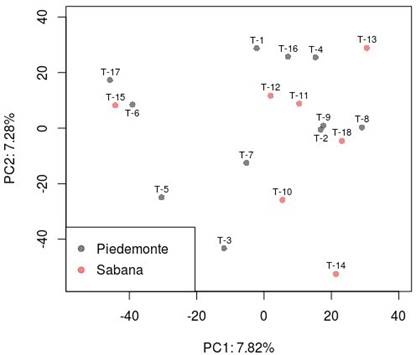
No se identificaron relaciones genéticas entre los individuos ni agrupamientos por su región de origen a partir del análisis de componentes principales (Figura 1). Sin embargo, el análisis reveló una estrecha relación entre los toros T6, T15 y T17, que al evaluar el pedigrí se identificó una relación de parentesco en los abuelos de T6 y T15. No se contó con genealogía para el individuo T17 que pudiera aportar pistas sobre una posible relación cercana con los otros toros. La inclusión del efecto de estructura poblacional no incidió (p>0.05) en la media fenotípica observa- da en este estudio.
Los análisis de asociación genómica se realizaron para cada una de las variables incluidas en este estudio, pero como se esperaba por el análisis previo (Cuadro 1), las variables circunferencia escrotal y motilidad espermática no presentaron señales de asociación. Para la variable CAP, el SNP Hap- map48689-BTA-23260 presentó la mayor significancia estadística (p=6.174e-05), aun- que no superó el umbral de significancia después de la corrección de BonFerroni (2.53 x10-6) y presentó un FDR de 0.72. En cambio, para las variables concentración espermática y espermatozoides normales se encontraron cuatro regiones del genoma con señales de asociación (Cuadro 2, Figura 2), aunque solo una región en cada variable cumplió con los umbrales para comparación múl tiple.
La utilización de modelos de medidas longitudinales (medidas repetidas) mejora notablemente el poder de detección de variantes alélicas asociadas a los fenotipos respecto a un modelo que emplea la media fenotípica observada en los individuos (Rönnegård et al., 2016) dado que permite modelar las estructuras de (co)varianza de las observaciones fenotípicas en el tiempo y el genotipo de los individuos. De hecho, se ha observado que no considerar la estructura de correlación entre el tiempo y el fenotipo incrementa el número de falsos positivos (Ghosh y Fardo, 2018).
Cuadro 2 Descripción de los cuatro SNPs más significativos del análisis de asociación genómica para concentración de espermatozoides y los espermatozoides normales
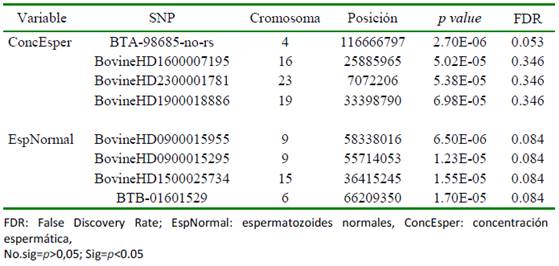

Figura 2 Manhattan plot de los resultados del análisis de asociación genómica para concentración espermática (arriba) donde se destaca el SNP BTA-98685-no-rs ubicado en el BTA4 y el porcentaje de espermatozoides normales (abajo) con los SNP’s BovineHD0900015955 y BovineHD0900015295 ubicados en el cromosoma BTAU9
Este tipo de modelos puede ser favorable cuando el tamaño de muestra es limitado, dado que en un escenario de análisis con fenotipos medidos en un tiempo específico, se pierde poder en la estimación de asociaciones verdaderas y no resalta los factores genéticos y epigenéticos que se destacan al considerar los efectos de ambiente permanente (Rönnegård et al., 2016).
Concentración Espermática
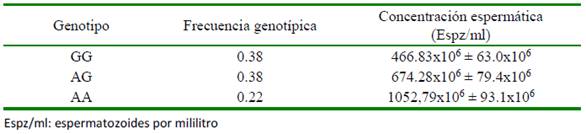
El análisis de asociación para la concentración espermática permitió identificar el SNP BTA-98685-no-rs ubicado en el BTA4 con un FDR 0.053 (Figura 2), el cual mostró un efecto de sustitución alélica aditivo y donde los individuos con dos copias del alelo de menor frecuencia (AA) presentaron una concentración espermática 2.25 veces superior a la observada en individuos con el genotipo GG (Cuadro 3). La región del BTA4 con señal de asociación contiene algunos genes relacionados con la síntesis y metabolismo de esteroides. Particularmente, los genes INSIG1 y PAXIP1 forman parte de rutas metabólicas de síntesis de esteroides, los cuales son producidos en las células de Leydig de los machos y se requieren para la espermatogénesis y, por ende, en la concentración espermática (Eacker et al., 2008).
Cuadro 3 Frecuencia genotípica y concentración espermática para los genotipos del SNP BTA-98685-no-rs
INSIG1 (Insulin Induced Gene 1) codifica una proteína que bloquea la activación proteolítica de las proteínas de unión al elemento regulador de esteroles, que son factores de transcripción que activan los genes que regulan el metabolismo del colesterol, los ácidos grasos y la glucosa (Sun et al., 2012) y en el control de retroalimentación de la síntesis de lípidos (Sever et al., 2004). La relación a nivel bioquímico y fisiológico de INSIG1 es relevante para la reproducción. Por ejemplo, la síntesis de colesterol y otros lípidos de membrana en las células de los mamíferos está regulada por proteínas de unión a elementos reguladores de esteroles (SREBPs) del retículo endoplásmico (ER) para el complejo Golgi y son un factor de transcripción en la membrana que activan genes asociados a la síntesis de lípidos (Brown et al., 2000). El colesterol es el precursor esencial de todas las hormonas esteroides y que para los machos es un proceso altamente regulado en las células de Leydig para mantener la homeostasis adecuada del colesterol (Eacker et al., 2008). Esta misma región fue identificada por una señal de asociación genómica cuando se evaluó la hipoplasia testicular en el ganado Nelore (Neves et al., 2019). Por la relación de las variables observadas INSIG1 puede considerarse un excelente gen candidato para la evaluación reproductiva de toros cebú, y determinar la presencia de variantes en las secuencias asociadas con cambios en el patrón de expresión.
Posteriormente, se analizó una región de 200Kb que rodea el SNP BTA-98685-no-rs, la cual contiene 24 genes- Al realizar el análisis de ontologías no se observó una sobrerrepresentación significativa (p>0.05) de procesos biológicos.
Porcentaje de Espermatozoides Normales
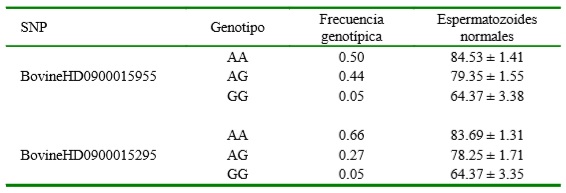
Los SNPs con mayor significancia fueron el BovineHD0900015955 y Bovine- HD0900015295. El FDR para la significancia de estos SNPS fue BH=0.084, los cuales se ubican en el cromosoma BTAU9 (Figura 2). Se encontró un efecto de sustitución alélica aditivo en el SNP donde las copias de los alelos de mayor frecuencia AA mostraron un aumento en el porcentaje de espermatozoides normales con respecto a las copias diferentes (Cuadro 4).
El análisis de ontologías para los genes ubicados a 200 kb a cada lado del SNP incluyeron aspectos metabólicos como el desarrollo y la diferenciación de las espermáticas (p-value=7.07E-08, FDR=9.32E-04), del cual se destacaron cuatro genes: PACRG, UBE2J1, CCR6 y TBPL1.
Cuadro 4 Frecuencia genotípica y porcentaje de espermatozoides normales en toros Brahman para los genotipos de los SNPs con señal de asociación en el BTA9
La ausencia de expresión del gen PACRG (Parkin co regulated gene) puede causar la ausencia de la estructura de la cola del espermatozoide y generar defectos en la estructura principal, como cabezas redondas o desprendidas (Li et al., 2015). PACRG interactúa con el gen de meiosis expresada 1 (MEIG1) y junto con el antígeno 16 asociado al espermatozoide que codifica un axonema central del aparato proteico (Lehti y Sironen, 2017).
El gen UBE2J1 (ubiquitin conju- gating enzyme) juega un papel importante en la degradación de proteínas en el retículo endoplasmático. En ratones, se observó su relación con la esterilidad en el macho debido a defectos en el flagelo y la función del acrosoma y una eliminación defectuosa del citoplasma de los espermatozoides alargados (Koening et al., 2014). En la fase de espermiación el citoplasma es eliminado de la espermátida, puentes citoplasmáticos intercelular entre las espermátidas son interrumpidos y la fuerte adhesión entre espermátidas y células de Sertoli son removidos para facilitar su liberación dentro de los túbulos seminíferos. Las espermátidas en estos pasos de diferenciación son en gran parte transcripcionales inactivas, lo que implica que las transcripciones se transcriben antes, y que la traducción de Ube2j1 (y presumiblemente otro) y las transcripciones se descomprimen en espermátidas alargadas. Por lo tanto, es probable que se requiera UBE2J1 en un momento crítico dentro de la espermátida que se alarga para completar con éxito los pasos finales de diferenciación y espermiación (Koening et al., 2014).
El gen CCR6 (Chemokine receptor 6), se ubica en la pieza principal y la región basal (cuello) del espermatozoide. Antes de la fertilización el espermatozoide debe recibir y procesar señales del ambiente para localizar el ovocito (Kelly, 1995). El plasma seminal contiene altas concentraciones de citoquinas y quimioquinas y otros compuestos bilógicos que ejercen un potente efecto sobre el sistema inmune de la hembra. Se ha demostrado que el semen induce una aguda inflamación en la mucosa genital de la hembra después del coito. La interacción del espermatozoide con esas quimios atrayentes primarios influencia el movimiento del espermatozoide direccionándolo al sitio de la fertilización (Robertson, 2007). El CCR6 mRNA es expresado en el testículo y la proteína se localiza sobre el plasma de membrana del espermatozoide; hay presencia de CCR6 sobre la superficie del espermatozoide; esta región está involucrada en la motilidad e hiperactivación, un patrón de motilidad especializado asociado con la capacitación (Caballero-Cam po et al., 2014).
El gen TBPL1 (Tata Box Binding Protein like 1) interviene en la regulación de la transcripción en la espermátida. Este gen codifica un miembro de la familia de proteínas de unión a caja TATA y tienen un papel crítico en la transcripción por la ARN polimerasa II como componentes del complejo de factor de transcripción IID (TFIID) (Isogai et al., 2016). Igualmente, desempeña un papel importante en la espermatogénesis y los polimorfismos de un solo nucleótido, y pueden estar asociados con la infertilidad masculina. Además, se involucra en la organización de la cromatina, y es requerido para la apropiada formación y mantenimiento del cromocentro (Catena et al., 2006). La mutación de TBPL1 produce una arquitectura anormal de la cromatina y puede causar una falla de la posición de los centrómeros y se exhiben múltiples cromocentros. Así, los defectos en las espermátidas redondas guían a una amplia apoptosis en las espermátidas alargadas con poca producción de espermatozoides (Berkovits y Wolgemuth, 2011).
CONCLUSIONES
La temporada (seca y lluvia) incidió sobre el porcentaje de espermatozoides normales observados mientras que el estado reproductivo (monta o descanso) tuvo relación con la concentración espermática en bovinos Brahman.
Los genes INSIG1 y PAXIP1 identificados alrededor de la señal de asociación en el BTAU4 (BTA-98685-no-rs) podrían estar relacionados con la concentración espermática en Brahman, Es necesario validar este resultado en una muestra de mayor tamaño así como con un mayor número de marcadores.
La señal de asociación en BTA9 se ubica junto a los genes PACRG, UBE2J1, CCR6 y TBPL1, los cuales hacen parte del desarrollo y diferenciación espermática e influyen en la morfología de los espermatozoides. Estos genes podrían ser objetivo de análisis para la evaluación de anormalidades de espermatozoides.












 uBio
uBio