INTRODUCCIÓN
El coipo (Myocastor coypus) es un roedor neotropical, criado en condiciones zootécnicas por su piel y carne. Presenta una gestación de 132 días con un rango de 127 a 138 días (Weir y Rowlands, 1974). El número de crías por camada varía entre 7 a 13 (Ebensperger y Hayes, 2016). La morfología de sus órganos reproductivos ha sido estudiada en animales sexualmente maduros. Presenta un útero doble con dos canales endocervicales independientes (Felipe et al., 1998). La morfología general de su sistema reproductor tiene características similares a las reportadas para otros histricomorfos (Flamini et al., 2009; Mayor et al., 2011; Wahid et al., 2020).
Las funciones del sistema reproductor hembra de los mamíferos dependen de los eventos que acontecen durante el desarrollo prenatal (Kelleher et al., 2019). La diferenciación del útero involucra cambios del epitelio de revestimiento, la formación de las glándulas (Kelleher et al., 2019) y la transformación del mesénquima en tejido conectivo y muscular (Wilson y Bordoni, 2021). El desarrollo prenatal del útero ha sido ampliamente estudiado en animales domésticos (Bukar et al., 2006; Hayashi et al., 2008; Abiaezute et al., 2017; Prozorowska et al., 2018, 2019), pero no sobre el coipo. Los estudios pioneros de Weir y Rowlands (1974) demostraron la variación interespecífica en los sistemas reproductores hembra de los histricomorfos. Dado que la dieta, reproducción y cuidados generales en cautiverio del coipo se encuentran documentados (Felipe et al., 2001a,b), la especie puede constituirse en un nuevo modelo para estudios citohistológicos del desarrollo. El objetivo de este trabajo fue caracterizar las variaciones morfológicas y morfométricas en el desarrollo prenatal del útero del coipo.
MATERIALES Y MÉTODOS
Se conformaron dos núcleos de reproductores con ocho ejemplares de M. coypus cada uno (siete hembras y un macho) alojados en corrales semitechados. Se les suministró alimento balanceado y agua ad libitum. Se efectuaron análisis colpocitológicos diarios de cada hembra mediante el empleo de técnicas de rutina estandarizadas (Felipe et al., 2001a). Se aplicó la metodología del apareamiento dirigido de los animales (Felipe et al., 2001b), para lo cual, una vez determinado el estro por colpocitología, se procedió al traslado de la hembra al corral del macho. La efectivización de la cópula y de la eyaculación se determinaron por observación directa del comportamiento de los animales y por detección de la presencia de espermatozoides en la cavidad vaginal mediante muestreo colpocitológico realizado 1 h después del apareamiento. La confirmación del apareamiento permitió asumir el día de su ocurrencia como tiempo 0. Se sacrificaron 12 hembras gestantes (tres por cada tiempo de muestreo), con el método de desnuca- miento respetando las condiciones establecidas en el Acta de Bienestar Animal de la FCV-UNCPBA (Acta de Bienestar Animal, 2002).
Se colectaron los aparatos reproductores de fetos con intervalos de 30 días, desde el día 60 al día 120 post coito (dpc) y de fetos a término (135 dpc). El muestreo se inició a los 60 dpc ya que estudios previos indican que a esa edad los fetos presentan el sistema reproductor diferenciado a nivel gonadal (Felipe et al., 2006). Para cada edad fetal se trabajó con tres fetos obtenidos al menos de dos camadas diferentes. Los fetos de 60 dpc se procesaron enteros, en tanto que para los fetos con edades gestacionales de 90, 120 y 135 dpc se tomaron muestras de los cuernos y cuerpo uterino y del cérvix.
Las muestras se procesaron con técnicas histológicas de rutina. Se obtuvieron cortes cada 5 µm de los bloques de parafina, y se colorearon con hematoxilina-eosina para determinar la estructura histológica. Para identificar zonas con epitelio mucosecretor se utilizó ácido peryódico-reactivo de Schiff (PAS) (Prophet et al., 1995). Para determinar la presencia de fibras colágenas se aplicó la técnica de picrosirius-red (Singh et al., 2018) y las secciones se analizaron mediante epipolarización en un microscopio binocular Olympus CH3 provisto de filtro polarizador U-POT UP110 y filtro giratorio analizador CH3-AN CO500. Para establecer la diferenciación de componentes musculares se analizó el patrón de expresión de á-actina de músculo liso (clon 1 A4, Dako Cytomation) mediante la técnica de inmunohistoquímica peroxidasa-antiperoxidasa (Sternberger et al., 1970).
Se analizó la organización histológica en túnicas y capas, y se efectuó la distinción de características tisulares del estroma superficial y profundo. El análisis del cérvix se realizó considerando las características de su mucosa endo y exocervical y su estroma (Felipe et al., 2005). Las denominaciones utilizadas para las estructuras embrionarias se ajustaron a la Nomina Embryologica Veterinaria (2017) y a la Nomina Anatomica Veterinaria (2017).
RESULTADOS
Estadio de 60 dpc
Se observaron los conductos parame- sonéfricos (ductus parameso-nephricus). Presentaron un trayecto longitudinal rectilíneo desde las gónadas hasta el límite entre las vértebras lumbares y sacras, donde pre- sentaron un encorvamiento hacia medial para constituir el primordio útero-vaginal (primordium uterovaginale). El epitelio de revestimiento fue cúbico simple rodeado por una capa de células de aspecto mesenquimático. Paralelos a los conductos parameso- néfricos se localizaron, en un pliegue de la pared celómica, los conductos mesonéfricos (ductus mesonephricus) (Figura 1A).
Estadio de 90 dpc
El útero se observó regionalizado en un par de segmentos libres (cornus uteris), un segmento con fusión externa de ambos cuernos (corpus uteri) y el cérvix (cervix uteri). En los segmentos cefálicos y medio del útero, el lumen fue de aspecto ovoidal y con superficie lisa (Figura 1B). Los lúmenes en el cuerpo presentaron forma triangular y pliegues mucosales.
La pared de los segmentos uterinos presentó tres túnicas:
La túnica interna mostró un epitelio de revestimiento estratificado cúbico alto (Figura 1C).
La túnica media estuvo constituida por células estrelladas y fusiformes, donde se diferenciaron dos capas: la capa interna o estroma superficial con abundancia de células fusiformes y la capa externa o estroma profundo, con células estrelladas en una trama laxa.
La túnica serosa presentó un epitelio simple plano y una capa mesenquimática. Solo se identificaron fibras colágenas en la túnica serosa del cuerpo uterino con la colocación picrosirius red.
La luz de los canales endocervicales (canalis cervicis uteri) se observó de forma estrellada, con presencia de pliegues primarios e invaginaciones del epitelio (Figura 1D). La mucosa endocervical presentó criptas poco profundas, con un epitelio estratificado cúbico con núcleos ovoideos. En el tabique entre los canales endocervicales se observó mesénquima con células de aspecto fusiforme. El epitelio del exocérvix (portio vaginalis cervicis) fue cúbico estratificado, apoyado sobre una capa de células mesenquimáticas.
Se observaron fibras colágenas dispersas en el estroma de los canales endocervicales. No se observó reacción PAS positiva a nivel del epitelio de revestimiento o glandular en los cuernos uterinos ni en el de revestimiento luminal o de las criptas del cérvix. Solo se detectó inmunomarcación para á- actina de músculo liso en la pared de los vasos sanguíneos.
Estadio de 120 dpc
El útero se observó regionalizado en cuernos, cuerpo y cérvix. La luz uterina fue ovalada y con superficie irregular en los segmentos cefálicos y medio de los cuernos, en tanto que la luz presentó aspecto estrellado en el segmento caudal. En los cuernos uterinos se distinguieron las túnicas mucosa, muscular y serosa. El epitelio de revestimiento fue de aspecto estratificado, con células cúbicas de núcleos redondeados (Figura 2A). La zona subyacente al epitelio presentó células fusiformes inmersas en una matriz de tejido conectivo laxo. Se observaron indicios de adenogénesis temprana como invaginaciones epiteliales localizadas en el estroma superficial.
En la túnica muscular se diferenciaron tres capas: una muscular interna, una vascular media y una muscular externa. Las tres fue- ron positivas a inmunomarcación para α-actina de músculo liso. La capa muscular interna presentó sus células dispuestas en forma circular. La capa media presentó haces musculares escasos y abundantes vasos sanguíneos. En la capa muscular externa los haces de fibras se presentaron orientados en sentido longitudinal y agrupados en fascículos rodea- dos de tejido conectivo. Por fuera de la túnica muscular se observó la túnica serosa.
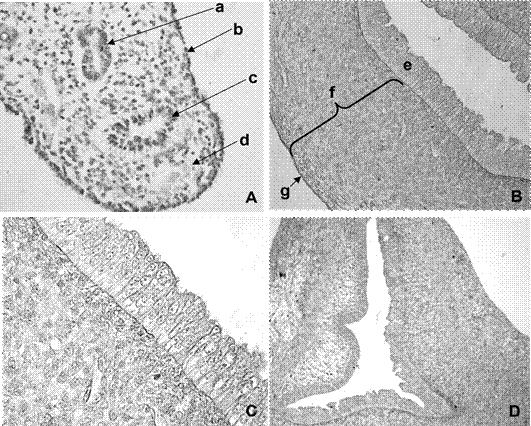
Figura 1 A. Microfotografía de corte transversal de la cresta urogenital derecha de fetos de coipo (Myocastor coypus) de 60 días poscoito (dpc), 40x; B. Corte transversal de la pared uterina a los 90 dpc, 10x; C. Vista del epitelio endometrial y estroma superficial a los 90 dpc, 20x; D. corte transversal del canal endocervical derecho a los 90 dpc, 10x. Referencias: a. conductos de Wolf, b. epitelio celómico, c. conductos paramesonéfricos, d. mesénquima, e. epitelio, f. estroma, g. serosa. Coloración H-E
En la zona de fusión externa de los cuernos uterinos, los lúmenes uterinos presentaron aspecto estrellado y superficie irregular (Figura 2B). El epitelio fue estratificado cúbico. El estroma estuvo conformado por tejido conectivo laxo. La túnica muscular fue semejante a la de los cuernos. El área media entre la unión de los dos cuernos mostró tejido conectivo laxo muy vascularizado. Se observaron abundantes fibras colágenas en la zona del estroma superficial y en la zona de unión de los dos cuernos uterinos.
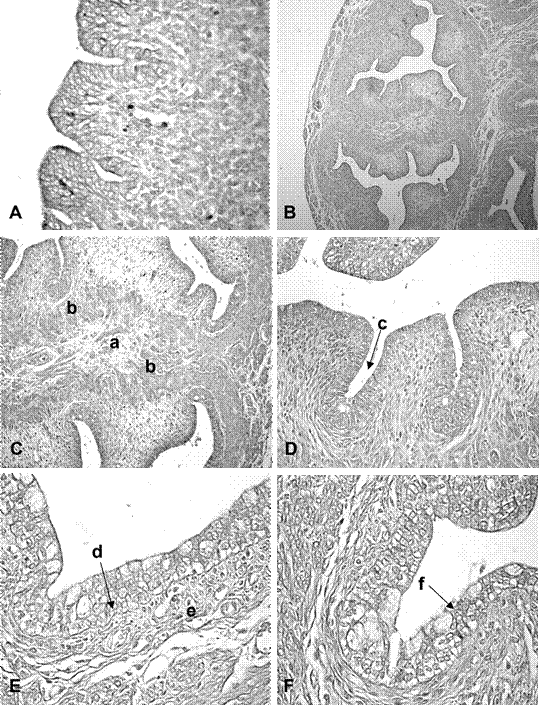
Figura 2 Microfotografías de cuernos uterinos y cérvix de fetos de coipo (Myocastor coypus) de 120 días poscoito (dpc). A. Epitelio y estroma endometrial, 40x; B. Vista general del área del cuerpo uterino doble, 4x; C. Vista de la zona intermedia de los canales endocervicales, 4x; D. Pliegues y criptas del endocérvix, 40x; E. Epitelio y estroma endocervical, 40x; F. Epitelio y estroma exocervical, 40x. Referencias: a. estroma conectivo de la zona de unión de los canales cervicales, b. áreas musculares, c. cripta, d. epitelio endocervical, e. estroma endocervical, f. epitelio exocervical. Coloración H-E
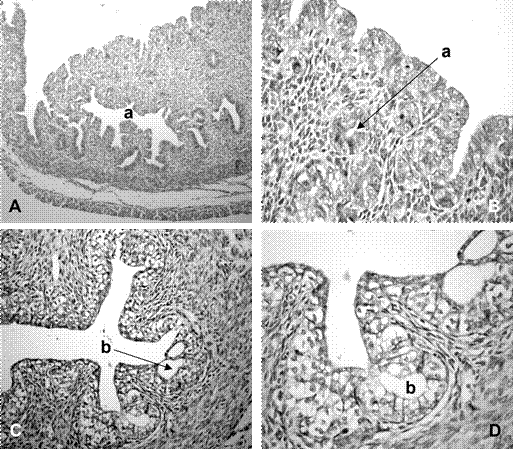
Figura 3 Microfotografías de cuernos uterinos y cérvix de fetos de coipo (Myocastor coypus) de 135 días poscoito (dpc). A. Vista general de la pared uterina, 10x; B. Vista del epitelio y estroma del endometrio, 40x; C. Canal endocervical derecho, 20x. D. Crip- tas cervicales con 40x. Referencias: a. glándulas endometriales, b. criptas. Colo- ración H-E
La zona del cérvix presentó una luz estrellada, con numerosos pliegues mucosales. En la zona media entre los canales endocervicales se observó tejido conectivo laxo con numerosos vasos sanguíneos, interpuesta entre dos áreas de tejido muscular (Figura 2C). Se observó la presencia de criptas poco profundas en el espacio comprendido entre los pliegues de la mucosa (Figura 2D). El epitelio endocervical fue estratificado, con células isodiamétricas de núcleos centrales y redondos. En su capa más superficial se observaron células de citoplasma claro y vacuolizado (Figura 2E). El estroma superficial del cérvix presentó células dispuestas en forma paralela al epitelio, en tanto en el estroma profundo las células se observaron desordenadas. El epitelio exocervical fue estratificado (Figura 2F). Hacia basal, se observaron células isodiamétricas o cúbicas con núcleos redondos, en las capas medias, predominaron células ovoidales de núcleos ovoides y, en las capas más superficiales, se presentaron células intercaladas con citoplasmas vacuolizados. Se observaron fibras colágenas en el estroma de los canales endocervicales. No se observó reacción PAS positiva a nivel del epitelio de revestimiento o glandular.
Estadio de 135 dpc
La luz uterina en los sectores cefálicos, medio y caudal fue de forma ovalada y con superficie irregular. El epitelio de revestimiento fue estratificado con células isodiamétricas de núcleos redondos. La lámina propia presentó características de un tejido conectivo con abundancia de células fusiformes. La túnica muscular se observó conformada por tres capas: interna, media o vascular y externa. La primera con fibras musculares lisas orientadas en forma circular; la media con abundancia de vasos sanguíneos, tejido conectivo laxo y haces dispersos de fibras musculares lisas y la capa externa con fascículos musculares longitudinales. La túnica serosa fue de tejido conectivo laxo y mesotelio. Se identificaron estructuras semejantes a glándulas tubulares localizadas en el estroma superficial de los cuernos y el cuerpo (Figura 3A,B).
La luz de los canales endocervicales fue estrellada, de forma alargada en sentido dorsoventral y con numerosas criptas (Figura 3C). El epitelio de revestimiento se observó estratificado cúbico con núcleos redondeados (Figura 3D). En el estroma superficial, los componentes conectivos se presentaron dispuestos en forma paralela al epitelio, en tanto que en la zona profunda, se observó una disposición desordenada de células fusiformes y fibras. Al igual que en la zona caudal de los cuernos uterinos, en la zona media entre los canales endocervicales se presentó una zona más laxa, de tejido conectivo con numerosos vasos sanguíneos, interpuesta entre dos áreas de tejido muscular liso. El exocérvix presentó un epitelio estratificado formado por células isodiamétricas con núcleos ovoidales.
En la región de transición entre cérvix y útero se observaron fibras colágenas subepiteliales y alrededor de los vasos sanguíneos. La inmunolocalización de la α-actina de músculo liso permitió distinguir las dos capas de la túnica muscular del útero, tanto en cuernos como en cérvix. En la región del estroma se presentó marcando la túnica muscular de los vasos sanguíneos. No se observó reacción PAS positiva a nivel del epitelio de revestimiento o glandular.
DISCUSIÓN
La identificación de las fases del desarrollo uterino favorece estudios comparativos y su aplicación biomédica (Yamaguchi et al., 2021). En las etapas fetales analizadas se observaron resultados de procesos de organogénesis e histogénesis uterina que indican un avanzado desarrollo prenatal en comparación con otras especies de roedores y mamíferos domésticos (Cooke et al., 2013; Kelleher et al., 2019).
En el ratón, el útero del recién nacido consiste en un epitelio simple rodeado por un mesénquima indiferenciado que carece de glándulas endometriales (Goad et al., 2017). El epitelio uterino exhibe un patrón dorsoventral (mesometrial-antimesometrial) de diferenciación tisular posnatal desde el día 3. Al día 5, el mesénquima se ha desarrollado en tres capas separadas: el estroma endometrial de orientación radial, la capa de miometrio circular interna y la capa longitudinal externa. Al día 15, la histoarquitectura del útero se ha desarrollado en su forma madura con capas endometriales y miometriales (Vue y Behringer, 2020). Por otro lado, las variaciones en la morfología de la luz uterina observadas en el coipo fueron observadas en los ratones en etapas posnatales; así, el lumen es liso entre los días 8 y 11, e irregular al día 21 (Vue y Behringer, 2020).
La rata solo presenta diferenciado su epitelio luminal al nacimiento, mientras que la diferenciación del tejido muscular y del epitelio glandular ocurre en la etapa postnatal (Hu et al., 2004). Brody y Cunha (1989) analizaron el desarrollo del miometrio en ratón y rata con técnicas histológicas e inmunoci- toquímicas con α-actina, -vimentina y -laminina encontrando que las células mesen-quimales uterinas se orientaron al azar durante el periodo fetal tardío; en tanto que en el periodo neonatal temprano se pudo reconocer tres capas mesenquimales: la del medio (miometrio circular prospectivo) desarrolló una orientación circular distinta y se diferenciaron en una capa compuesta de células de músculo liso positivas para actina, las células de la capa interna mostraron inicialmente una orientación radial, y las capa longitudinal externa se diferenciaba en haces de células de músculo liso que representaban el miometrio longitudinal. La capa mesenquimatosa interna permaneció positiva para vimentina y se diferenciaba en el estroma endometrial ordenado al azar.
En el caso del cerdo, la histogénesis uterina comienza en la vida prenatal y se completa en la etapa posnatal (Franke Radowiecka et al., 2019). En esta especie, los eventos morfogenéticos en los primeros 60 días de vida incluyen la aparición y proliferación de glándulas uterinas, el desarrollo de pliegues endometriales y el crecimiento del miometrio (Spencer et al., 2019). En el gato doméstico, Prozorowska et al. (2019) señalaron dos etapas en el desarrollo del epitelio de la mucosa uterina; primero, el desarrollo del epitelio del segmento uterino de los conductos paramesonefricos entre el día 33 y 42 del coito, y segundo, la diferenciación del epitelio de la mucosa uterina a partir de allí hasta el final del periodo prenatal.
La histogénesis uterina en el ovino involucra alteraciones morfogenéticas dinámicas, especialmente entre los días 80 y 130 de la vida fetal y la aparición de células musculares organizadas en una delgada capa a partir del tercio medio de gestación (Wiley et al., 1987). El lumen uterino es ovoidal y liso a los 55-60 dpc, apareciendo las primeras hendiduras en la superficie mucosa y bandas de células semejantes a las musculares lisas, alargadas y eosinofílicas entre los días 90 y 100 poscoito, profundizándose entre los días 100 y 110 poscoito (Wiley et al., 1987).
En el coipo, a diferencia de la rata (Branham et al., 1985) el ratón y el cerdo (Bartol et al., 1993), la transformación gradual de lo que se considera una histoarquitectura fetal a una madura ocurre entre el día 90 al 135 poscoito. Al igual que en el ovino, las células musculares aparecen durante la gestación, habiendo sido observadas a los 135 dpc. En humanos, Robboy et al. (2017) describen que entre las 8 a 9 semanas de gestación se observa una débil reactividad de la α-actina, indicativa de la diferenciación del músculo liso. Hacia las 11 a 12 semanas la α- actina se detecta de manera prominente en la región del cuello uterino, y todos los órganos del tracto reproductivo femenino muestran una fuerte reactividad de á-actina en la semana 20.
A diferencia de otros roedores, como la rata y el ratón (Branham y Sheehan 1995), y de animales domésticos, como el cerdo (Spencer et al., 2019) y la oveja (Padua, 2004), la adenogénesis uterina en el coipo ocurre en la etapa fetal (120 dpc).
CONCLUSIONES
En los fetos de 60 días poscoito (dpc) se observaron los conductos paramesonéfricos.
En los fetos de 90 dpc el útero presentó regionalización en cuernos, cuerpo y cérvix.
En los fetos de 120 dpc se distinguieron las túnicas mucosa, muscular y serosa. La túnica muscular presentó tres capas (muscular interna, vascular media y muscular externa).
En los fetos de 135 dpc, se distinguieron los tejidos epitelial, conectivo y muscular con una distribución similar al adulto.
Fueron identificados rasgos de adenogénesis en fetos de 120 y 135 dpc.












 uBio
uBio 

