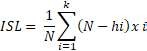INTRODUCCIÓN
El lenguado Paralichthys adspersus es una especie que se distribuye en las costas de Perú y Chile (Acuña y Cid, 1995). En el litoral peruano constituye un recurso de importancia económica por su alto valor comercial. Las investigaciones orientadas al desarrollo de la acuicultura de esta especie se iniciaron hace más de una década y actualmente se encuentra en los inicios de una proyección a escala piloto comercial. En estudios recientes se ha determinado la madurez gonadal para la especie (Cota, 2012; Perea et al., 2015), el acondicionamiento y maduración gonadal de reproductores en sistemas de recirculación de agua de mar (SRA) (Perea y Carrera, 2012; Carrera et al., 2013a), así como el seguimiento del crecimiento de juveniles en cautiverio (Carrera et al., 2017); la evaluación de varias microdietas en condiciones de laboratorio (Orihuela et al., 2018) y últimamente la densidad de cultivo durante la etapa larval (Castro et al., 2019). Sin embargo, aún son escasas las investigaciones sobre el control de su reproducción, la calidad de los desoves en cautiverio y los factores que involucran estos procesos.
El control de la reproducción representa el primer paso para alcanzar una acuicultura autosostenible (De Metrio et al., 2010) y para la obtención de semilla de calidad, que permita el desarrollo comercial de una especie en cultivo (Mylonas et al., 2010). Por ello, es importante identificar posibles disfunciones que pueda causar el cautiverio sobre el proceso de reproducción, tal y como ha sido observado en peces silvestres o nacidos en cultivo, lo cual se atribuye a las alteraciones del ambiente o por la presencia de algún agente que interfiera con el funcionamiento normal del proceso reproductivo (Mylonas y Zohar, 2001, 2007; Mylonas et al., 2010, 2013).
Se conoce que las hembras de peces planos sufren la ausencia de la maduración final de los ovocitos (Berlinsky et al., 1997; Larsson et al., 1997) o ausencia de desove (Kjorsvik et al., 1990; Rasines et al., 2012). La estrategia más común para solucionar estos problemas son los tratamientos con hormonas exógenas, como por ejemplo análogos de la hormona liberadora de gonadotropina (GnRHa), análogos de la hormona luteinizante liberadora (LHRHa), extracto de hipófisis de carpa (CPE) y gonadotropina coriónica humana (HCG) (Zohar y Mylonas, 2001; Mylonas y Zohar, 2001; Sampaio et al., 2008; Valdebenito, 2008). Al respecto, las terapias hormonales basadas en el tratamiento con GnRHa se han utilizado para controlar alteraciones del proceso reproductivo como: ausencia del desarrollo gonadal, ausencia de la maduración final de los ovocitos y la falta de desoves en varias especies de teleósteos (Mañanos et al., 2009). Asimismo, ha sido aplicada con éxito en algunos peces planos como Paralichthys lethostigma (Smith et al., 1999; Watanabe et al., 1999), Scoph-talmus maximus (Mugnier et al., 2000), Solea solea, Solea senegalensis (Bertotto et al., 2006; Guzmán et al., 2009; Rasines et al., 2012), entre otros.
En tal sentido, el objetivo del presente trabajo fue inducir la ovulación y posterior desove de hembras de Paralichthys asdpersus, capturadas del medio natural y acondicionadas al laboratorio, utilizando una hormona análoga a la gonadotropina (GnRHa), realizando la fecundación artificial y la evaluación de la calidad de los huevos y larvas.
MATERIALES Y MÉTODOS
Manejo de Reproductores
Los ejemplares de lenguado Paralich- thys adspersus fueron capturados del ambiente natural para su acondicionamiento en las instalaciones del Laboratorio de Cultivo de Peces del Instituto del Mar del Perú (IMARPE). En el laboratorio los peces fueron colocados en tanques circulares de fibra de vidrio de 2.5 m3 conectados a sistemas de recirculación de agua de mar (SRA), con una tasa de recambio diario del 300%/día y un flujo de 750 L/h (Carrera et al., 2013). La densidad de cultivo promedio fue de 6.15 kg/m2; es decir, 10 peces por tanque de cultivo, distribuidos en 4 tanques (S3T1, S3T2, S4T1 y S4T2), con un peso promedio de 1.4 kg. La temperatura estuvo entre 15 y 17 °C con un fotoperiodo de 10:00 h de oscuridad y 14:00 h de luz. Los ejemplares fueron sexados y mar- cados con microchips Passive Integrated Transponders (PITS, HDI Chip International, Holanda) para el seguimiento de su condición física y madurez gonadal (Carrera et al., 2013). Se hizo el seguimiento diario de los parámetros fisicoquímicos de calidad del agua como temperatura, oxígeno disuelto y pH con un multiparámetro Thermo Scientific™ Orion™ Star A329 y semanalmente de productos nitrogenados como nitrógeno amoniacal total (LM3304), nitrato (LM3319), nitrito (LM3352) y dióxido de carbono (LM7297) con kits colorimétricos LaMotte®.
Alimentación
Se realizó en base a trozos de anchoveta, a una tasa de 2.5% de la biomasa total de cada tanque de cultivo, suministrándose de manera interdiaria y en una ración al día, durante el periodo de mayor intensidad de luz (13:00 h). La alimentación fue complementada con cápsulas que contenían vitaminas C (Ácido ascórbico, Sigma-Aldrich®) y E (á- Tocopherol Merk®).
Maduración Gonadal
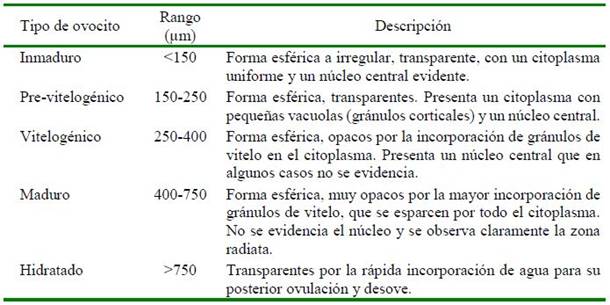
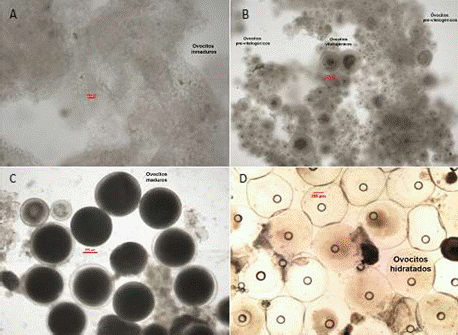
En los muestreos periódicos de los peces acondicionados en el SRA, se seleccionaron hembras con base al seguimiento de la madurez gonadal en dos periodos: el primero en 2014 (julio, setiembre, octubre y diciembre) y el segundo en 2015 (abril, junio, julio y agosto). Las muestras de ovocitos se obtuvieron por biopsia ovárica usando cánulas estériles de polipropileno (Mylonas et al., 2010; Perea y Carrera, 2012), se midió el diámetro de 30 ovocitos por cada hembra, y se clasificaron según sus características morfológicas (Cuadro 1, Figura 1) de acuerdo con la escala de madurez gonadal del lenguado planteada por Cota (2012) y Perea et al. (2015). Para esto, se utilizó un microscopio óptico LEICA® con una cámara digital incorporada utilizando el software de medición LAS 4.3.
Para el caso de los machos, se colectó una muestra de semen mediante masaje abdominal para evaluar la calidad espermática en base a la concentración y motilidad (Carrera et al., 2013).
Inducción Hormonal
Se seleccionaron hembras en estadio III de maduración (7 en 2014 y 6 en 2015), con promedio de ovocitos mayores a 500 µm. Se les aplicó una dosis intraperitoneal de 0.1 ml/kg equivalente a 1 µg/kg de pez, de un análogo sintético de la hormona liberadora de gonadotropina (GnRHa), acetato de buserelina (Pyr-His-Trp-Ser-Tyr-D-Ser- (But)-Leu-Arg-Pro-NHEt), Conceptase®. En los machos se seleccionaron ejemplares con una motilidad espermática mayor al 50% y una concentración promedio de 0.84 x 1010 espermatozoides/ml, sin necesidad de realizar inducción hormonal.
Desove, Fecundación e Incubación
A las 48 h de la inducción hormonal y a temperatura de 16.8 ± 0.7 °C, las hembras mostraron la cavidad abdominal abultada con signos de una hidratación avanzada (IV desovante). Los peces fueron trasladados a un tanque de menor tamaño, que contenía agua de mar con el anestésico Tricaine-S (MS-222 - Metasulfonato de tricaína) a una concentración de 80 mg/l para sedar y facilitar la manipulación siguiendo protocolos de ética animal. Se aplicó una presión abdominal o «stripping» a las hembras para obtener los ovocitos y fueron colectados en vasos de precipitado de 500 ml. Se determinó el peso de los ovocitos colectados y fueron conservados a 5 °C.
Se utilizaron dos machos por cada hembra para la fertilización. El semen de los machos se obtuvo igualmente aplicando el «stripping» a nivel abdominal y colectando las muestras en jeringas de 1 ml y conservándolas a 5 °C.
Ambos productos sexuales se mezclaron en seco a razón de 1 ml de esperma por cada 100 g de ovocitos en los vasos de precipitado. Luego de 5 min los huevos fecundados fueron transferidos a una probeta de 1 L con agua de mar esterilizada por radiación ultravioleta (UV), dejándose en reposo por 30 min. Posteriormente, los huevos viables (huevos flotantes) fueron recuperados y transferidos a tanques cónicos de 150 L, a una densidad de 150 huevos/L en sistema estático. El periodo de incubación fue de 48 h a una temperatura de 18.03 ± 0.13 °C.
Parámetros de Desove
El número de huevos totales se obtuvo a partir de una muestra de 1 g de huevos de los cuales se contabilizó el número de huevos por gramo, para luego extrapolar al peso total obtenido. Asimismo, se midió el diámetro de los huevos, la gota oleosa y las larvas recién eclosionadas con un microscopio óptico con cámara digital incorporada, utilizando el programa de imágenes LAS 4.3. Además, se determinó la fecundidad relativa con la fórmula Fecundidad Relativa = (Número de huevos / kg de pez).
Parámetros de Calidad de Huevos y Larvas
Se calculó el porcentaje de fecundación, porcentaje de eclosión, índice de supervivencia larval (ISL) y la tasa de mortalidad del día 3 (MA3) de acuerdo con Shimma y Tsujigado (1981). Para el porcentaje de fecundación, una hora después de realizada la mezcla de gametos se tomaron tres muestras de 50 huevos, colocadas en placas Petri con agua de mar UV. Se observó al micros- copio y se contabilizó el número de huevos que se encontraban al inicio de la división celular de 2-64 blastómeros. En forma similar, se utilizaron muestras de 50 huevos por triplicado para determinar el porcentaje de eclosión, donde los huevos fueron incubados en vasos precipitados de 1 L con agua de mar UV, luego de 48 horas ocurrió la eclosión y se contabilizó el número de larvas recién eclosionadas o nacidas (Aristizabal et al., 2009).
Porcentaje de fecundación = (N° de huevos con 2-64 blastómeros / N° total de huevos) x 100
Porcentaje de eclosión = (N° larvas vivas / [N° larvas vivas + N° larvas muertas + N° huevos remanentes]) * 100.
Para determinar el Índice de Supervivencia Larvaria (ISL), se colocaron en tres vasos de precipitado de 1 L con agua UV a 30 larvas por vaso y diariamente se contabilizó el número de larvas muertas. El cálculo se hizo de acuerdo con la fórmula:
donde: N = Número total de larvas; hi = Mortalidad acumulada en i-th; k = número de días transcurridos hasta que todas las larvas mueren debido a la inanición. El ISL también indica la mortalidad acumulada al día tres después de la eclosión.
Composición Bioquímica de los Huevos
Se tomaron muestras de 5 g de huevos de cada desove en ambos periodos, las cuales fueron enjuagadas con agua destilada y colocadas en tubos Falcón de 50 ml y conservadas a -80 °C en una ultra congeladora. Los análisis de proteínas, carbohidratos, lípidos y ácidos grasos se hicieron en el Laboratorio de Análisis Instrumental del IMARPE. Las proteínas totales se estimaron mediante el método de Hartree (1972), el total de carbohidratos mediante el método espectrofotométrico usando la glucosa como estándar (Dubois et al., 1956) y los lípidos totales por el método de Folch-Lee (Folch et al., 1957), para luego derivatizarlos mediante una reacción de transesterificación usando HCL al 8% en metanol como catalizador y llevarlos a las pruebas de cromatografía de gases para la identificación de ácidos grasos (Ichihara y Fukubayashi, 2010).
Análisis Estadístico
Los análisis estadísticos se realizaron con el programa estadístico R (R Core Team, 2019). La normalidad de los datos fue verificada mediante la prueba de Shapiro-Wilk y la homogeneidad de varianzas mediante una prueba de Levene. Se estableció un nivel de significancia de p 0.05 y se correlacionó la fecundidad relativa y los porcentajes de fecundación y eclosión con el ISL, MA3 a través del test de Pearson.
RESULTADOS
Desoves
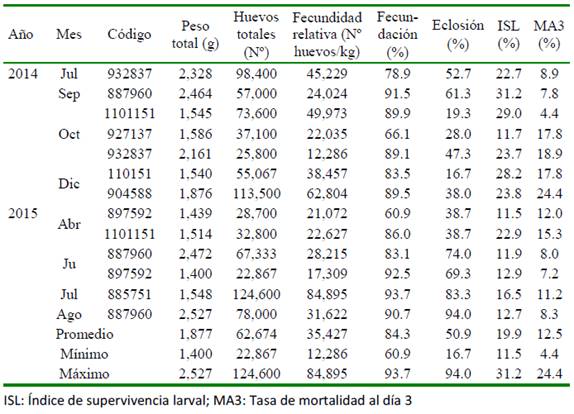
Las hembras en maduración avanzada seleccionadas para la inducción hormonal presentaron ovocitos de tamaño promedio de 542.61 µm. Todas las hembras desovaron y tuvieron un periodo de latencia entre 45 y 48 h a una temperatura promedio de 16.46 ± 0.06 °C. En el Cuadro 2 se muestra los ejemplares que desovaron en cada grupo y los parámetros determinados en cada desove.
Los mayores valores de fecundación se observaron en los meses de julio y diciembre de 2014 y en julio y agosto de 2015. Por otro lado, el porcentaje de fecundación fue superior al 70% en todos los meses de ambos periodos. Los huevos fecundados presentaron un diámetro de 858.0 ± 5.9 µm y de la gota oleosa de 168.8 ± 5.3 µm. Se caracterizaron por ser esféricos, transparentes y pelágicos. La eclosión ocurrió 48 h posteriores al desove a una temperatura de 18.03 ± 0.13 °C. Los mayores porcentajes de eclosión se observaron en los meses de julio y setiembre en 2014 y de julio a agosto en 2015. Las diferencias entre la fecundidad relativa, porcentajes de fecundación y eclosión de los desoves agrupados por meses se muestran en la Fi- gura 2.
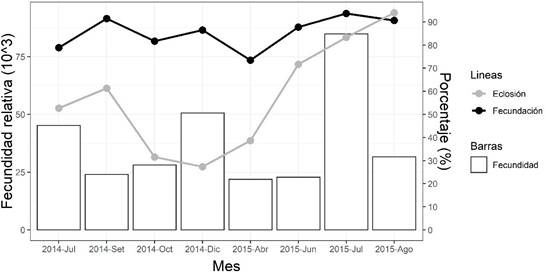
Figura 2 Fecundidad relativa, porcentaje de fecundación y eclosión de los desoves de Paralichthys adspersus con un análogo de GnRH según los meses
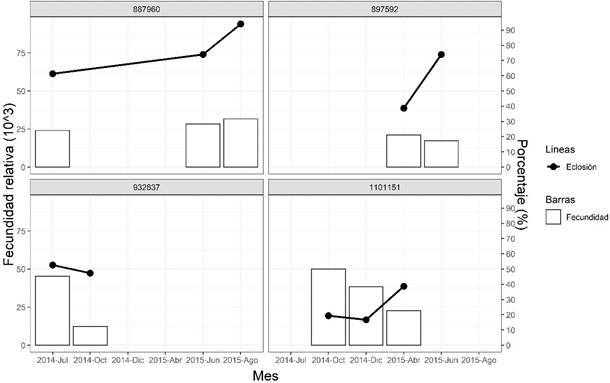
Figura 3 Parámetros de desove de cuatro hembras Paralichthys adspersus inducidas hormonalmente con un análogo de GnRH en los periodos de 2014 y 2015
Cuadro 3 Correlación de Pearson entre los parámetros de calidad de huevos y el índice de supervivencia larval (ISL) y mortalidad acumulada al día 3 (MA3) de los desoves de Paralichthys adspersus

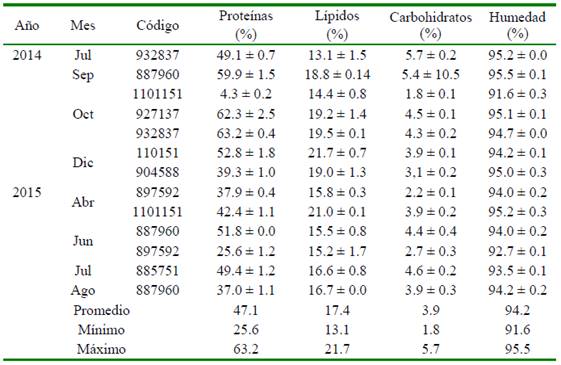
Cuadro 4 Composición bioquímica de huevos de los desoves de Paralichthys adspersus con un análogo de GnRH en los periodos 2014 y 2015
En la Figura 3 se observan los parámetros de desoves de cuatro hembras que tuvieron más de un desove. En la mayoría de los casos la fecundidad relativa disminuyó con el progreso de los meses; sin embargo, el porcentaje de eclosión aumentó.
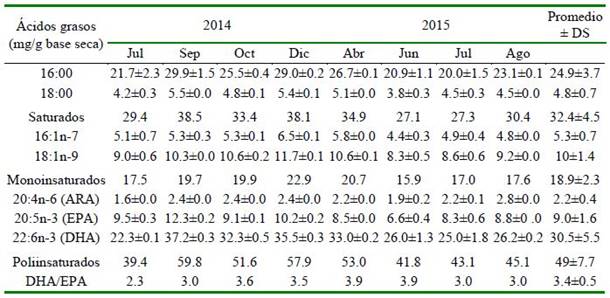
Cuadro 5 Perfil de ácidos grasos de huevos de los desoves con GnRHa del periodo del 2014 y 2015 de Paralichthys adspersus
El ISL indica que las larvas de P. adspersus sobreviven a la inanición hasta un máximo de 11 días después de la eclosión. El valor más alto de ISL para 2014 se presentó en el mes de setiembre y en 2015 en abril. Asimismo, la MA3 presentó los valores más altos en octubre (13.7%) y diciembre (21.1%) de 2014 y en abril (13.7%) de 2015, lo cual coincide con los meses en que se presentó los porcentajes de eclosión más bajos (31.6 y 27.3% en octubre y diciembre de 2014, respectivamente y 38.7% en abril de 2015). En el Cuadro 3 se muestran las correlaciones de Pearson (r) entre la fecundidad relativa, porcentaje de fecundación y eclosión con los índices ISL y MA3. Si bien los mayores valores de r correspondieron entre el porcentaje de eclosión con el ISL (valor positivo) y entre el porcentaje de eclosión y el MA3 (valor negativo); sin embargo, no fueron significativos (p>0.05).
Composición Bioquímica de los Huevos
Los resultados de los análisis de la composición bioquímica de los huevos se observan en el Cuadro 4. En relación a las proteínas, se encuentran en un rango entre el 37 y 62% (a excepción de junio del 2015 donde la hembra con código 897592 muestra un valor de 25.6 ± 1.2), los lípidos varían entre 13 y 19% y los carbohidratos entre 2.2 y 5.7%. Información necesaria para la formulación y elaboración de dietas para reproductores de la especie.
La abundancia relativa de los ácidos grasos (mg/g de muestra seca) se observa en el Cuadro 5. Se encontró una predominancia de los ácidos grasos poliinsaturados, seguido de los ácidos grasos saturados y monoinsaturados. El DHA (ácido docosa- hexaenoico, 22:6n-3) fue el más abundante de los ácidos grasos poliinsaturados, seguido del EPA (ácido eicosapentaenoico, 20:5n-3) y ARA (ácido araquidónico 20:4n-6). La relación de DHA: EPA fue 3.4 ± 0.5.
DISCUSIÓN
La situación ideal es que los reproductores desoven espontáneamente, pero en condiciones de cautiverio este proceso se ve alterado por la falta de maduración final del ovocito y espermiación, o por la falta desincronización entre machos y hembras; sien- do la fertilización artificial una buena alternativa, donde los ovocitos ovulados y el esperma maduro son obtenidos por separado por presión abdominal, colocados en seco en un recipiente libre de contaminación (orina) y mezclados con la adición de agua de mar (Mylonas et al., 2010). Al respecto, el estrés de los reproductores a las condiciones de cautiverio tiene un efecto negativo en el acondicionamiento, maduración gonadal y en la calidad de huevos, lo cual se le conoce como disfunciones reproductivas. Esto puede ocurrir por la falta de liberación de la hormona luteinizante (LH) al final de vitelogénesis; siendo por ello utilizada la GnRHa en varias especies de peces. Una ventaja particular del uso de GnRHa es que se puede utilizar en peces con desarrollo ovocitario asincrónico o grupos sincrónicos, con ovocitos en diferen- tes estadios de maduración (Mylonas et al., 2013), como es el caso de lenguado P. adspersus. Entre las terapias hormonales, la GnRHa es la más utilizada por tener menor especificidad de especie y actuar a nivel del eje cerebro-pituitaria-gónada, estimulando la liberación de la LH endógena (Mylonas et al., 2010). Adicionalmente, la GnRHa puede administrarse en forma de bolo (inyección líquida) o en un sistema de liberación sostenida conocida como implante (Mylonas y Zohar, 2001). Esta aplicación hormonal se ha realizado con éxito en hembras con ovocitos mayores a 500 µm (Sarih et al., 2018), y en el caso de P. adspersus se ha utilizado para la inducción al desove.
Es importante mencionar que cada método de inducción tiene ventajas dependiendo de la especie (Fakriadis et al., 2018). Por ejemplo, en la corvina Argyrosomus regius, múltiples inyecciones de GnRHa fueron más ventajosas en comparación con los implan- tes, debido a un mejor control de la producción de huevos y repetibilidad de la respuesta (Mylonas et al., 2015). Asimismo, en Seriola dumerili se evaluaron los dos tipos de uso de la GnRHa para inducir al desove (Mylonas et al., 2004; Fernández-Palacios et al., 2013). En el presente estudio con P. adspersus se utilizaron inyecciones de GnRHa obteniendo desoves en los dos periodos de experimentación.
Respecto a la dosis de GnRHa (1 µg/kg de pez), los desoves ocurrieron en un periodo de latencia entre 45 y 48 h posteriores a la inyección, con una temperatura de 16.46 ± 0.1 °C. En Solea senegalensis con dosis de 25 µg/kg de GnRHa ([des-Gly10, D-Ala6]- LH-RH-ethyl-amide) (Sigma) se reporta la ovulación a las 41-44 h después del tratamiento, con una temperatura de 16 °C (Rasines et al., 2012). En Paralichthys lethostigma se usaron tres concentraciones (5, 25 y 50 µg/ kg de pez) de un análogo a la hormona liberadora luteinizante de mamíferos (sGnRHa), produciendo desoves a las 54-58 h (Wright-Moore et al., 2019). Asimismo, en Seriola dumerili, múltiples desoves ocurrieron después de un periodo de latencia de 43.1 ± 2.5 con inyecciones de GnRHa (20-25 µg/kg) (Fakriadis et al., 2018; Sarih et al., 2018).
En los peces se define la calidad del huevo como la capacidad para desarrollarse y producir embriones viables (Reading et al., 2018). Esta capacidad se ve afectada por factores que incluyen el estado nutricional, estrés, sobre-maduración del huevo, tipo de hormona para inducción al desove, la genética y la edad de los reproductores; además de otros factores como la calidad del agua y ambientales como fotoperiodo, temperatura y salinidad (Bobe y Labbe, 2010; Mylonas et al., 2010; Jia et al., 2014). Los indicadores más usados para determinar la calidad del huevo son las tasas de fertilización y eclosión, así como la morfología, flotabilidad y tamaño del huevo, distribución de gotas de lípidos y morfología anormal de blastómeros (Aristizabal et al., 2009; Jia et al., 2014). Jia et al. (2014) reportó en desoves naturales de turbot Scophthalmus maximus de origen silvestre los mayores valores de fertilización (90.74 ± 1.01%) y eclosión (76.49 ± 3.29%) a mitad de la temporada reproductiva, pero con grandes variaciones durante todo el periodo. Sin embargo, en el presente estudio se obtuvo 84.3% de fertilización y 50.9% de eclosión en ambos periodos de experimentación. Por otro lado, en Solea senegalensis se reportó 36.7 ± 4.5 y 18.5 ± 3.6% de fertilización y eclosión, respectivamente (Rasines et al., 2012); y en Seriola dumerili entre 81.6 y 98.9 de fertilización y entre 33.3 y 100.0% de eclosión (Fernández-Palacios et al., 2013).
La cantidad de huevos producidos por hembra por inducción hormonal con GnRHa depende de las concentraciones utilizadas. Así, Wright-Moore et al. (2019) reportaron para Paralichthys lethostigma 128 000 huevos a 5 µg/kg, 61 100 a 25 µg/kg y 40 600 a 50 µg/kg con fecundidades relativas de 95 400, 26 700 y 7800 huevos/kg, respectivamente. El mayor número de huevos producidos en P. adspersus fue de 124 600 y la mayor fecundidad relativa fue de 84 895 huevos/kg a una dosis de 1 µg/kg.
En relación a la composición bioquímica de huevos y larvas como indicador de calidad, las proteínas cumplen un papel importante en la fertilización y en el desarrollo normal del embrión, y los aminoácidos libres son indispensables como combustible metabólico para las larvas (Ceccon et al., 2012). Asimismo, la composición de lípidos y ácidos grasos en el alimento de los reproductores permite la reproducción y supervivencia exitosas de la descendencia (Izquierdo et al., 2001); teniendo importancia el perfil de los ácidos grasos esenciales como DHA, EPA, ARA y sus proporciones (Ceccon et al., 2012), por lo cual deben ser considerados (Sargent et al., 2002). El DHA juega un papel importante como componente estructural de las membranas celulares, especialmente en los procesos de sinaptogénesis y retinogénesis durante el desarrollo embrionario en peces (Sargent et al., 2002; Tocher, 2010). Además, la relación DHA/EPA conduce a un equilibrio adecuado en la composición estructural de las células, pudiendo afectar el desarrollo del embrión y supervivencia de la larva (Furuita et al., 2002).
En el hirame (Paralichthys olivaceus), Furuita et al. (2000) reportaron que los huevos presentaron valores de ARA 0.6 ± 0.1, DHA 8.2 ± 0.6, EPA 6.9 ± 1.0% del total de ácidos grasos y una relación DHA/EPA de 1.2 ± 0.1% a partir de reproductores alimentados con un nivel 2.1 g/100 g dieta de ácidos grasos. Asimismo, en esta misma especie, reproductores alimentados con dietas con una relación de DHA/EPA de 1.2, 1.6 y 1.5%, obtuvieron valores de ARA 1.0 ±0.2, 0.9 ± 0.3 y 0.9 ± 0.2, EPA 6.7 ± 0.5, 8.1 ± 1.0 y 11.7 ± 0.3; DHA 9.4 ± 0.7, 11.9 ± 2.4 y 13.4 ± 1.1% del total de ácidos grasos y una relación DHA/EPA 1.4 ± 0.1, 1.5 ± 0.4 y 1.2 ± %, respectivamente (Furuita et al., 2002).
En turbot se obtuvo para huevos producidos por desoves naturales valores de proteína 12.7 ± 0.7%, lípidos 20.6 ± 0.8% y carbohidratos 9.4 ± 0.3%, y con respecto a los ácidos graso (g/kg de peso seco): EPA 7.6 ± 0.5, DHA 29.2 ± 0.6 y ARA 2.6 ± 0.1, y una relación DHA/EPA de 3.8 ± 0.3% (Jia et al., 2014). Asimismo, para la misma especie, Tong et al. (2017) determinaron que el DHA y EPA están estrechamente asociados con el crecimiento, desarrollo del cerebro y la función visual. En general, la relación DHA/ EPA varía entre 3:1 a 4:1 (Jia et al., 2014; Tong et al.,2017). La composición de ácidos grasos en huevos fertilizados de Liza rama- da por inducción hormonal (segunda dosis) obtuvieron DHA 0.4, EPA 2.5, ARA 0.2% del total de ácidos grasos, y una relación DHA/EPA de 0.1% (Fayez-Fahmy y Abdel- Baki, 2014). En el presente estudio, la composición de ácidos grasos de huevos de P. adspersus para DHA, EPA y ARA fue de 30.5 ± 5.5, 9.0 ± 1.6 y 2.2 ± 0.4 (mg/g en base seca, respectivamente), y la relación DHA/EPA de 3.4 ± 0.5, considerándose huevos de buena calidad para los desoves obtenidos por la inducción hormonal.
El ISL es un indicador potencial de calidad, porque determina la calidad de las reservas endógenas contenidas en el sacovitelino y el potencial de sobrevivencia intrínseca de la larva (Giménez et al., 2006). Este valor refleja la actividad de las larvas y es un indicador práctico en la producción de juveniles. En P. olivaceus varió de 15.3 a 30.9 (Furuita et al., 2000). Por otro lado, Furuita et al. (2001) reportan un MA3 de 80.4% e ISL de 27.1%, en tanto que Furuita et al. (2002) obtuvieron valores de MA3 entre 71.1 y 86.0% e ISL entre 40.3 y 59.7%, dependiendo de los niveles de ácidos grasos utiliza- dos en la dieta. En especies como el dentón común Dentex dentex y besugo Pagrus pagrus, Giménez et al. (2006) y Aristizabal et al. (2009), respectivamente, determinaron que el ISL fue similar entre desoves de alta y baja calidad. En el presente estudio se obtuvo un MA3 entre 4.4 y 24.2% con un ISL entre 11.5 y 31.0, lo cual indica la buena calidad de huevos y larvas, considerando que se encuentran dentro del rango de resultados que se presentaron en especies similares y otras.
Se puede concluir que la inducción hormonal con GnRHa permitió obtener huevos y larvas de calidad; sin embargo, se requiere considerar una dieta especie específica para reproductores que permita asegurar una buena calidad de la progenie y con ello lograr la producción de semilla sostenible en el tiempo.












 uBio
uBio