INTRODUCCIÓN
Los perros facilitan la trasmisión de al menos 65 zoonosis causadas por bacterias, protozoos, helmintos y artrópodos, siendo algunas de amplia distribución geográfica (Macpherson, 2013). Espacios públicos en las ciudades pueden fácilmente contaminarse con estadios parasitarios (huevos, larvas o quis- tes) eliminados con las heces de los perros (Macpherson, 2013; Simonato et al., 2019; Cociancic et al., 2020).
Las áreas contaminadas con heces de perros como calles, parques, áreas verdes, ciclovías, plazas, cajones de arena y playas son una fuente importante de patógenos parasitarios para la población de perros, para sus dueños y para la comunidad en general, afectando su salud, pudiendo significar un problema de importancia para la salud pública (Beck, 2000; Traversa et al., 2014). En Chile se han registrado cerca de 43 especies de parásitos en el perro, entre protozoos, platelmintos, nematodos y artrópodos (Alcaíno y Gorman, 1999), siendo 17 de ellas causantes de zoonosis, que son trasmitidas directa o indirectamente, mediante hospederos intermediarios o paraténicos a la población humana.
Se han efectuado diversas investigaciones con la finalidad de cuantificar la contaminación ambiental por la eliminación de excretas de perros en espacios públicos mediante el análisis de heces (Harvey et al., 2020), tierra (León et al., 2020), arena (Ristic et al., 2020) y césped (Malca et al., 2019), usándose métodos cualitativos/cuantitativos de sedimentación/flotación para la recuperación de los estadios parasitarios. En Chile se han realizado algunos estudios en muestras de heces colectadas en plazas y parques públicos en las ciudades de Los Ángeles (Luzio et al., 2015) y Temuco (Armstrong et al., 2011; Olivares et al., 2014), así como en playas de la comuna de Tomé (Luzio et al., 2013). De la misma manera, se registran estudios específicos sobre la detección de huevos de Toxocara canis en heces colectadas en plazas y parques de la ciudad de Santiago (Castillo et al., 2000) y en la localidad costera de Niebla (Vargas et al., 2016), así como en 13 ciudades situadas entre Arica y Punta Arenas (Mercado et al., 2004)
El amplio espectro de parásitos zoonóticos en perros de Chile (Alcaíno y Gorman, 1999) motivó el presente estudio, cuyo objetivo fue determinar la prevalencia de parásitos eucarióticos (huevos, larvas o quistes) y el número de huevos o larvas de helmintos por gramo de heces colectadas en calles de la zona urbana de dos localidades costeras en el sur del país.
MATERIALES Y MÉTODOS
Sitios de Estudio
El estudio fue realizado en las localidades costeras de Niebla (39°49´S y 73°22´O) y Corral (39°51´S y 73°24´O) en la provincia de Valdivia, Región de Los Ríos, en el sur de Chile. La población de perros en Niebla y Corral fue determinada en estudio previos, siendo de 363 (Boettcher, 2012) y 648 perros (Güttler, 2005), respectivamente. La población humana alcanza 2202 y 3670 personas en las localidades de Niebla y Corral, respectivamente (Instituto Nacional de Estadísticas, 2005). La temperatura ambiental en la región durante 2015 fue de 11.6 °C (6.3-17.9 °C), humedad relativa de 77.0% (57.7-90.3%) y precipitación anual de 1925 mm (Dirección General de Aeronáutica Civil, 2016). No se aplican medidas sanitarias para el recojo de heces en las calles de ambas localidades.
Muestras
Las muestras de heces fueron colecta- das en la zona urbana, transitable y habitada de Niebla y Corral en los meses de marzo y mayo de 2015, respectivamente. Las áreas muestreadas incluyeron 2 km en total de las calles primarias transitadas de cada localidad. En las zonas de recolección de mues- tras se midió en terreno la distancia de una calle y luego en un mapa a escala se determinó la distancia total de las calles investiga- das. La recolección se realizó por dos personas en forma simultánea. Cada persona, mediante inspección visual colectó las muestras observadas en cada lado del camino recorrido, sin incluir aquellas en proceso de desecación. Las muestras fueron recogidas manual- mente, utilizando guantes desechables, mediante el uso de doble bolsa de polietileno. Cada muestra fue numerada y ordenada según su procedencia en contenedores, manteniendo a 4 °C hasta su procesamiento.
Análisis de Laboratorio
Cada muestra en su doble bolsa fue homogenizada manualmente desde el exterior previo a su procesamiento. En cada muestra se aplicó una combinación (TMFL) de los métodos cualitativos de sedimentación de Telemann modificado y flotación con solución de sulfato de zinc pentahidratado (70 g de sulfato de zinc en 100 ml de agua) (Torres et al., 1972). Además, se utilizó el método cuantitativo de Knight (KN) (Knight et al., 1976) para el recuento de huevos y larvas de helmintos.
En el método TMFL se observaron dos preparaciones microscópicas en láminas portaobjetos cubiertas con una laminilla (22x22 mm) y teñidas con tionina de 0.1% para la técnica de sedimentación (100 y 400X), y una preparación sin tinción para la técnica de flotación. En el método de KN se observaron preparaciones microscópicas de la totalidad del sedimento (100X). Las mediciones de los estadios parasitarios se efectuaron mediante micrómetro ocular y para su identificación se utilizaron principalmente como referencia a Levine (1961), Mehlhorn et al. (1993) y Bowman (2009).
Análisis Estadístico
Se determinaron los porcentajes de prevalencia para cada taxón parasitario según la localidad. Para la comparación de proporciones de muestras positivas por cada taxón parasitario se aplicaron las pruebas exactas de Fisher y Chi cuadrado de Pearson mediante el programa EPI DAT 3.1 (Dirección Xeral de Saúde Pública de la Consellería de Sanidade, Xunta de Galicia, España/OPS- OMS). Para la comparación de la media de los distintos estadios parasitarios por gramo de heces determinados con el método de KN se usó la prueba de U Mann-Whitney para dos muestras con software libre Vassar Stat (http://vassarstats.net/index.html). En todas las pruebas se consideró a p<0.05 como estadísticamente significativa.
RESULTADOS
El 85.1 y 92.3% de las muestras colectadas en Niebla y Corral resultaron positivas a huevos, larvas, ooquistes o esporoquistes de uno o más taxones de parásitos eucarióticos, mediante la aplicación simultánea de los métodos de TMFL y KN, respectivamente, sin observarse diferencias significativas (p>0.05) entre localidades (Cuadro 1).
En las localidades en estudio se encontraron estadios de ocho taxones parasitarios (Cuadro 1; Figura 1), siendo los parásitos de mayor porcentaje de prevalencia Uncinaria stenocephala y Trichuris sp (Cuadro 1). La prevalencia de U. stenocephala fue mayor en Corral (p<0.05), mientras que aquella de T. canis resultó más elevada en Niebla (p<0.05) (Cuadro 1). En el caso de U. stenocephala, además de los huevos típicos en estado de mórula (Figura 1D), también se encontraron huevos larvados (Figura 1E) o larvas libres (Figura 1G), producto de su desarrollo en el ambiente. Igual situación sucedió en el caso de la presencia de huevos larvados de Capillariidae gen. sp (Figura 1J).
Cuadro 2 Recuento de huevos y larvas de nematodos por gramo de heces de perros, mediante el método de Knight et al. (1976) en muestras de heces colectadas en calles de las localidades costeras de Niebla y Corral, Chile
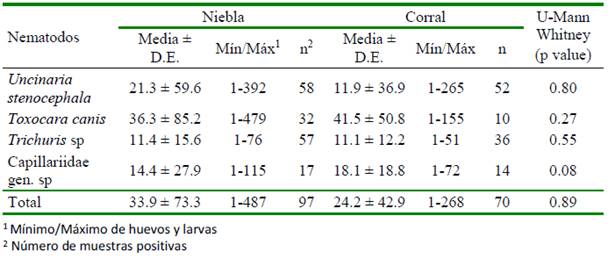
La aplicación del método de KN solo reveló la presencia de estados parasitarios correspondientes a seis taxones (U. steno- cephala, T. canis, Trichuris sp, Capillariidae gen sp, Taeniidae gen. sp, y C. canis) (Cuadro 2). La media de huevos o larvas por gramo de heces de cuatro taxones no mostró diferencias (p>0.05) entre localidades. Los huevos de Taeniidae gen. sp solo se observa- ron en una muestra de heces de cada localidad, con 4 huevos/g en Niebla y 7 huevos/g en Corral.
DISCUSIÓN
Más del 85% de las muestras de heces resultaron positivas a uno o más taxones parasitarios en las localidades de Niebla y Corral, mostrando una elevada contaminación ambiental con riesgo potencial para la población humana y canina. En estudios previos en Chile se determinaron prevalencias de 60 a 100% en muestras colectadas en plazas y parques de las ciudades de Los Angeles (Luzio et al., 2015) y Temuco (Olivares et al., 2014), así como en playas de la comuna de Tomé (Luzio et al., 2013).
En este sentido, en playas públicas del Municipio de Pelotas y en áreas aledañas a escuelas del mismo municipio (Rio Grande do Sul, Brasil) se determinó 59.0% (Ferraz et al., 2019), 39.8% (Antúnez et al.,2020) y 74.7% (Mello et al., 2020) de heces positivas a parásitos; mientras que en calles, parques infantiles, plazas y paseos costeros de Ushuaia (Argentina) y parques públicos en Mérida (México) se reportó 32.5% (Cociancic et al., 2020) y 11.0% (Medina- Pinto et al., 2018) de positividad, respectivamente.
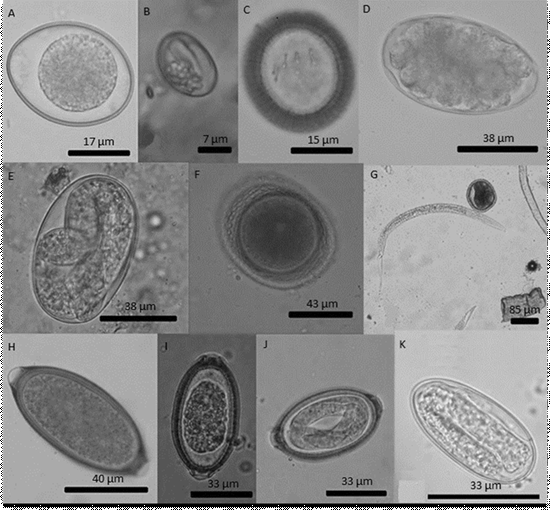
Figura 1 Estadios parasitarios identificados en muestras ambientales de heces de perro colectadas en calles de las localidades de Niebla y Corral, Chile. A. Ooquiste de Cystoisospora canis; B. Esporoquiste de Sarcocystis sp; C. Huevo de Taeniidae gen. sp, D. Huevo de Uncinaria stenocephala; E. Huevo larvado de U. stenocephala; F. Huevo de Toxocara canis; G. Huevo de T. canis y larva libre de U. stenocephala; H. Huevo de Trichuris sp; I. Huevo de Capillariidae gen. sp; J. Huevo larvado de Capillariidae gen. sp; K. Huevo larvado de Spirocerca sp
Los huevos y larvas de Uncinaria stenocephala fueron los estadios parasitarios más frecuentemente observados en el estudio. En Chile, los estudios en plazas y parques de las ciudades de los Ángeles (Luzio et al., 2015) y Temuco (Olivares et al., 2014), así como en playas de la comuna de Tomé (Luzio et al., 2013) revelaron 0.4, 69.6 y 0.9% de muestras con huevos de U. stenocephala, respectivamente. En la ciudad de Mar del Plata, Argentina, se encontró una positividad de 22.2% (Andresiuk et al., 2003); sin embargo, en Ushuaia, en el extremo sur del país, fue de 1.3% (Cociancic et al., 2020). U. stenocephala es la única especie del género que ha sido relacionada con el cuadro de larva migrante cutánea en conjunto con otras especies de la familia Ancylostomatidae (Acha y Szifres, 2003), registrándose un solo caso autóctono en Chile (González et al., 2015).
Respecto a T. canis, principal agente de toxocarosis humana o larva migrante visceral, el porcentaje de muestras positivas en la localidad de Niebla duplicó la cifra observada en Corral. En estudios similares realizados en Chile, se indican porcentajes de positividad de 33.3% (Castillo et al., 2000) y 66.7% (Luzio et al., 2015) en muestras de plazas y parques de la ciudad de Santiago; de 9.2% (Luzio et al., 2015) y 12.4% (Armstrong et al., 2011) en la ciudad de Los Ángeles, de 21.5% en la ciudad de Temuco (Olivares et al., 2014), de 22.9% en playas de la comuna de Tomé (Luzio et al., 2013), y de 15.6% en la zona urbana de Niebla en 2012 (Vargas et al., 2016), siendo esta última cifra casi duplicada en el presente estudio (29.9%). Mercado et al. (2004) en muestras de plazas y parques públicos en 13 ciudades de Chile, entre Arica y Punta Arenas, registraron entre 2.0 y 12.5% de positividad. En el presente estudio, la tasa de positividad a huevos de T. canis en Niebla es un reflejo de la alta seroprevalencia de toxocarosis humana (21.4%) encontrada en 2012 (Vargas et al., 2016). El cuadro de larva migrante visceral por Toxocara spp ha sido reportado en Chile en niños con serología positiva asociada a sintomatología pulmonar, hepática, neurológica, ocular y cutánea (Noemí et al,1992; Sánchez et al., 2011).
En Argentina, los porcentajes de positividad a huevos de T. canis, fueron de 9.2% en Mar del Plata (Andresiuk et al., 2003), 1.7% en Buenos Aires (Rubel y Wisnivesky 2010) y 5.0% en Ushuaia (Cociancic et al., 2020) . En Suba, Colombia se reportó una positividad de 5.4% (Polo- Teran et al., 2007). En plazas públicas del municipio de Pelotas, Brasil, fue de 1.7% (Antúnez et al., 2020) y de 11.9% en áreas circundantes a escuelas municipales de dicha ciudad (Mello et al., 2020), así como de 3.0-3.3% en otras localidades brasileras (Ferraz et al., 2019; Harvey et al., 2020). En México, se documentan prevalencias de 12.1- 52.3% en calles de Toluca (Romero-Núñez et al., 2013) y de 17.5-55.7% en calles de Nezahualcóyotl (Romero-Núñez et al., 2011).
En el presente estudio, el porcentaje de muestras con huevos de Trichuris sp (50.7- 54.8%) fue superior a lo observado en plazas y parques de las ciudades de los Angeles (0.8%) (Luzio et al., 2015) y Temuco (35.2%) (Olivares et al., 2014) y en playas de la comuna de Tomé (8.1%) (Luzio et al., 2013). En estudios similares, se reportan prevalencias de 24% en Mar del Plata (Andresiuk et al., 2003) y valores menores (1.3-2.6%) en Buenos Aires y Ushuaia (Rubel y Wisnivesky 2010; Cociancic et al., 2020). En playas de Rio Grande do sul y del municipio de Pelotas se reportaron positividades de 13.0% (Ferraz et al., 2019) y 4.5% (Antúnez et al., 2020).
Los huevos de Capillariidae gen. spp se encontraron en un 19.4 y 30.8% de heces colectadas en Niebla y Corral, respectivamente. En ciudades de Chile como Tomé (Luzio et al., 2013) y Temuco (Olivares et al., 2014) se reportaron 2.7 y 21.5% de positividad, respectivamente; asimismo, Torres et al. (1974) llegaron a identificar Pearsonema plica (=Capillaria plica) y Eucoleus aerophilus (=Capillaria aerophila) con prevalencias de 30.5 y 3.3%, respectivamente, en necropsias de perros en la ciudad de Valdivia. En Argentina se encontraron 0.8% de huevos de Capillaria spp en Mar del Plata (Andresiuk et al., 2003), mientras que fue de 0.2% en plazas públicas de Pelotas, Brasil (Antúnez et al., 2020).
Los huevos de Spirocerca sp se observaron en bajo porcentaje, tal y como fue observado en la provincia de Chubut (Argentina) con 2.4-4.3% (Sánchez et al., 2003) y en Suba (Colombia) con 0.3% (Polo-Terán et al., 2007). En Chile solo se ha documentado Spirocerca sp en el zorro andino, Licalopex culpaes (Oyarzún Ruiz et al., 2020), en tanto que en Perú, en la misma especie se identificó Spirocerca lupi (Gómez- Puerta et al., 2018).
Huevos de especies de la familia Taeniidae fueron registrados en el 0.7 y 4.8% de las muestras obtenidas en Niebla y Corral, respectivamente. Reportes en Chile mencionan frecuencias de 1.5-1.8% (Luzio et al., 2013, 2015) y de 11.4% (Armstrong et al., 2011), mientras que en Argentina se han re- portado frecuencias de 0.6% (Rubel y Wisnivesky 2010) y 2.5% (Cociancic et al., 2020). En perros de Chile se han identificado tres especies: Taenia serialis, T. multiceps y Echinococcus granulosus (Alcaíno y Gorman, 1999), siendo esta última la de mayor importancia por causar hidatidosis humana. En la Región de Los Ríos se han registrado incidencias de 3.6-8.4 casos de hidatidosis por 100 000 habitantes y una letalidad de 1.3% para el periodo 1999-2009 (Acosta-Jamett et al., 2016).
Los porcentajes de Cystoisospora canis en muestras de Niebla (3.0%) fueron similares a los registrados para Cystoisospora spp en playas de Tomé, Chile (3.6%) (Luzio et al., 2013). En Brasil, en infecciones por especies no identificadas de Cystoisospora, se encontró 4.0% (Ferraz et al., 2019) y 2.2% (Harvey et al., 2020) en muestras de la playa de Sao Lorenzo y en el municipio de Ilheus, respectivamente. Por otro lado, la frecuencia de esporoquistes de Sarcocystis sp en Niebla fue de 1.5% y en corral de 3.8%, mientras que en Suba, Colombia fue de 0.1% (Polo- Teran et al., 2007) y en la zona de Ilheus, Brazil de 1.9% (Harvey et al., 2020).
La mayor parte de resultados sobre huevos por gramo de heces están enfocados principalmente a T. canis. En un estudio previo se encontró en la localidad de Niebla promedios de 11.3 y 8.4 hpg en las zonas rural y urbana, respectivamente (Vargas et al., 2016), lo que indica valores cuatro veces mayores que en el presente estudio. Asimismo, en calles de Nezahualcóyotl y Toluca (México) se observaron promedios de 6.1- 8.9 (Romero-Núñez et al., 2011) y de 4.1- 11.4 (Romero-Núñez et al., 2013) huevos de Toxocara por gramo de heces, respectivamente.
Los resultados sugieren adoptar medidas de prevención para el control de los parásitos identificados, en especial en lo referente a tenencia responsable de mascotas y su periódico tratamiento antiparasitario. En encuestas realizadas en Niebla (Boettcher, 2012) y Corral (Güttler, 2005) se constató que 51.2 y 68.2% de los perros no recibían atención veterinaria, respectivamente. Del mismo modo, es necesario reforzar el aseo periódico de las calles, evitando la permanencia de las heces de perros.
CONCLUSIONES
En las localidades costeras de Niebla y Corral en el sur de Chile se registraron prevalencias de 85.1 y 92.3% de esta- dios parasitarios en heces de perro colectadas en calles del sector urbano, respectivamente.
En ambas localidades se observaron ocho taxones parasitarios (C. canis, Sarcocystis sp, Taeniidae gen. sp, U. stenocephala, T. canis, Spirocerca sp, Trichuris sp, y Capillariidae gen. sp) en las heces, con prevalencias más altas para U. stenocephala y Trichuris sp.
Se halló mayor prevalencia para huevos y larvas de U. stenocephala en Corral (p<0.05) y de huevos de T. canis en Nie- bla (p<0.05).












 uBio
uBio