INTRODUCCIÓN
Los micoplasmas hemotrópicos felinos constituyen un grupo de bacterias que pue- den causar anemia hemolítica en gatos (Roura et al., 2010; Tasker, 2010; Korman et al., 2012). Tres hemoplasmas han sido descritos causando infecciones en gatos domésticos y salvajes, Candidatus Mycoplasma haemo- minutum, Candidatus Mycoplasma turicensis y Mycoplasma haemofelis, siendo este último el microorganismo más patogénico (Santos et al., 2014).
La micoplasmosis felina también conocida como anemia infecciosa felina o hemo- bartonellosis, es causada por una bacterias gram negativa extracelular pequeña (0.3 - 0.8 µm), con habilidad pleomórfica, que utilizan la superficie de los eritrocitos de varias especies de mamíferos para su supervivencia (Silva et al., 2020). Estas infecciones inducen hemolisis aguda asociada a episodios de anorexia, letargia, deshidratación y pérdida de peso (Willi et al., 2010), así como cuadros severos de anemia hemolítica en gatos inmunocompetentes, pudiendo llegar a causar la muerte del animal (Tasker et al., 2009; Vilhena et al., 2017). La ruta natural de trans- misión depende del vector artrópodo Ctenocephalides felis; sin embargo, la inoculación subcutánea de sangre que contiene microorganismos sugiere que la transmisión puede ser posible, además, por interacciones agresivas, transfusiones de sangre, y median- te transmisión vertical (Tasker, 2020).
La infección por Mycoplasma es usual- mente diagnosticada a través de la detección del microorganismo en la superficie del eritrocito en extendidos de sangre periférica coloreados con Giemsa y vistos bajo el microscopio (Inokuma et al., 2004); sin embargo, la observación microscópica por sí sola no es suficiente para confirmar el diagnóstico ya que pueden presentarse falsos positivos y negativos (Aklilu et al., 2016, Hawley et al., 2018). En años recientes, la técnica PCR (reacción en cadena de la polimerasa) se ha convertido en el método de elección para el diagnóstico del patógeno, dada su alta sensibilidad y especificidad (Korman et al., 2012, Molina y Pacheco, 2016).
MATERIALES Y MÉTODOS
Consideraciones Bioéticas
El estudio fue aprobado por el Comité de Bioética Animal y los procedimientos fue- ron realizados en las instalaciones del labora- torio Multifuncional del Programa Medicina Veterinaria y Zootecnia y en el laboratorio de Biología Molecular de la Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Colombia.
Tipo de Estudio y Población
Se realizó un estudio descriptivo de tipo corte transversal con la población felina aten- dida en la Unidad Móvil de Bienestar Animal del Bioparque Ukumarí, durante las campañas de esterilización realizada en la ciudad de Pereira en 2019 y 2020. Se tomó una población base de 104 felinos con un margen de error del 5% y un nivel de significancia del 95%, en base a otras prevalencias de la misma enfermedad halladas en Latinoamérica (Carvajal, 2012, González, 2014). Se tuvieron en cuenta variables como edad, sexo, estado de vacunación (si el felino estaba va- cunado frente a algún agente infeccioso) y zona geográfica de procedencia.
Como criterios de inclusión se tuvieron en cuenta felinos no castrados entre 1 y 10 años clasificados en tres grupos etarios (1, 2,
>3 años), pertenecientes a estratos socioeconómicos uno (bajo-bajo) y dos (bajo) de la ciudad de Pereira (Yunda, 2019), que corresponden a zonas con recursos económicos limitados, limitando su acceso a servicios veterinarios. Como criterios de exclusión se consideraron a felinos mayores de 10 años, castrados y/o con coagulopatías o enfermedades cardiacas de base.
Muestras
Las muestras de sangre se tomaron de la vena cefálica o yugular externa en el momento en que los pacientes se encontraban anestesiados para el procedimiento quirúrgico de esterilización. Las muestras se toma- ron mediante aspiración con jeringa emplean- do tubos de BD Vacutainer tapa lila pediátrico que contenían EDTA como anticoagulante. Las muestras fueron transportadas al laboratorio en neveras portátiles a una tempera- tura aproximada de 4 ºC. En el laboratorio se realizaron dos extendidos por cada muestra: uno para coloración de Wright y el otro para coloración con Giemsa, los cuales fueron analizados por microscopía de luz clara para de- terminar la presencia o ausencia del hemo- parásito. Además, se hicieron hemogramas de cada muestra en un analizador hematológico Urit Medical 2900Vet Plus.
Extracción de ADN y Cebadores
Se extrajo el ADN de las muestras de sangre con el QIAamp DNA Blood Mini kit (Qiagen) siguiendo las instrucciones del fabricante. A partir del ADN obtenido se realizó la amplificación del fragmento 16s ARN ribosomal de la bacteria Mycoplasma haemofelis str. Langford 1 (NCBI FR773- 153.2) empleando PCR convencional. Se emplearon los cebadores para la detección de Mycoplasma haemofelis descritos por Tasker et al. (2009). La expresión del gen constitutivo gliceraldehído 3-fosfato deshidrogenasa felino fue usado para normalizar la expresión de los datos de cada muestra, los cebadores para el GADPH felino fueron descritos por Leute-negger et al. (1999) (Cuadro 1). Los cebadores se alinearon con base en las secuencias re- portadas en el sitio web GenBank NCBI (National Center for Biotechnology Infor- mation). Se empleó como control positivo ADN de Mycoplasma del kit comercial Mycoplasma PCR detection kit (Applied Biological Materials - abm) y como control endógeno del proceso GAPDH felino (NCBI NM 001009307.1) (Cuadro 1).
PCR
Para la PCR convencional se emplea- ron las siguientes concentraciones: 50 ng/µl de ADN genómico, 2.0 mM MgCl2 (Promega), buffer PCR 1x (Promega), 0.2 mM dNTPs, 0.2 µmol de cada cebador (Sigma), 1.5 UI de Taq Polimerasa (Thermo Scientific) en un volumen final de 25 µl de reacción bajo las siguientes condiciones: desnaturalización inicial 94 °C por 5 min, desnaturalización 94 °C por 30 s, hibridación 57 °C por 1 min, extensión 72 °C por 1 min, extensión final 72 °C por 5 min. Para la visualización de los productos de PCR se empleó como agente revelador SYBR green (Invitrogen). Los amplificados obtenidos se corrieron en geles de agarosa al 2%, y fue- ron observadas en un sistema documentador de geles Doc Rx (Bio Rad).
Análisis de Datos
Se determinó la frecuencia de animales infectados y se realizó una descripción esta- dística de los datos hematológicos según pro- cedencia, grupo etario y sexo. Todos los da- tos fueron sometidos a pruebas de normalidad y homocedasticidad, y una vez cumplidas las premisas se procedió con los análisis de correlación utilizando las pruebas Chi cuadrado y t test (p<0.05). Para todos los análisis se empleó el Statistical Analysis Software.
RESULTADOS
El 80.7% (84/104) de los gatos muestreados fue positivo para Mycoplasma haemofelis usando PCR convencional del fragmento 16s del ARNr con la amplificación de un fragmento de 79 pb de longitud (Figura 1).
En las láminas coloreadas con Giemsa se encontró una positividad para M. haemofelis similar a la hallada por PCR (80.7%; 84/104), en tanto que con la coloración de Wright fue de 81.7% (85/104); es decir, se encontró una correlación significativa (p<0.01) entre el diagnóstico por PCR y por el examen citológico. En el examen se pudo observar al interior de los glóbulos rojos y a nivel epicelular cuerpos redondos basófilos, algunas veces en forma de anillos o bastón de 0.5-3 µm (Figura 2).
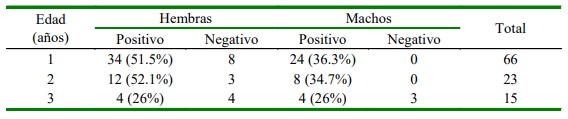
Del total de animales muestreados, 59.6% fueron hembras y 48.4% machos, obteniendo una prevalencia de infección para hembras de 88% (50/62) y para machos de 85% (36/42); sin embargo, no hubo correlación entre el género del felino y la presencia del parásito; tampoco se observó correlación entre el estado de vacunación ni el estrato socioeconómico con la presencia del parásito. Por otro lado, se evidenció una correlación significativa (p=0.0038) de la edad con la infección como un factor de riesgo asocia- do en esta zona del país, siendo los felinos entre 1 y 2 años de edad los que presentaron la mayor prevalencia del parásito (Cuadro 2).
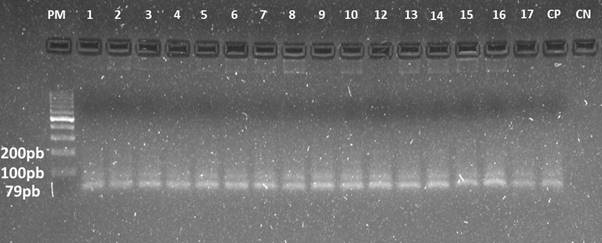
Figura 1 Electroforesis en geles de agarosa del producto de PCR que muestra un tamaño de banda esperado de 79 pb para Mycoplasma haemofelis (1-17), CP: control positivo, CN: control negativo, PM: marcador de peso molecular 100pb
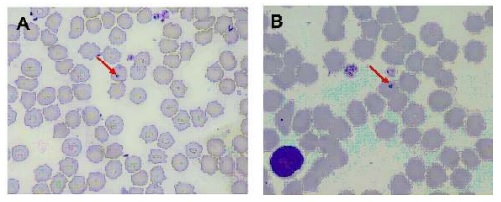
Figura 2 Micrografía de extendidos de sangre periférica de felinos (100x). A. Coloración de Wright B. Coloración de Giemsa. Las flechas rojas indican la presencia de estructura basófila periférica compatible con Mycoplasma haemofelis
No se encontró asociación entre los parámetros hematológicos evaluados (células blancas, células rojas, hemoglobina, hematocrito, volumen corpuscular medio, concentración media de hemoglobina, concentración corpuscular media de hemoglobina, plaquetas, linfocitos, neutrófilos) y la presencia del parásito.
DISCUSIÓN
El cuadro infeccioso causado por Mycoplasma haemofelis es considerado como una enfermedad recurrente en medicina veterinaria en Colombia, donde gran parte de las infecciones en gatos están sujetas a infestaciones por el vector Ctenocephallides felis (Molina y Pacheco, 2016). El diagnóstico del patógenos en el país está usualmente limitado a la identificación mediante extendidos de sangre periférica y su asociación con los valores hematológicos, por lo que la mayoría de los pacientes reciben tratamientos terapéuticos basados en diagnósticos presuntivos (Mayorga et al., 2019). La prevalencia de 81% en el presente estudio fue muy alta en comparación con estudios similares (Cruz et al., 2011; Latrofa et al., 2020; Silva et al., 2020), aunque Carvajal (2012) reportó una tasa de 70% para la ciudad de Bogotá (Colombia), Esto sugiere la importancia de establecer campañas locales y nacionales dirigidas a mitigar la tasa de infección de este microorganismo, especialmente si se considera que la infección también se reporta en felinos silvestres (Willi et al., 2007; Erdal et al., 2018).
La técnica de PCR convencional tiene el potencial de ser extremadamente sensible y específica para el diagnóstico de M. haemofelis, mostrando más sensibilidad que el examen citológico (Tasker, 2010; Kamying- kird et al., 2021). Sin embargo, para próximos estudios se sugiere realizar qPCR con el fin de diferenciar M. haemofelis de otras especies de micoplasmas hemotrópicos. En el presente estudio se obtuvo una correlación significativa entre la técnica citológica y la técnica molecular, por lo que se puede inferir que el extendido de sangre periférica es una prueba de alto valor diagnóstico; sin embargo, se requiere que el técnico de laboratorio tenga la habilidad para el reconocimiento e identificación del microorganismo, así como la experticia en el manejo de técnicas mole- culares para realizar un diagnóstico certero de la condición del paciente.
Por otro lado, diversos autores indican que el examen microscópico por sí solo no es suficiente para confirmar el diagnostico por su baja sensibilidad y especificidad (Tasker, 2010; Hawley et al., 2018), ya que las estructuras de la bacteria pueden ser confundidas con artefactos provenientes de tinciones inadecuadas (falsos positivos) o niveles variables de parasitemia que se presentan en animales clínicamente enfermos (falsos negativos). Adicionalmente, se pueden generar interferencias ocasionadas por mala prepa- ración del material a usar e inclusiones citoplasmáticas tipo cuerpos de Howell Jolly, sumado a la incapacidad para diferenciar otras especies infectantes (Barker, 2019).
Los resultados obtenidos por diversos autores con respecto a los parámetros hematológicos son controversiales. Así algunos reportan una relación entre la presencia de M. haemofelis y un estado de anemia hemo- lítica en gatos inmunocompetentes, especial- mente en casos de infección severa y potencialmente mortales (Barker et al., 2011; Ghazisaeedi et al., 2014; Vilhena et al., 2018); sin embargo, en este estudio no se encontró día relación, en concordancia con lo afirmado por otros estudios (Roura et al., 2010; Munhoz et al., 2018), de allí que el cuadro hemático no podría considerarse como un parámetro predictivo en infecciones causadas por este microorganismo.
Con relación a la edad, se determinó que los gatos más afectados corresponden al grupo etario entre 1 y 2 años. Duarte et al. (2015) afirman que la tasa de infección por este patógeno se presenta en animales muy jóvenes o gerontes debido a la menor competencia del sistema inmune y la aparición de enfermedades asociadas a la edad. Adicional- mente, una gran población de gatos domésticos en esta región del país tiene actividades al aire libre, exponiéndose a gatos callejeros portadores de la enfermedad, lo que facilita el adquirir este microorganismo a través de artrópodos hematófagos (Inokuma et al., 2004). Con respecto al sexo del felino, y en concordancia con otros estudios realizados, no se encontró una asociación con la presencia del patógeno (Molina y Pacheco, 2016).












 uBio
uBio