INTRODUCCIÓN
La mastitis en el ganado lechero causa serios daños económicos al productor debido a menores rendimientos y mayor descarte de leche y de animales, así como hasta posibles mermas en fertilidad (Seegers et al., 2003; Halasa et al., 2007; Abebe et al., 2016). La mastitis subclínica es de 15 a 40 veces más prevalente que la forma clínica, es de larga duración y difícil de detectar (Sarker et al., 2013; Tripura et al., 2014). Gómez et al. (2015) reportaron una prevalencia de mastitis subclínica de 72.3% en ganaderías lecheras de Apurímac, Perú. Al mismo tiempo, ha habido una disminución importante en la prevalencia de mastitis contagiosa y un aumento relativo o absoluto en la incidencia de mastitis ambiental (Klaas y Zadoks, 2018). Este tipo de mastitis esta ocasionada por patógenos coliformes, Streptococcus uberis, S. aureus y Streptococcus agalactiae, que aunado a los cambios en el huésped y en el medio ambiente, incluidas las presiones sociales y eco- nómicas, impulsan cambios en la epidemiología y el control de la mastitis (Klaas y Zadoks, 2018). La información relativa a la prevalencia y distribución de bacterias causantes de mastitis, tanto ambientales como contagiosas (Zadoks et al., 2001; Olde Riekerink et al., 2010), junto con la identificación de los factores de riesgo contribuyentes (Leelahapongsathon et al., 2014) son cruciales para prevenir y controlar la enfermedad. En esta línea, Abebe et al. (2016) reportaron en rebaños con 59% de mastitis subclínica que los factores asociados a mastitis fueron el tamaño del rebaño, el material de cama y el tipo de ordeño.
Si bien se han realizado muchos estudios en rebaños lecheros grandes, las familias que viven en zonas de altura poseen granjas con un tipo de sistema de producción completamente diferente (Firth et al., 2019). En el Perú, de modo similar a lo que ocurre en granjas lecheras de Austria, Suiza y en las regiones alpinas de Italia, las fincas son a menudo relativamente pequeñas en compa- ración con el tamaño promedio del rebaño europeo (Busato et al., 2000; Pothmann etal., 2014). Asumiendo que la mastitis es una enfermedad multifactorial, es importante considerar programas integrados de salud de las ubres (Firth et al., 2019). Ante esto, el objetivo del presente estudio fue estimar la prevalencia de mastitis subclínica e identificar los factores de riesgo ambientales para la presentación de mastitis en vacas de pequeños productores en alta montaña.
MATERIALES Y MÉTODOS
Área de Estudio
El estudio se desarrolló durante abril y agosto (época seca) de 2018 en granjas le- cheras de pequeños productores en el distrito de Santa Rosa, provincia de Melgar, dentro de la región de Puno, Perú. La zona se encuentra a una altitud de 3993 msnm, y presenta temperatura mínima de -14 y máxima de 18.8°C, precipitación pluvial de 0.738 mm/día y humedad de 76.9% (SENAMHI, 2018).
Población y Práctica de Crianza
Se utilizaron datos de vacunos Brown Swiss en diferentes etapas de lactación, pertenecientes a 38 productores de 13 sectores de la «Asociación de Productores Agropecuarios Apu Kunurana - Santa Rosa». Los animales pastorean durante 7 a 8 horas al día, con alimentación basada en pastizales y alfalfa, heno y ensilado de avena. Los meses del estudio son considerados como época de heladas con escasa precipitación pluvial. Los animales son alojados por las noches en corrales con piso de tierra, en su mayoría sin te- cho, con ausencia de comederos y bebederos.
Diseño Experimental y Tamaño de Muestra
El tamaño de muestra se calculó utilizando la fórmula n = (1.962 * Pexp (1-Pexp ))/d2 (Thrusfield (2004), con una tasa de prevalencia esperada del 39%, un intervalo de confianza del 95% y una precisión absoluta del 5%, donde n = tamaño de muestra requerido, Pesp = prevalencia esperada, d 2 = precisión absoluta deseada. El tamaño mínimo muestral resultó en 300 vacas lactantes (1200 cuartos mamarios).
Se realizó un estudio transversal para determinar la prevalencia y los factores de riesgo extrínsecos asociados a mastitis subclínica bovina. Se examinó a las vacas para detectar casos subclínicos utilizando la Prue- ba de Mastitis de California (CMT).
Metodología
Cuestionario estructurado
Se utilizó un cuestionario previamente consensuado por los supervisores del proyecto y se realizaron entrevistas directas a los propietarios de las granjas para recopilar in- formación sobre factores de riesgo extrínsecos como escala de producción (pequeña y mediana), tipo de ordeño (ordeñadora mecánica y manual), inducción de bajada de leche (con o sin ternero), higiene pre-ordeño (lava- do y sin lavado de pezones -con mínima cantidad de agua-) higiene del ordeñador (lava- do o no de manos) y cantidad de ordeños por día (uno o dos). No se consideró el factor granja puesto que todos los productores poseen las mismas características en infraestructura. La toma de datos se consignó antes, durante y posterior al ordeño, además de realizar la inspección correspondiente a la labor del ordeño y visita a las instalaciones.
Muestras de leche y prueba de CMT
Se desecharon los dos primeros chorros de leche y se tomó 2-3 ml de leche en la paleta de mastitis de cada cuarto inmediatamente después de que la ubre fue secada (De la Cruz, 2011). El reactivo CMT se mezcló con cada muestra en la paleta en proporción a la muestra de leche. Se realizó un movimiento rotatorio y el resultado se interpretó como negativo (N), traza (T), +1, +2 o +3 (Radostitis et al. 2007). Se consideró como positivo a mastitis subclínica el grado de «traza» y al menos un cuarto mamario afectado con grados de traza, 1, 2 o 3. Se incluyó el grado traza debido a que se considera que la muestra posee 200,000 a 400,000 células somáticas por mililitro (Mellenberger y Roth, 2000), tal y como se detalla en el Cuadro 1.
Cuadro 1. Interpretación de los grados de la Prueba de Mastitis de California (CMT) para detectar mastitis subclínicas

Fuente: Mellenberger y Roth (2000)
Análisis de Datos
Se utilizaron estadísticas descriptivas como la media, mínima y máxima para describir la prevalencia. Los grados de mastitis subclínica se sometieron a un análisis de varianza y comparación de medias con la prueba de LSD. El efecto de los factores de riesgo con posible asociación con la mastitis subclínica se analizó mediante la prueba de Chi cuadrado con el software Statgraphics XVI 1.18, considerándose como estadísticamente significativa un valor de p<0.05.
RESULTADOS
El promedio de vacas en lactación por hato fue de 7.89±5.49, donde el 87% (33/38) de los productores ordeña una vez al día, obteniendo una producción promedio de
5.23 l/vaca.
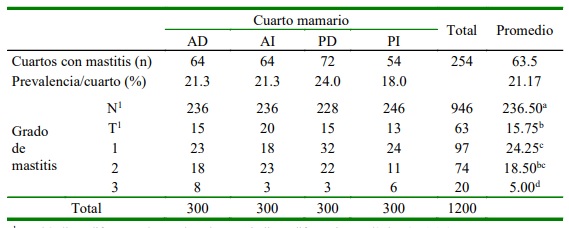
El 47% (141/300) de las vacas resultó positiva a mastitis subclínica y el 21.17% (254/1200) de los cuartos mamarios estuvieron afectados (Cuadro 2). El grado 1 fue estadísticamente similar al grado 2, pero significativamente mayor que el grado traza (p<0.05). Asimismo, se observó un ligero mayor número de mastitis subclínica en el cuarto posterior derecho, pero sin diferencia significativas entre cuartos mamarios (Cuadro 2).
Se encontró una correlación de 91% entre tamaño de hato bovino y presentación de mastitis subclínica (r=0.908); es decir, mientras mayor es la cantidad de vacas en lactación por hato, la probabilidad de la presencia de vacas con mastitis subclínica se incrementa, pero sin demostrar evidencia so- bre la asociación entre ambas variables (p>0.05)
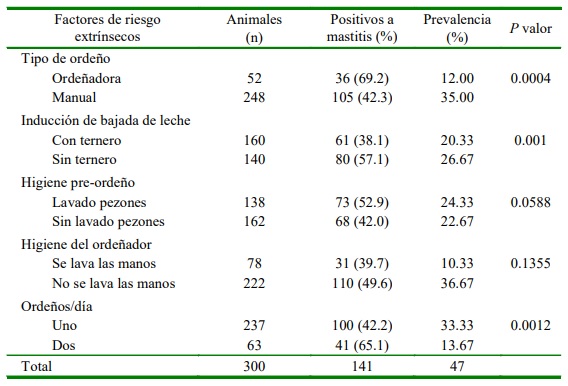
Los factores tipo de ordeño, inducción de la bajada de la leche con ternero al pie e higiene previa al ordeño resultaron factores determinantes para la presentación de mastitis subclínica (p<0.05), en tanto que la higiene del ordeñador (lavado de pezones y de manos) no influyó en la presentación de mastitis subclínica (Cuadro 3).
Cuadro 2. Prevalencia de mastitis subclínica y grado de CMT y a nivel de cuartos mamarios (300 vacas y 1200 cuartos) en vacas Bron Swiss (Santa Rosa, Melgar, Puno)
a,b,c Subíndices diferentes dentro de columnas indican diferencia estadística (p<0.05)
1 N=Negativo. T=traza
DISCUSIÓN
El 47% de prevalencia de mastitis subclínica encontrada fue bastante menor al 72.3% reportado por Gómez et al. (2015) en Abancay, Perú, bajo condiciones de ordeño más precarias; en cambio en Colombia se halló una menor prevalencia de 45.4% (Sánchez et al., 2018), pero menor al 21.58% reportado bajo las condiciones de la costa peruana (Cordero et al., 2014). Asimismo, Atajo (2019), realizando recuento de células somáticas en vacas de la provincia de Melgar, Arequipa, halló 25.28% de mastitis subclínica. Por otro lado, la prevalencia encontrada en el presente estudio fue menor que estudios realizados en Etiopía con prevalencias de 56- 59% (Abebe et al., 2016; Tsegaye et al., 2019), posiblemente debido a que en dichos estudios se utilizó ordeño mecanizado y con mayor número de animales (Dobson, 2000). En cambio, en fincas de la Sabana de Bogotá ubicadas entre 2500 a 3000 msnm se halló una prevalencia del 34.4% de mastitis subclínica en vacas ordeñadas mecánicamente y a mano (Calderón y Rodríguez, 2008), frecuencia menor posiblemente a que se realizaba doble ordeño al día.
La prevalencia por cuartos mamarios fue mucho menor a las reportadas por Santivañez et al. (2014) con 48.7% y Tsegaye et al. (2019) con 29.0%, pero mayor al 16.2% manifestado por Sánchez et al. (2018) y 7.57% determinado por Atajo (2019). Ninguno de los cuartos mamarios presentó una mayor frecuencia significativa de mastitis subclínica, a pesar de que el cuarto posterior derecho tuvo una ligera mayor frecuencia (Cuadro 2); resultado similar a los reporta- dos por Guerrero (2017) y Gómez et al. (2015) quienes incluyeron el grado de trazas como casos positivos; no obstante consideran un mayor predominio de casos en el cuarto posterior derecho, posiblemente debido a la modalidad de ordeño manual, donde se realiza de forma cruzada y se inicia con el pezón derecho posterior y el anterior izquierdo.
El ordeño mecánico involucra mayor predisposición a la mastitis (p<0.05), debido a que esta actividad muchas veces es des- empeñada con descuido de la higiene del equipo (Ruiz et al., 2011; Celis, 2016), tanto para el diagnóstico por CMT como para recuento de células somática (RCS). El ordeño mecánico tiene muchos beneficios para el productor; sin embargo, se tiene un mayor riesgo de infección por uso continuo de las pezoneras (Cordero et al., 2014), así como por posibles descuidos en el lavado y desinfección del equipo y utensilios de ordeño (Ramírez et al., 2011).
La estimulación de la bajada de la leche con ternero al pie conlleva a una prevalencia de 20.33% de vacas con mastitis frente a la inducción sin ternero al pie (p<0.05)-La estimulación con ternero al pie es una práctica tradicional en los sistemas de producción mixto (Drescher, 2005). Este es un factor para considerar ya que el ternero no solo estimula la bajada de la leche, sino que al final del ordeño consume la leche residual, lo cual es adecuado para limitar el desarrollo de bacterias en la glándula mamaria (Andresen, 2001). En este sentido. Aguilar y Alvarez (2019) sugieren ordeño y masaje de los cuartos afectados cada cuatro horas en casos de mastitis leves.
El lavado de pezones con mínima cantidad de agua y el lavado de las manos del ordeñador se observó en menos de la tercera parte de los productores, denotando que di- cho comportamiento no influyó en la presentación de mastitis subclínica (p>0.05), probablemente debido a la poca cantidad de agua utilizada, pues cuanta menos agua se para el lavado de los pezones reduce la probabilidad de que esta discurrirá hacia la entrada del pezón, por lo tanto no arrastrará bacterias causantes de mastitis (Blowey y Edmondson, 2010; Dairy Australia, 2020).
CONCLUSIONES
La presentación de mastitis subclínica afectó al 47% de vacas criadas en condiciones de altura.
Factores ambientales como el ordeño mecánico, la inducción de la bajada de leche sin ternero, y la realización de dos ordeños al día son factores que predisponen la presentación de mastitis subclínica en vacas de pequeños productores.












 uBio
uBio