INTRODUCCIÓN
En Perú, los programas de control y prevención de la hidatidosis basados en la inspección del proceso de beneficio del ganado y la desparasitación de perros no han logrado el éxito esperado debido a la constante reinfección que presentan los perros, ya que aún se mantiene la costumbre de alimentar- los con vísceras de animales infectados (Moro et al., 1994, 1997; Santivañez et al., 2010). Si bien, la desparasitación de los perros evita la infección de los ovinos, esto no logra reducir la infección en ovinos previamente infectados; sin embargo, la desparasitación de es- tos puede disminuir la carga parasitaria calcificando algunos quistes (Blanton et al., 1998). En ambos casos, los ovinos continúan actuando como reservorio de quistes activos, facilitando la propagación de la enfermedad (Dueger y Gilman, 2001).
En el afán de encontrar una herramienta serológica útil que permita diagnosticar la hidatidosis ovina, se estableció que la prueba de electroinmuno transferencia enzimática (EITB) o Western blot presenta una buena sensibilidad (69-73%), especificidad (98.7%) y ausencia de reacciones cruzadas (Moro et al., 1997; Dueger et al., 2003), aunque se desconoce su efectividad para identificar una infección activa (presencia de quistes activos). Es por ello que, el presente estudio tuvo como objetivo evaluar la prueba de EITB en el diagnóstico serológico de la hidatidosis ovina en campo, dentro de una zona endémica, así como evaluar la utilidad de la prueba para detectar quistes activos con base a la presencia de al menos una banda antigénica.
MATERIALES Y MÉTODOS
Lugar de Ejecución
El análisis de las muestras se llevó a cabo en las instalaciones del laboratorio de la Unidad de Cisticercosis del Instituto Nacional de Ciencias Neurológicas, en Lima. La necropsia de los animales tuvo lugar en las instalaciones del Laboratorio de Epidemiología y Economía Veterinaria de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (FMV- UNMSM) y en el Complejo Científico Ecológico Académico Santa María del Mar de la Universidad Peruana Cayetano Heredia (UPCH).
Material Experimental
Se trabajó con 84 ovinos Corriedale distribuidos en dos grupos. El Grupo I, conformado por 80 animales mayores de 3 años, adquiridos en la SAIS Pachacútec, Junín y trasladados a la ciudad de Lima, y el Grupo II conformado por cuatro ovinos menores de 1 año, nacidos en Lima bajo condiciones de laboratorio. A todos los animales se les tomó una muestra de sangre (8 ml) mediante punción de la vena yugular en tubos al vacío con gel separador y sin anticoagulante (Vacutainer®). Las muestras fueron centrifugadas a 635 g durante 10 min y el sobrenadante fue transferido a un microvial, preservándose en cadena de frío (Ice pack) a 4 °C durante su transporte hacia el Instituto Nacional de Ciencias Neurológicas.
Electroinmuno Transferencia Enzimática (EITB)
Preparación del antígeno
El antígeno hidatídico fue preparado según lo descrito por Verastegui et al. (1992), utilizando el fluido de quiste hidatídico bovino crudo obtenido de animales provenientes de un matadero de la ciudad de Lima. Breve- mente, el líquido se trató con 0.5M de fluoruro de fenil metil sulfonilo a 4 °C en proporción de 1/100 y se centrifugó a 3000 rpm durante 10 min. El sobrenadante se filtró y dividió en alícuotas, congelándolas a -70 ºC, para liofilizarlas y almacenarlas a -20 °C. La reconstitución del antígeno fue con solución salina tamponada con fosfato (PBS), diluyen- do al antígeno con 0.1% de dodecilsulfato de sodio-0.025 (peso/volumen) de azul de bromofenol-Tris-HCl 0.0025 M (pH 8.0). Para obtener una concentración final de 100 µg/ml de proteína, se agregó glicerol al 6% y se calentó a 65 °C durante 10-20 min. El antígeno bovino identifica tres bandas de glicoproteínas (8, 16 y 21 kDa).
Procesamiento de la muestra
Electrotransferencia. Corrida electroforética en gel de poliacrilamida para separar proteínas de la muestra. Se preparó un SDS-PAGE en base a un gel de 15 y 25%. Se sembraron las muestras de los 84 animales (75 µl por gel de la dilución del antígeno), colocándolas en una cámara de electroforesis durante 40 a 60 min. Este proceso permitió la distribución del antígeno en el gel.
Transferencia. Aplicación de corriente eléctrica para llevar las proteínas desde el gel a la membrana de nitrocelulosa. Se formaron cassettes apilando tapa negra, esponja, papel de filtro, membrana, gel, papel de nitrocelulosa, esponja, tapa transparente; los cuales fueron colocados en la cuba con transfer buffer y refrigerante, corriéndolos a 37mA durante 3 h en agitación. Luego se extrajo el papel de nitrocelulosa y se lavó con PBS-Tween. El pale fue cortado en tiras de 3 mm de ancho.
Incubación o Blot. Las tiras de nitrocelulosa se sumergieron en las canaletas de incubación con solución bloqueadora (leche descremada al 5%) y la muestra de suero del animal, dejándolas incubar toda la noche en refrigeración y en agitación. Al día siguiente se realizaron cinco lava- dos con PBS-Tween, se agregó el conjugado 1:10000, incubando en movimiento por 2 h a temperatura ambiente. Se volvió a lavar y se agregó 500 µl de solución de coloración en PBS con peróxido de sodio y diaminobencidina (DAB), dejando reaccionar por 10 min para volver a lavar tres veces con agua. Las tiras fueron secadas para proceder a su lectura.

Figura 1 Tiras diagnósticas del EITB con bandas específicas de 8, 16 y 21kDa. Tira 1; las tres bandas se encuentran teñidas - positivo a hidatidosis. Las tiras 2 y 3 no reaccionaron a la tinción - resultado negativo
Los resultados de la prueba de EITB se determinaron mediante la observación del número de bandas coloreadas en las tiras de nitrocelulosa. La tinción simultánea de las tres bandas antigénicas asociadas (8, 16, 21 KDa) indicaron un resultado positivo a hidatidosis (Figura 1), en tanto que la presencia de dos bandas o menos indicó un resultado negativo.
Necropsia
Se estableció a la necropsia como Gold estándar para el diagnóstico confirmatorio de la hidatidosis ovina. Todos los ovinos fueron anestesiados mediante inyección intramus- cular de xilacina (0.2 mg/kg) y ketamina (20 mg/kg) y sacrificados con pentobarbital sódico intravenosos (60 mg/kg). El hígado y los pul- mones fueron aislados para determinar la pre- sencia de larvas de Taenia ovis y metaces- todes de Taenia hydatigena (Cysticercus tenuicollis); asimismo, se inspeccionaron los órganos abdominales en busca de tenias o lesiones por estas. Se examinaron todos los quistes encontrados, registrando el número, ubicación, diámetro y tipo. Los animales con al menos una lesión quistica a nivel del hígado o de los pulmones fueron considerados como positivos (Cuadro 1).
Basados en las características macroscópicas descritas por Dueger et al. (2013) con algunas modificaciones, los quistes se clasificaron en activos e inactivos. Los quis- tes activos presentaban forma ovoide, llenos de líquido transparente y contenían protoes- cólex liberados, que formaban la «arenilla hidatídica» (Figura 2) (Dueger y Gilman, 2001; Dueger et al., 2003). Los quistes inactivos eran de tipo degenerado si presentaban capas adventicias ennegrecidas con una o múltiples cámaras llenas o no de material purulento y con o sin una membrana degradada (Figura 3) o de tipo calcificado si presentaban una consistencia dura al corte con depósitos calcificados calcáreos en la pared (Figura 4) (Dueger y Gilman, 2001; Dueger et al., 2003).
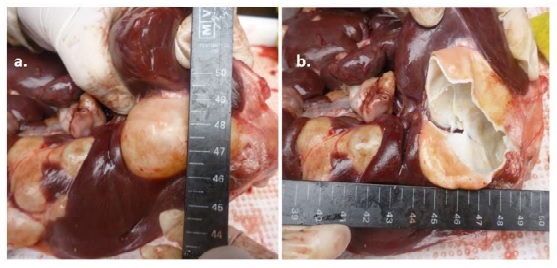
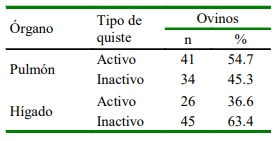
Figura 2 Características de un quiste hidatídico hepático activo: quiste de 4 cm de diámetro. (a) Vista externa: forma esférica, lleno de contenido líquido. (b): Vista interna: membrana de color blanco nacarado, presencia de una sola cámara
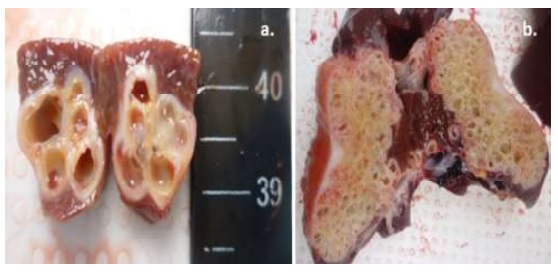
Figura 3 Características de un quiste hidatídico hepático inactivo degenerado. (a): Quiste he- pático con varias cámaras, membrana de coloración amarillenta y escaso contenido líquido. (b): Quiste hepático con múltiples cámaras, no contiene líquido, cámaras formando trabéculas
Figura 4 Características de un quiste hidatídico hepático inactivo calcificado. (a): Quiste hepático con una sola cámara, membrana engrosada con depósitos calcáreos. (b): Quiste hepático con varias cámaras, membrana engrosada
Cuadro 2 Resultado de la prueba de electroinmuno transferencia (EITB) en muestras sanguíneas de ovinos para detección de hidatidosis ovina según el tipo de banda encontrada
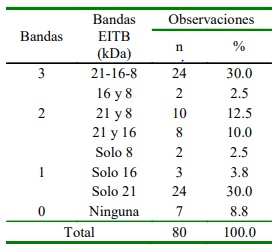
Por otro lado, a fin de conocer la relación entre las bandas de la prueba de EITB y los hallazgos a la necropsia, se consideró el EITB positivo con la presencia de al menos una de las bandas de glicoproteínas y la necropsia positiva con la presencia al menos una lesión quística activa (en hígado o pulmones) (Cuadro 1).
RESULTADOS Y DISCUSIÓN
Bandas en la Prueba de EITB
La prueba de EITB indicó que, de los 80 sueros ovinos del Grupo I, 24 (30%) marcaron positivo a tres bandas, 20 (25%) a dos bandas, 29 (36.25%) a una banda y 7 (8.75%) a cero bandas (Cuadro 2). La mayor frecuencia de reacción fue ejercida por la banda de 21 kDa, que según Verastegui et al. (1992), es altamente específica para hidatidosis. En este sentido, Miranda et al. (2010) consideró como específicas a las bandas 25 y 31 kDa, pero Moro et al. (1997) y Jeyathilakan et al. (2011) consideran como más específica a la banda 8 kDa.
La diferencia en la presentación de las bandas puede deberse al tipo de antígeno empleado (ovino, bovino, porcino, etc.), ya que el mismo parásito puede expresar proteínas distintas según el hospedero; además, existe la posibilidad de presentarse diversas cepas de Echinococcus granulosus (Gomez, 2004). Tal es el caso que Miranda et al. (2010, 2013) identificaron seis bandas en antígeno porcino (8, 16, 21, 25, 31 y 45 KDa) y cuatro en antígeno de alpaca (8, 16, 32 y 38 KDa). En forma similar, al usar antígeno bovino, Verastegui et al. (1992) identificaron las bandas 8,16 y 21 KDa, mientras que Miranda et al. (2010) identificaron las bandas 8, 16, 32 y 35 KDa.
Necropsia
Un total de 77 ovejas del Grupo I pre- sentaron al menos una lesión quística, ya sea a nivel del hígado o de los pulmones (96.3%), cifra similar al 98.9% reportada por Villarreal (2007) en el la SAIS Tupac Amaru en Junín. Este resultado evidencia que a pesar de los años y de las medidas preventivas adopta- das, las cifras de ovinos infectados se mantienen elevadas, colocando al departamento de Junín como uno de los más endémicos a hidatidosis, poniendo en riesgo la salud de las personas.
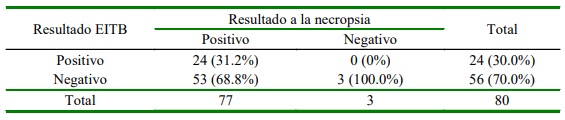
Cuadro 4 Sensibilidad y especificidad de la prueba de electroinmuno transferencia (EITB) para el diagnóstico de hidatidosis ovina en comparación con los hallazgos de quistes hidatídicos en la necropsia
En los 77 animales se contabilizaron 859 quistes hidatídicos, siendo 241 activos. De este grupo de animales, 75 presentaron quis- tes a nivel del pulmón, siendo 41 (54.7%) y 26 (36.6%) con quistes activos en pulmón e hígado, respectivamente (Cuadro 3). No se encontraron larvas de Taenia hydatigena (Cysticercus tenuicollis) o Taenia ovis, ni lesiones ocasionadas por estos parásitos en los órganos del sistema digestivo.
El número de quistes fue mayor en los pulmones que en el hígado. Lo cual concuerda por otros estudios ((Dueger y Gilman, 2001; Urquart et al., 2001; Martinez et al., 2003); sin embargo, García et al. (1997) re- portaron una ligera diferencia a favor de lesiones quísticas en hígado (46.2%) que en pulmones (43%). La presencia de un mayor número de animales con lesiones quísticas y quistes activos en pulmón podría deberse a la menor respuesta inmune de este órgano en comparación con el hígado ((Hariri et al., 1965; Musiani et al., 1978). También podría relacionarse a una variación del genotipo de E. granulosus con predisposición por los pulmones, asociado al incremento en la dilatación capilar y volumen sanguíneo de los pulmones como resultado a la adaptación a grandes altitudes (Lahiri, 1977; Guerra y Breña, 2015) o a una variación morfométrica del parásito, si se considera que los ganchos de los protoescólices en pulmones de ovinos y bovinos son más largos que de aquellos en el hígado (Almeida et al., 2007).
Sensibilidad y Especificidad del EITB
Se elaboró una tabla de doble entrada para comparar los resultados obtenidos en la prueba de EITB con los resultados de la necropsia para los 80 animales del Grupo I (Cuadro 4). La validez interna de la EITB evidenció una sensibilidad de 31.2%, valor bajo comparado con los rangos de 69 y 92.5% obtenidos en estudios similares (Moro et al., 1997; Dueger et al., 2003; Simsek y Koroglu, 2004; Miranda, 2010; Jeyathilakan et al., 2011) y una especificidad del 100% en la prueba. Los valores predictivos positivo y negativos fueron de 100 y 5.4%, respectiva- mente; sin embargo, los resultados no mostraron una asociación significativa (p=0.337).
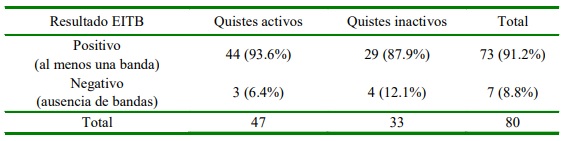
Cuadro 5 Sensibilidad y especificidad de la prueba de electroinmuno transferencia enzimática (EITB) con relación a la presencia de al menos un quiste hidatídico activo en ovinos (Junín, Perú)
La sensibilidad estimada de la prueba a nivel de los pulmones (32%) y del hígado (33.8%) fue similar. Estos resultados se ase- mejan a lo reportado por Moro et al. (1997) a nivel del pulmón (33%), pero difieren para la sensibilidad a nivel de hígado (52%). Al respecto, las diferencias encontradas podrían estar relacionadas al tamaño de la muestra o a la presencia de falsos negativos (Dueger et al., 2003). La especificidad encontrada fue de 100%, tanto en hígado como en pulmones, valor similar a otros reportes con valores que varían entre 95.3 y 99.3% (Moro et al., 1997; Miranda, 2010; Jeyathilakan et al., 2011; sin embargo, se tienen reportes con sensibilidades menores, tales como de 38% (Dueger et al., 2003; Simsek y Koroglu, 2004) en mues- tras de áreas endémicas de características similares a la zona de estudio.
Sensibilidad del EITB con Quistes Activos
El criterio empleado para detectar quis- tes activos mediante la prueba de EITB basado en la identificación de al menos una de las tres bandas antigénicas (8, 16 o 21 kDa) resultó con una sensibilidad de 93.6% (Cuadro 5). Este valor se asemeja al obtenido en otros estudios en ovinos con 91.4% de sensibilidad (Dueger et al., 2003) y en humanos de 95.7% (Gadea et al., 2000). Los valores predictivos positivo y negativo fueron de 60.3 y 57.14%, respectivamente; pero sin llegar a mostrar una asociación significativa (p=0.307).
Evaluar el efecto de la ubicación del quiste activo en la sensibilidad de la prueba fue difícil, ya que los animales presentaban lesiones quísticas activas a nivel del hígado y pulmones de manera simultánea. Así, para realizar este análisis los quistes se estratificaron según el órgano, encontrándose una sensibilidad en hígado de 96.2% y en pulmones de 92.7%. Estos valores se asemejan a la sensibilidad estimada de 95.7% reportada por Gadea et al. (2000). No obstante, la prueba de Fisher evidenció que no existe asociación significativa entre la presencia de lesiones quísticas activas a nivel del hígado (p=0.533) o de pulmones (p=0.569) con el resultado en la prueba de EITB.
Es importante tener en cuenta que la eficacia de las pruebas serológicas depende de muchos factores, algunos de ellos asociados a la procedencia y pureza del antígeno empleado, al suero seleccionado, al órgano afectado (hígado o pulmones), al número de quistes, al tipo de quiste, a la respuesta inmunitaria del hospedero y al hospedero propiamente dicho (Virginio et al., 2003; Carmena et al., 2007). Así mismo, los antígenos extraídos del líquido hidatídico presentan una naturaleza bioquímica compleja que genera problemas en su estandarización debido a la baja sensibilidad y especificidad (Irabuena et al., 2000; Liance et al., 2000).
CONCLUSIONES
La prueba de electroinmuno transferencia enzimática (EITB) para el diagnóstico serológico de hidatidosis ovina pre- sentó baja sensibilidad (31.2%) y alta especificidad (100%).
La sensibilidad de la prueba EITB a la presencia de al menos una banda para detectar animales con lesiones quísticas activas evidenció una alta sensibilidad (93.6%).
La sensibilidad de la prueba de EITB para detectar lesiones quísticas en el hí- gado (96.2%) y en pulmones (92.7%) fue relativamente similar.
En la prueba de EITB, la banda 21 kDa fue más específica en el diagnóstico serológico de la hidatidosis ovina.












 uBio
uBio