INTRODUCCIÓN
Animales con enfermedades hematológicas se presentan constantemente en las clínicas veterinarias debido al deterioro en la salud de los animales (Qiu et al., 2018). Comúnmente, las alteraciones son producidas por microorganismos trasmitidos por vectores (biológicos y mecánicos), especialmente en zonas tropicales y subtropicales, siendo muchos de estos microorganismos capaces de afectar a los animales domésticos y al ser humano (Salim et al., 2019).
Los animales domésticos como perros y gatos representan el origen de enfermedades zoonóticas más cercanas en zonas urbanas (Peña et al., 2017). Debido a la convivencia y relación que existen entre dichos animales con el ser humano, los microorganismos en sangre generan implicaciones le- ves a mortales en la salud humana, principalmente a personas con sistemas inmunológicos inmaduros (Kolo et al., 2016).
Las infecciones por estos microorganismos pueden conllevar a la ocurrencia de anemia y trombocitopenia; acompañado de otras alteraciones como fiebres intermitentes, anorexia, debilidad, vómito y afecciones oculares. Los signos clínicos varían y aumentan de acuerdo con el agente etiológico, su patogenicidad y la condición nutricional, inmunológica o fisiológica del hospedero (Sanchez et al., 2016; (Kolo et al., 2016). Los hemoparásitos se han convertido en un tema de interés e investigación debido a su distribución global e implicaciones zoonóticas. Debido al calentamiento global, migraciones, viajes de hospederos y diversidad de vectores, estos microorganismos se encuentran en áreas que anteriormente no eran afectadas, teniendo repercusiones negativas en la salud pública y animal (Pantchev et al., 2015).
Se resalta la importancia de dar a conocer datos locales sobre la frecuencia de agentes patógenos en perros y gatos domésticos. Por consiguiente, el objetivo de esta investigación fue determinar la prevalencia de microorganismos en sangre en gatos y perros de compañía ingresados a una clínica veterinaria durante el periodo 2016-2018 en la ciudad de Valledupar, Colombia.
MATERIALES Y MÉTODOS
La investigación corresponde a un estudio de diseño descriptivo y retrospectivo. Se realizó en la ciudad de Valledupar, departamento del Cesar, Colombia. La zona presenta una temperatura promedio de 28.4 ºC y dos épocas lluviosas y secas cada una durante el año (IDEAM, 2018).
La población de estudio corresponde a 957 historias médicas, positivas para hemoparásitos y Rickettsias de mascotas ingresados a la clínica veterinaria entre 2016 y 2018. De estas, 847 (88.5%) corresponden al perro doméstico (Canis lupus familiaris) y 110 (11.5%) al gato doméstico (Felis silvestris catus). Las historias clínicas se tabularon en una hoja de cálculo Excel. Las variables analizadas fueron especie, sexo, edad (meses), raza, microorganismo identificado, además de coinfecciones. Para la edad se formaron cuatro grupos etarios: 1-12, 13- 36, 37-72 y mayor a 72 meses.
Las muestras sanguíneas se procesaron través de un extendido de sangre periférica (ESP) descrita por Jiménez y Ro- mero (2015). Las láminas se colorearon con la tinción de Field de acuerdo con las instrucciones del fabricante y se visualizaron por microscopía con aumento de 100X y aceite de inmersión. Las estructuras parasitarias se definieron según Reagan et al. (2019). El diagnóstico final de cada animal se obtuvo de acuerdo con el examen clínico, el hemograma (datos no mostrados) y el microorganismo identificado.
RESULTADOS
Información Clínica
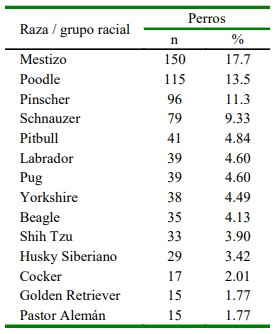
Para el caso de los canes, 52.2% fueron machos y 48.8% hembras. La edad promedio fue de 34.3 meses, siendo la frecuencia de 48, 17, 21 y 14%, para los grupos etarios de 1-12, 13-36, 37-72 y >72 meses, respectivamente. Se determinaron 46 razas caninas, siendo la más frecuente el Poodle (13.5%, 115/847), seguido del Pinscher (11.3%, 96/ 847) y Schnauzer (9.33%, 79/847). Además, se encontró una gran frecuencia del tipo mestizo (17.7%, 150/847) (Cuadro 1).
Cuadro 1 Razas caninas de mayor frecuencia positivas para microorganismos a nivel sanguíneo durante el periodo 2016- 2018 en una clínica veterinaria de Valledupar, Cesar, Colombia
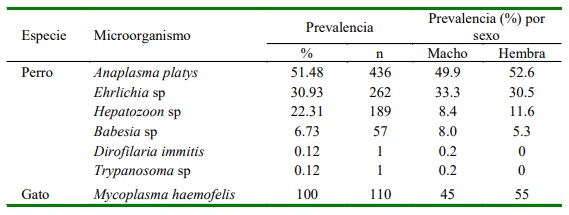
En el caso de los felinos, 55% correspondieron a hembras y 45% a machos. La edad promedio fue de 29.8 meses, siendo la frecuencia de 44, 32, 16 y 8% para los grupos etarios de 1-12, 13-36, 37-72 y >72 meses, respectivamente. Se reportaron seis razas: American Shorthair (30.9%, 34/110), Persa (4.5%, 5/110), Siamés (3.6%, 4/110), Blue Russian (2.7%, 3/110), Angora (1.8%, 2/110) y Abisinio (0.9%, 1/114); además del grupo racial mestizo (55.5%, 61/110).
DISCUSIÓN
Los tipos de microorganismos y las frecuencias encontradas en los caninos del presente estudio fueron similares a los reporta- dos por Ybañez et al. (2018), donde se encontró una mayor frecuencia de machos con patógenos en sangre (56%), los cuales eran mayormente de razas puras y de una edad media de 30 meses. La raza, edad y sexo puede ser útil en el diagnóstico de enferme- dades transmitidas por garrapatas; sin embargo, algunas enfermedades como la ehrlichiosis canina no tienen mayor asocia- ción con estas variables (Harrus y Waner, 2011; Ybañez et al., 2018).
El 44% de los perros infectados eran jóvenes (1-12 meses), datos similares obtenidos por Solano-Gallego et al. (2008), donde manifiestan que hemoparásitos como Babesia spp presentan una mayor prevalencia en perros jóvenes debido a su estado inmunológico. No obstante, es necesario estudios locales que determinen la predisposición de las razas y la edad con las infecciones por microorganismos a nivel hematológico en perros.
La mayor prevalencia de los patógenos reportados fue observada en perros mestizos (17.7%), lo cual concuerda con Maia et al. (2007). Esto podría estar asociado a las condiciones socioeconómicas del dueño y a las condiciones de vida previa a la adopción de los canes, debido a la exposición de vectores o imposibilidad de tratamientos. Además, es- tas infecciones podrían aumentar al mantener contacto con formaciones vegetales tropicales donde se encuentran los vectores (Novacco et al., 2010).
Los resultados encontrados en felinos en el presente estudio coinciden con el reporte de Rosenqvist et al. (2016), quienes encontraron una mayor frecuencia de infección por micoplasmas en gatos mestizos. No obstante, estos investigadores encontraron una mayor frecuencia de infecciones en gatos e»8 años y en machos, en tanto que en el presente estudio fue en hembras (55%) y con edades entre 1 y 12 meses (44%).
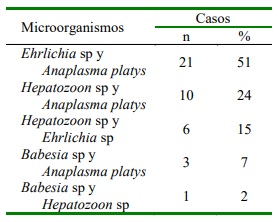
Cuadro 3 Coinfecciones a nivel hematológico en 847 historias clínicas de perros ingresados durante el periodo 2016-2018 en una clínica veterinaria (Valledupar, Cesar)
En estudios en Colombia, McCown et al. (2014) reportaron Ehrlichia canis en 41 y 30% de los perros muestreados en Barranquilla y Cartagena, respectivamente, en tanto que Pesapane et al. (2019), informan de 20.2% de prevalencia de A. platys y 15.3% de Ehrlichia en la región de Magda- lena, valores menores a los obtenidas en el presente estudio. Por otro lado, Galvan et al. (2018) reportaron 26% de prevalencia de Babesia canis en perros de Córdoba. Reportes de infecciones por otros microorganismos a nivel hematológico en otras zonas de Colombia muestran, por ejemplo, 40.6 y 5.5% para E. canis y Babesia sp, respectivamente (Vargas-Hernández et al., 2012a), 17.6% para Ehrlichia spp. y 2.5% para Anaplasma spp (Arroyave et al., 2020), va- lores inferiores a los encontrados en el presente estudio. Sin embargo, Vargas- Hernandez et al. (2011b) reportaron Hepatozoon sp en 31.8% de los perros muestrea- dos, dato mayor al hallado en este estudio.
Solo se encontró un caso de Dirofilaria immitis (0.12%), similar a lo reportado en Barranquilla (2%) y Cartagena (3%) y ningún caso en Medellín (McCown et al., 2014), posiblemente debido a la afinidad del parásito por las zonas cálidas. Sin embargo, Mendoza et al. (2020), reporta su presencia la ciudad de Bucaramanga, zona de mayor altitud a la del presente estudio. En la región del Meta, la presencia de Trypanosoma cruzi en perros tuvo variaciones del 0 a 5.1% (Jaimes-Dueñez et al., 2017). En Cundina- marca, Mesa-Arciniegas et al. (2018) halla- ron anticuerpos anti-T. cruzi en 29.5% de los perros. La presencia de este microorganismo en perros los convierte en el reservorio doméstico más importante de la enfermedad de Chagas (Ramírez et al., 2013).
Se ha evidenciado que prevalencias de patógenos de los géneros Anaplasma, Ehrlichia, Hepatozoon y Babesia en perros se debe a garrapatas del género Rhipicephalus como uno de los principales vectores en zonas tropicales y subtropicales (Götsch et al., 2009; Qiu et al., 2018). No obstante, los nuevos reportes en zonas de mayor altura notifican que, los factores antropogénicos influyen en la dispersión de patógenos con potencial zoonótico.
En gatos, Mycoplasma haemofelis se encontró en todos los registros clínicos; resultado similar al obtenido por Barrs et al. (2010), quienes reportaron 66.6% de gatos positivos con esta bacteria. No obstante, Rosenqvist et al. (2016) solo encontró 1.5% de los gatos afectados por M. haemofelis, posiblemente debido a las condiciones de clima templado en dicho estudio (Tasker et al., 2004).
Las coinfecciones por microorganismos hemáticos pueden ser graves y mortales en perros (Matjila et al., 2008). En este estudio se encontró 4.84% de coinfección en perros, donde Anaplasma platys estuvo presente en 82% de los casos. Pesapane et al. (2019) y Kelly et al. (2013) reportaron coinfección en perros por Anaplasma platys y Ehrlichia canis en una frecuencia menor a la del presente estudio. Asimismo, Wei et al. (2015) reportaron varios casos de coinfección don- de se encontraba B. vogeli-H. canis, H. canis-Ehrlichia canis, H. canis-A. platys y B. vogeli-A. platys.
La alta prevalencia de bacterias Rickett- siales en caninos sugiere un posible aumento poblacional de R. sanguineus como principal vector de estos agentes. Asimismo, pue- de indicar deficiencia en el saneamiento y control de vectores por parte de los dueños y las entidades correspondientes en la ciudad de Valledupar.












 uBio
uBio