INTRODUCCIÓN
La papilomatosis canina es una neoplasia benigna en la piel o membranas mucosas que se presentan sobre todo en perros meno- res de dos años y es ocasionada por el papilo- mavirus canino (CPV, por sus siglas en inglés) (Ji-Young et al., 2010). Se reconocen cinco clases de lesiones: papilomatosis oral múltiple en perros jóvenes (COPV, canine oral papillomavirus), papilomatosis oral solitaria o múltiple en perros de cualquier edad, papilomatosis venérea, papilomatosis ocular (escleropalpebral) y fibropapilomatosis (Carmona et al., 2002; Bianchi et al., 2012). La secuencia del gen de la proteína estructural L1 del papilomavirus oral canino fue la primera en ser publicada en 1994 (Yuanet al., 2007) y desde entonces se han encontrado 23 genotipos de CPV (de Alcântara et al., 2014).
El tratamiento en caninos es inespecífico, recurriéndose muchas veces a inoculación de sangre del animal para estimular la respuesta inmunológica, así como a la cirugía o criocirugía para eliminarlos. Además, existen tratamientos farmacológicos con agentes antineoplásicos (ciclofosfamida, vincristina, bleomicina), inmunoestimulantes (acemanano e interferón á) e incluso cimetidina (Carmona, 2002; Ramírez et al., 2012; Fantini et al., 2015). Asimismo, se reporta el uso de la autovacuna, pero con resultados controversiales (Kuntsi-Vaattovaara et al., 2003; Ñumbay et al., 2016).
En Costa Rica no se han realizado estudios para determinar y caracterizar los genotipos presentes en los papilomas de los caninos. Al no reportarse tratamientos específicos para tratar la aparición de papilomas en perros, la aplicación de una autovacuna se ve como una posible opción sanitaria viable y económica para el manejo de esta condición. El objetivo del presente estudio fue determinar la efectividad de una autovacuna para tratar papilomas asociados a CPV en un perro de raza Gran Danés.
MATERIALES Y MÉTODOS
Muestra
Se obtuvo un grupo de siete papilomas faciales pequeños de un perro Gran Danés macho, de tres meses de edad, que vivía en Hojancha, Guanacaste, pero que había ingre- sado a Costa Rica procedente de México D.F. al mes de edad. El animal fue atendido a través de visita domiciliar. Las lesiones se pre- sentaron en la cara del animal, sugiriendo una papilomatosis oral múltiple (Figura 1). Los papilomas se recuperaron de ambas partes del rostro del animal realizando cortes superficiales de 0.5-1 cm de longitud, que coinciden con el tamaño de las lesiones extraídas. Una parte de los papilomas se conservó en alcohol 70%, otra parte se mantuvo en formaldehido al 10% y la mayor parte se mantuvo en congelación para fabricar la autovacuna.
Extracción, Amplificación y Secuenciación del ADN
La muestra conservada en etanol se usó para la extracción de ADN siguiendo las es- pecificaciones del DNeasy Blood & Tissue kit (Qiagen, Alemania). Mediante la técnica de PCR se amplificó una región conservada de 478 pb del gen que codifica para la proteína estructural L1, usando los cebadores FAP59/FAP64 (5’-TAACWGTIGGI- CAYCCWTATT-3’/5’-CWATATCWVH-CATITCICCATC-3’). La reacción de PCR se realizó con DreamTaq Master Mix 1X (Thermo Scientific, USA), 0.25 µM de cada cebador, 1.25 µl de ADN (100 ng/µl) y agua libre de nucleasas (Thermo Scientific, USA) en un volumen de 25 µl. Las condiciones para la amplificación fueron una desnaturalización inicial a 94 °C de 10 min, seguida de 45 ciclos de desnaturalización a 94 °C por 90 s, hibridación a 50 °C por 90 s, extensión a 72 °C por 90 s; y una extensión final a 72 °C de 5 min (Alfaro-Mora et al., 2021).
Los productos del PCR se visualizaron mediante electroforesis utilizando un gel de agarosa al 1% teñido con GelRed (Thermo Scientific, USA). El producto de PCR se envió a secuenciar a la empresa Macrogen (Seúl, Corea del Sur). La edición de la secuencia se realizó con el software Bioedit 7.2.5. Posteriormente se comparó con las secuencias de la base de datos del GenBank (BLASTn). También se construyó un árbol filogenético con la secuencia obtenida y con las secuencias reportadas de los 20 genotipos existen- tes utilizando el software MEGA7.
El árbol filogenético fue elaborado por el método de máxima verosimilitud, utilizan- do el método del modelo Tamura-3-parameter, con soporte de Bootstrap para 1000 réplicas a partir del producto de PCR para el gen L1 de 449pb obtenido del CPV-1 encontrado en Costa Rica. Los números de acceso del GenBank usados como referencia para la creación del árbol filogenético fueron CPV-1 (KX587461.1), CPV-2 (LC363559.1), CPV- 3 (DQ295066.1), CPV-4 (EF584537.1), CPV-5 (FJ492743.1), CPV-6 (FJ492744.1), CPV-7 (FJ492742.1), CPV-8 (HQ262536.1), CPV-9 (JF800656.1), CPV-10 (JF800657.1), CPV-11 (JF800658.1), CPV-12 (JQ754321.1), CPV-13 (JX141478.1), CPV-14 (JQ7018-02.1), CPV-15 (JX899359.1), CPV-16 (KP099966.1), CPV-17 (KT272399.1), CPV-18 (KT3269- 19.1), CPV-19 (KX599-536.1), CPV-20 (KT901797.1), CPV-21 (NC_040578.1), CPV- 22 (NC_040579.1), CPV-23 (MH285954.1) y BPV-1 (X02346.1).
Análisis Morfológico e Histológico
Se fotografiaron las lesiones y se describieron desde un punto de vista macroscópico. La muestra conservada en formaldehído se sometió a tinción con hematoxilina- eosina y se analizó en microscopio de luz 20X (Martens et al., 2000).
Elaboración de la Autovacuna
Se preparó con un grupo de papilomas pequeños que fueron triturados y macerados en solución salina 0.9%, llegando a constituir el 10% p/v de la solución final preparada. El producto fue centrifugado a 2000 rpm duran- te 1 min. El sobrenadante fue filtrado y se mantuvo en contacto por 24h entre 2-8 ºC con un volumen de formaldehido cuya concentración final fue de 0.3%. Se realizaron pruebas de esterilidad en medios de Tioglicolato y Saboraud. La vacuna estéril se aplicó cuatro veces vía subcutánea con intervalos de 7 días, iniciando con 0.5 ml y continuando con tres aplicaciones de 1 ml, par- tiendo de una modificación del protocolo pro- puesto por Aydin et al., (2020).
RESULTADOS
La secuencia de la proteína estructural L1 amplificada de la muestra del papiloma-(número de acceso GenBank MT177270) resultó ser 100% (449/449pb) similar con una secuencia de CPV-1 aislada de un papiloma de un Husky Siberiano en Sur África (número de acceso GenBank KX587461.1). El árbol filogenético reveló un 100% de identidad con el CPV-1 (Figura 2).
El papiloma se clasificó como papilomatosis oral múltiple en perros jóvenes de acuerdo con sus características morfológicas e histológicas. El estudio histopatológico determinó proliferación papilar, hiperplasia epidermal exofítica e hiperplasia (con hiper- queratosis ortoqueratotica del estrato queratinizado) e hiperplasia del estrato espinoso en algunas áreas de la lesión, mostrando queratinocitos con citoplasmas claros, hinchados, vacuolados con núcleos picnóticos (coilocitos). Se visualiza gránulos de queratohialina a nivel del estrato granuloso. No se reconocieron cuerpos de inclusión intranucleares. Estas papilas son soportadas por un corion fibrovascular central (Figura 3).

Figura 2 Árbol filogenético construido por el método de máxima verosimilitud, utilizando el método del modelo Tamura-3-parameter, con soporte de Bootstrap para 1000 réplicas a partir de productos de PCR para el gen L1 de CPV-1 encontrados en Costa Rica
El perro en el día de la aplicación de la tercera dosis vacunal (tres semanas después de la visita al centro hospitalario [Figura 1]) no presentó evidencias de papilomatosis (Figura 4).
DISCUSIÓN
Se reporta por primera vez en Costa Rica la presencia del CPV genotipo 1, el cual se denominó originalmente como papilomavirus oral canino (COPV) por su predisposición a ocasionar papilomas en las membranas de la mucosa oral y zonas peludas en los perros, que en este caso clínico mostró una distribución preferente por la cara del animal en su forma múltiple, concordando con la clasificación existente de papilomatosis oral múltiple en perros jóvenes reportada en la literatura (Bianchi et al., 2012; De Alcântara et al., 2014). La presencia de CPV-1 ha sido reportada en Brasil, Italia, Japón, China y Corea (Isegawa et al., 1994; Jun et al., 2010; Ji-Young et al., 2010; De Alcântara et al., 2014; Porcellato et al., 2014; Chang et al., 2020).
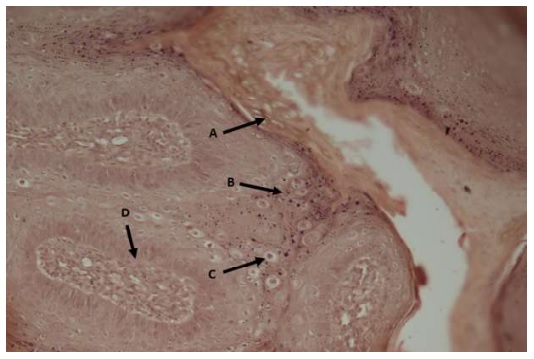
Figura 3 Histopatología del papiloma canino con papilas exofiticas (en forma de coliflor) colec- tado de la cara de un perro Gran Danés de tres meses. Se observa (A) Hiperqueratosis (ortoqueratotica) (B) Proliferación exofítica del epitelio escamoso con hiperplasia de la capa espinosa (C) Queratinocitos (coilocitos) (D) Corion fibrovascular. HE, 20X
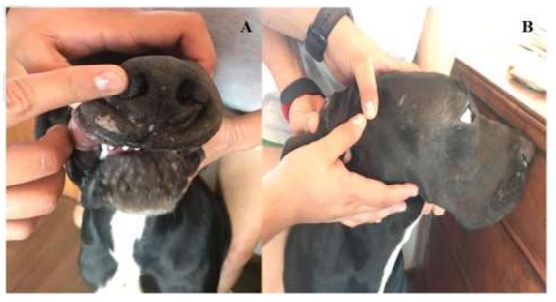
Figura 4 Paciente canino Gran Danés de tres meses con regeneración epitelial y recuperación de papilomatosis facial a la tercera dosis de una autovacuna. Costa Rica (2018)
La caracterización macroscópica, así como el análisis histopatológico permitieron clasificar la lesión como papiloma oral múltiple, describiéndose a partir de alteraciones citoplasmáticas que llevan a efectos citopáticos (Gross et al., 2005). Fue visible una alta proliferación epitelial con un evidente engrosamiento del estrato córneo. La aparición de células agrandadas con núcleos picnóticos rodeados de citoplasma claro (coilocitos), y a pesar de que no se encontraron las inclusiones intranucleares eosinofilicas, podría inferirse la presencia de papilomavirus en el tejido (Lange y Favrot, 2011).
La autovacuna parece una terapia pro- metedora, al lograr la regresión de los papilomas en 21 días. Esta terapia ha sido descrita principalmente para papilomas bovinos, donde se reporta una efectividad superior al 70% de los animales tratados (Sadasiva et al., 2000) y una regresión en 40 días (Peña et al., 2005; Ñumbay et al., 2016). En perros existen pocos reportes sobre el uso de autovacuna en el manejo de CPV, y con un número bajo de sujetos de estudio, destacan- do los reportes de Suzich et al. (1995), donde se utiliza un extracto de papiloma inactivado con formalina para la prevención de COPV en Beagles a través de la infección experimental y natural, pero no su uso como trata- miento, y el de Agut et al. (1996) donde se reporta una efectividad de 100% para la autovacuna en nueve casos.
Kuntsi-Vaattovaara et al. (2003) reportan la aplicación de una vacuna recombinante con la proteína L1 en una hembra Husky Siberiano de 16 meses, aplicada luego de una intervención quirúrgica con láser, eliminando los papilomas a lo largo de 15 semanas, sin presentarse reaparición de hasta 60 semanas posterior a la intervención.
Las autovacunas a partir de macerados de papilomas buscan inducir la producción de anticuerpos contra las proteínas virales (específicamente L1); sin embargo, solo funcionarán en papilomas ocasionados por el genotipo de papilomavirus presente en la autovacuna, y dependiendo de la función inmune del paciente, de la forma en que se recolectaron los papilomas, la forma en que se preparó la vacuna, el calendario de administración y la etapa de desarrollo que en que se encuentren los papilomas (Ranjan et al., 2013). En el presente caso, la autovacuna a partir del macerado e inactivación con formalina de lesiones de papiloma se presentó como una opción viable de tratamiento. Sin embargo, se recomienda realizar estudios más amplios para determinar si existen otros genotipos de CPV presentes en la papilomatosis oral canina (múltiple o solitaria) y confirmar la efectividad del tratamiento con un mayor número de casos caninos.












 uBio
uBio 


