INTRODUCCIÓN
El camarón Cryphiops caementarius es de interés comercial por su alta densidad poblacional en los ríos de la costa del Perú (Zacarías y Yépez, 2015), cuya extracción en 2019 fue de 1122 t (PRODUCE, 2020), cantidad similar a los años previos. Además, la especie tiene potencial para el cultivo, por lo que es necesario contribuir con el manejo de reproductores.
El sistema reproductor de C. caementarius macho localizado en el cefalotórax comprende un par de testículos con conductos deferentes cuya partes proximales están enrolladas, pero la parte media se extiende hasta la ampolla terminal, donde se almacenan espermatóforos listos para salir por el poro genital del coxopodito del quinto par de periópodos (Lip, 1976), tal y como se presenta en Macrobrachium amazonicum (Paschoal y Zara, 2018), M. rosenbergii (Shen et al., 2020) y M. carcinus (Ruiz et al., 2020).
El espermatóforo de crustáceos decápodos almacena los espermatozoides (Becker y Bauer, 2020), pudiéndose colectar median- te disección del conducto deferente (Lin y Ting, 1986), así como por desprendimiento del esternito de la hembra (López et al., 2007), presión manual (Nimrat et al., 2019) y por aplicación de corriente eléctrica en el poro genital (Costa et al., 2016). Estas técnicas se aplican con fines de manejo de la reproducción y de mejoramiento genético; sin embargo, poca atención se ha dado al ciclo de muda que es el proceso fisiológico más importante de todo crustáceo. La relación de la muda con la formación de espermatóforos es reportada en Litopenaeus vannamei (Parnes et al., 2006) y Farfantepenaeus brasiliensis (Braga et al., 2014). En M. acanthurus se extraen espermatóforos en muda C (Costa et al., 2016), mientras que en C. caementarius no se conocen los espermatóforos ni técnica alguna para su extracción. Por consiguiente, el objetivo del estudio fue evaluar el efecto de la estimulación eléctrica en la expulsión de espermatóforos de C. caementarius, según tamaños y estados de muda.
MATERIALES Y MÉTODOS
Los camarones (n=33) fueron colectados del río Lacramarca (9º5’39’’ S, 78º5’39’’ W) (Ancash, Perú). La especie C. caementarius se reconoció según Méndez (1981) y De Grave y Fransen (2011). El sexo del macho se verificó por la presencia del poro genital en cada coxopodito del quinto par de periópodos. Los animales fueron mantenidos en acuarios (55 L) en densidades de cuatro camarones por acuario y recibieron alimento balanceado (28% de proteína total). Para el tamaño de muestra se consideró emplear tres estímulos eléctricos (4, 6 y 8 V), cuatro estados de muda (B, C, Do y D1) y tres repeticiones. Los camarones fueron de 3.0 a 10.8 cm de longitud total (LT), medidos desde la escotadura post orbital hasta el ex- tremo posterior del telson, con vernier (± 0.01 mm) y de 2.0 a 22.5 g de peso determinado con balanza digital (± 0.01 g). El estado de muda de los camarones se verificó según Da Silva et al. (2019), quienes consideran la postmuda (A y B), intermuda (C) y premuda (Do, D1, D2 y D3). Luego fueron agrupados en cuatro rangos de tamaño (3-4, 5-6, 7-8 y 9-10 cm de LT) y para el rango inferior se tuvo en cuenta el tamaño de la primera madurez sexual que es de 2.2 cm de LT (Lip, 1976).
Para la expulsión de los espermatóforos se aplicaron choques de corriente eléctrica de 4 V (n = 15 individuos), 6 V (n = 12) y 8 V (n = 6), sobre un coxopodito del quinto par de periópodos o en el centro de la quilla que une ambos coxopoditos. Para ello, se empleó un transformador de corriente (AC/DC), previa- mente calibrado con multímetro digital Konstar UT33D. La duración del choque eléctrico fue entre 1 a 3 s y se hizo por 2-3 veces. Los espermatóforos fueron medidos con ocular micrométrico (EM-15X Lomo) en microscopio óptico Carl Zeiss y luego se observó la morfología. Cuatro camarones de los grupos de 6 V y 8 V, pero en estado de muda C, fueron disectados para verificar la presencia y distribución de espermatóforos en el conducto deferente distal y en la ampolla ter- minal. Los espermatozoides fueron liberados de los espermatóforos y coloreados con azul de metileno.
En la investigación se tuvo en cuenta la Ley Peruana 27265 (Ley de Protección a los Animales Domésticos y a los Animales Silvestres Mantenidos en Cautiverio) y se hizo todo lo posible para minimizar el sufrimiento durante el sacrificio de los animales en laboratorio. Los resultados de frecuencia de expulsión de espermatóforos fueron sometidos a análisis de Chi-cuadrado con nivel de significancia del 5%. Se empleó el Software SPSS v. 23 para Windows.
RESULTADOS
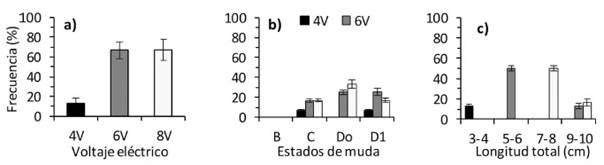
La mayor expulsión de espermatóforos (66.7%) fue lograda con 6 y 8 V (X2 = 9.258, p=0.009) (Figura 1a), en tanto que fue similar según el estado de muda (C: X2 = 0.768, p=0.681, Do: X2 = 5.127, p=0.077; D1: X2 =1.756, p=0.416), aunque en muda B no ex- pulsaron espermatóforos con ningún voltaje eléctrico (Figura 1b). Los camarones de 5-6 cm de LT (X2 = 12.833, p=0.002) y 7-8 cm de LT (X2 = 14.850, p=0.001) expulsaron mayor número de espermatóforos con 6 y 8 V, pero aquellos de 9-10 cm de LT (X2 = 2.750, p=0.253) y de 3-4 cm de LT (X2 = 2.555, p=0.279) el número de espermatóforos fue menor (Figura 1c) y estuvieron en muda C y D1. La estimulación eléctrica no causó alte- ración de los poros genitales ni ocasionó muer- tes hasta después de 15 días de culminado el experimento.
El espermatóforo consistió de un cordón blanquecino (Figura 2a), blando, pegajoso, con cubierta gruesa, de extremos abiertos y fueron de diversas formas (figuras 2b,c,d,e,f), pero al contacto con el agua per- dieron adhesividad y consistencia en pocos segundos. En el conducto deferente distal no hubo formación de espermatóforos únicos, sino un solo cordón que se repliega hasta acumularse en la ampolla terminal (figuras 2g,h). Los espermatozoides se observaron dispersos en una matriz espesa y transparente dentro de los espermatóforos (Figura 2i). Los espermatozoides fueron de forma de paragua evertido con un clavo recto y delgado que se proyecta desde el centro del núcleo (Figura 2j). La melanización de un poro genital fue observado en dos camarones del grupo de 6 V (Figura 2k) antes de aplicar el estímulo eléctrico, y el espermatóforo extraído tuvo un extremo marrón de consistencia dura que fue el que taponó el poro genital; sin embargo, el resto correspondió al cordón blanquecino característico de un espermatóforo (Figura 2l).
DISCUSIÓN
La mayor expulsión de espermatóforos de C. caementarius se logró con 6 y 8 V, sin causar daño a los poros genitales. En cambio, en M. rosenbergii se logró la mayor ex- pulsión de espermatóforos con 4.5-6.0 V (Moreno et al., 2000) aunque también es efectivo con 7.4 V (Li y Tsai, 2000) y 9 V (Goldberg y Oshiro, 2000). No se observa- ron daños por efecto de la estimulación eléctrica como en M. idella donde la ampolla ter- minal se torna oscura por lisis del tejido al emplear 6 V (Joshi y Diwan, 1990).
La estimulación en C. caementarius con 6 y 8 V en muda Do ocasionó mayor liberación de espermatóforos, aunque también se obtuvo en muda C y D1, lo que amplía la posibilidad de encontrar camarones aptos para extraer espermatóforos. En M. acanthurus se extrae espermatóforos con 4.5-6 V y en ejemplares en muda C (Costa et al., 2016). En cambio, la falta de respuesta al estímulo eléctrico se observó en muda B posiblemente debido a la consistencia blanda del exoesqueleto o por falta de espermatóforos en la ampolla terminal. En L. vannamei no hay espermatóforos 12 h antes ni después de la muda (Parnes et al., 2006) y en F. brasiliensis hasta 24 h después de la muda (Braga et al., 2014). Se requiere evaluar un mayor número de camarones en diferentes estados del ciclo de muda, especialmente en premuda tardía (D2) y en postmuda temprana (A).
En cuanto al tamaño de los camarones, la mayor expulsión de espermatóforos se logró en ejemplares de 5-6 cm de LT con 6 V y de 7-8 cm de LT con 8 V, lo que indica que estos voltajes son apropiados para dichas tallas. Similares resultados se reportan en M. acanthurus (Costa et al., 2016). La menor expulsión de espermatóforos se obtuvo con 6 y 8 V en camarones de 3-4 cm y de 9-10 cm de LT, los que estuvieron en muda C y D1. En M. rosenbergii, se emplea 9 V independiente del tamaño del animal (Goldberg y Oshiro, 2000), aunque no se considera el estado de muda. Es probable que, por el menor tamaño de los camarones empleados en la investigación, algunos no estuvieron completamente desarrollados, aunque de acuerdo con Lip (1976), C. caementarius de 2.2 cm de longitud total posee espermatóforos en las ampollas terminales.
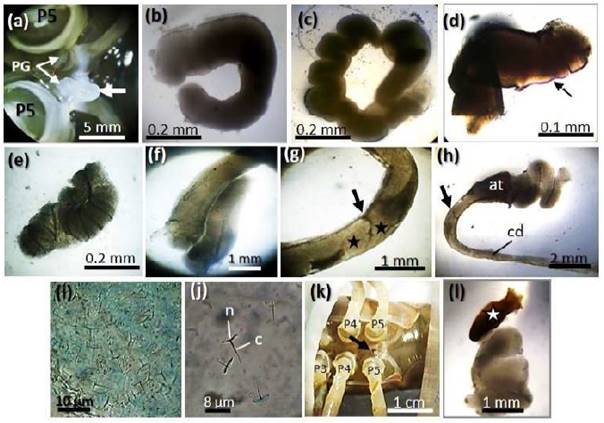
Figura 2 Macho C. caementarius. a) Espermatóforo saliendo de un poro genital (flecha). b) El mismo espermatóforo visto en microscopio a 4x. Observe los extremos abiertos del espermatóforo. c), d), e) y f) Formas de espermatóforos extraídos mediante estimulación eléctrica y mantenidos en agua dulce. g) Superposición de espermatóforos (*) en el conducto deferente distal (flecha negra). h) Conducto deferente distal y ampolla ter- minal de un espécimen fresco. Observe la acumulación de espermatóforos en la am- polla terminal. i) Espermatozoides dentro de matriz del espermatóforo. j) Espermatozoide maduro. k) Poro genital melanizado (flecha negra) antes de la estimulación eléctrica. l) Espermatóforo con un extremo melanizado (*). Abreviaturas: at: ampolla ter- minal. cd: conducto deferente distal. n: núcleo. c: clavo. PG: poro genital. P: periópodo
El espermatóforo de C. caementarius es un cordón blanquecino que al salir de la ampolla terminal adquiere diferentes formas, y es de consistencia blanda y pegajosa, necesario para adherirse al esternito de la hembra durante el apareamiento. Similar consistencia posee el espermatóforo de M. acan-thurus (Costa et al., 2016), M. amazonicum (Paschoal y Zara, 2018) y M. carcinus (Ruiz et al., 2020), aunque no se mencionaron las formas que presentan. Por otro lado, los espermatóforos de C. caementarius tuvieron extremos abiertos, no reportado en otros palaemónidos y, probablemente sea consecuencia de la formación continua y la disposición de espermatóforos dentro del conducto deferente distal hasta su acumulación en la ampolla terminal. Estudios histológicos podrían determinar si hay formación continua de espermatóforos en el conducto deferente medio y distal y si poseen espermatozoides maduros, pues en este estudio se observaron espermatozoides de forma de paragua evertido y con un clavo que se proyecta desde el centro del núcleo, idénticos a los de M. rosenbergii (Poljaroen et al., 2010), M. amazonicum (Paschoal y Zara, 2018) y M. carcinus (Ruiz et al., 2020).
Los estímulos eléctricos empleados no afectaron ni alteraron los poros genitales de C. caementarius. En cambio, la ampolla ter- minal se torna oscura al emplear 6 V en M. idella (Joshi y Diwan, 1990) y M. rosenbergii (Vijaya et al., 2004). En F. paulensis hay melanización de los poros genitales después de 24 h de aplicar 9 V para la extracción de espermatóforos (Nakayama et al., 2008). En el presente estudio, la apa- rente melanización de los poros genitales fue porque parte del espermatóforo se encontraba melanizado. Esto se relaciona con la acumulación excesiva de espermatóforos en la ampolla terminal, probablemente porque el macho no tuvo la oportunidad de aparearse. En L. vannamei, los espermatóforos restan- tes que se acumulan en la ampolla terminal se llegan a melanizar (Heitzmann et al., 1993), pero el apareamiento reduce los restos de melanina de los poros genitales (Parnes et al., 2006), que de no ser así ocasiona esterilidad irreversible y muerte (Alfaro-Montoya, 2010).
CONCLUSIONES
La estimulación eléctrica con 6 y 8 V aplicado sobre los coxopoditos del quinto par de periópodos de C. caementarius ocasiona mayor expulsión de espermatóforos en ejemplares de 5 a 8 cm de longitud total y en muda C, Do y D1. En cambio, los camarones en muda B, no responden a los estímulos eléctricos.












 uBio
uBio