INTRODUCCIÓN
Las razas bovinas Romosinuano (ROMO) y Costeño con Cuernos (CCC) forman parte del grupo de razas criollas colombianas caracterizadas por su adaptación a las condiciones tropicales que se ubican en el Valle del Sinú, sabanas de Sucre y Bolívar. Los machos reproductores de estas razas presentan valores de viabilidad, motilidad, morfologíay concentración espermática (calidad seminal) superiores a los de razas introducidas (Espitia et al., 2006). La estimación de la calidad seminal puede asociarse con el potencial fértil de un animal, y se considera fundamental en procedimientos de reproducción asistida como la inseminación artificial a tiempo fijo y la fertilización in vitro (Januskauskas et al., 2001). Sin embargo, la estimación de la calidad seminal no siempre acierta en aspectos fundamentales de la función espermática (Kastelic, 2013). En este sentido, las herramientas moleculares como la proteómica evidencian que la fertilidad del reproductor está fuertemente ligada a la presencia y/o ausencia de proteínas específicas, tanto en el plasma seminal como en la membrana espermática, que pueden convertirse en biomarcadores de la fertilidad del reproductor (Manjunath y Chadonet, 1993).
En el plasma seminal, proteínas como las BSP (binding seminal proteins) están envueltas en la protección de la membrana espermática, la unión del espermatozoide al oviducto, la capacitación espermática y la fecundación misma (Kumar et al., 2012). Las proteínas ácidas del fluido seminal (aSFP) evidencian un efecto antioxidante (Bustamante et al., 2014), mientras que las proteínas inhibidoras de metaloproteinasas (TIMPS) se relacionan con la membrana del espermatozoide y la fusión de gametos (Moura et al., 2007). Las espermadhesinas se relacionan con la capacitación espermática y prevención de la poliespermia (Moura et al., 2010), y la osteopontina (OPN) actúa ligando la unión espermatozoide-ovocito (Moura et al., 2011).
No obstante, se desconoce el perfil electroforético de las proteínas del plasma seminal de toros criollos ROMO y CCC y su relación con la calidad seminal, de allí que el propósito de este estudio fue generar el perfil de estas proteínas en toros Romosinuano y Costeño con Cuernos mediante electroforesis (SDS PAGE) en geles de poliacrilamida, así como y establecer posibles relaciones con las variables de calidad espermática
MATERIALES Y MÉTODOS
Localización
Esta investigación se realizó en el Centro de Investigación Turipaná de la Corporación Colombiana de Investigación Agropecuaria - AGROSAVIA -, ubicado en el municipio de Cereté, departamento de Córdoba, Colombia. La zona presenta una temperatura promedio de 29.7 °C, humedad relativa promedio de 77.8% y precipitación media entre 1352 a 1646 mm/año, con distribución bimodal.
Animales
Se trabajo con 10 toros ROMO y 10 toros CCC con edades entre 3 y 6 años. Los animales permanecieron bajo las mismas condiciones nutricionales mediante un modelo de pastoreo rotacional en praderas de Brachiaria decumbens, suplementados con sal mineralizada y suministro de agua a voluntad.
Muestras Seminales
Se colectaron tres muestras seminales de cada animal mediante electro eyaculación, con un mes de intervalo entre las colectas. A cada eyaculado se le determinó las variables de calidad seminal convencional, viabilidad (VF), motilidad masal (MMF), motilidad individual progresiva (MIRPF) y concentración espermática (CE). La VF mediante el conteo de espermatozoides según la coloración obtenida con la tinción de eosina-nigrosina, visto al microscopio (Olympus CH-2) con objetivo de 40x. La motilidad espermática mediante estimación visual del porcentaje de espermatozoides con movimiento progresivo en una alícuota de 8 ìl en microscopio óptico con objetivo de 40X. La CE se determinó mediante método espectrofotométrico con ayuda del equipo Spermacue Minitube®.
Plasma Seminal y Cuantificación de Proteínas
El plasma seminal (PS) se obtuvo por doble centrifugación de 2 ml del eyaculado a 7500 g durante 5 min a 4 ºC. El sobrenadante fue filtrado con una membrana Millipore 6 V de 0.22 ìm. Al filtrado se adicionó fenilmetilsulfonil fluoruro (PMSF) 5 µM (1.0 µl/ml de PS) como agente inhibidor de serinoproteasas y se almacenó a -20 ºC. La cuantificación de proteínas se hizo según Bradford (1976).
Crio preservación del Semen y Calidad Seminal Post-descongelación
La criopreservación se realizó utilizan- do el medio comercial para congelación (Bioxcell®, IMV Francia, proporción 1:2 diluyente) y se dejó por 10 minutos a 37 °C. Al homogenizar la muestra, se procedió a descender la temperatura en refrigeración hasta alcanzar los 5 °C en un periodo de 2.5
h. Se adicionó el diluyente faltante para completar las dosis de la pajilla (0.5 ml) quedando durante 16 h en periodo de equilibrio. Luego, las pajillas fueron empacadas y selladas utilizando el equipo IMV L’aigle France tipo MRS 1. Se procedió a disminuir la tempera- tura en vapores de nitrógeno líquido durante 10 min, para finalmente sumergir las pajillas en el nitrógeno líquido para alcanzar una temperatura de -196 °C.
El proceso de descongelación de las pajillas se efectuó utilizando un equipo de baño maría a 37 °C durante 4 s. Las pajillas son secadas, se corta un extremo y se deposita el contenido en un vial y se toma 3 µl para su evaluación en el equipo Sperm Class Analyzer® CASA System v. 6.6 (Microptic). Se determinó el porcentaje de espermatozoides con motilidad individual rápida progresiva (MIRPPC), porcentaje de espermatozoides con motilidad media progresiva (MPPC), porcentaje de espermatozoides rápidos progresivos (RPPC), progresividad (PPC) y viabilidad post congelación (VPC). Se realizó también la prueba de endosmosis (PHT) (Ramu y Jeyendran, 2013), para de- terminar la integridad de la membrana espermática.
Electroforesis Unidimensional (SDS- PAGE)
Para la separación unidimensional de las proteínas se tomaron 15 µg de proteínas del plasma seminal y se sometieron a electroforesis en geles de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE) (Laemmli, 1970). El procedimiento se realizó en geles de 7 x 8 cm y de 1.0 mm de grosor, en gradiente de concentración lineal de poliacrilamida (10-20%). Las soluciones de poliacrilamida se prepararon a partir de una solución stock al 30%, en un tampón con Tris- Base 1.38 M, EDTA al 0.3% y SDS (dodecilsulfato sódico) al 0.4% en agua a Ph 8.8. La polimerización se realizó con 0.8 µl/ml de TEMED (N, N, N’, N’ Tetrametil- etilendiamina) y 17 µl/ml de APS (persulfato de amonio) al 4%. Se mezcló 15 µg de pro- teína total con un tampón de carga compuesto por 60% de glicerol, 5% SDS, 0,125 M Tris-HCl a pH 6.8, 5% 2- Mercaptoetanol, 10 mM EDTA y 0,1% azul bromofenol.
Para la determinación de los pesos moleculares de las bandas se usó el marcador de peso molecular «Precision plus protein estándar» (Bio-Rad®). La electroforesis se realizó a 85 v durante 180 min. Los geles se tiñeron con azul brillante de Coomassie, y se revelaron con una solución decolorante a base de metanol-ácido acético, hasta la visualización de las bandas de proteína. Finalmente, los geles se digitalizaron en un documentador (Molecular Imagen Gel Doc, Bio-Rad®) y las imágenes obtenidas se analizaron con el software Image Lab® para determinar el peso molecular y la concentración relativa de las bandas de proteínas.
Cuadro 1 Porcentajes espermáticos de viabilidad (VF), motilidad masal (MMF), motilidad individual rápida progresiva (MIRPF) y concentración espermática (CE) en semen fresco y de viabilidad (VPC) y motilidad rápida progresiva (MIRPPC) en semen congelado-descongelado de bovinos criollos Romosinuano (ROMO) y Costeño con Cuernos (CCC)

a,b Valores con diferentes letras en columnas indican diferencias significativas (p<0.05)
DE: desviación estándar
Análisis Estadístico
Las variaciones de motilidad y viabilidad espermática de semen fresco y congela- do se analizaron mediante una prueba T- Student pareada. Se determinó el coeficiente de correlación (r2) entre la cantidad relativa de cada banda de proteína y los parámetros de calidad seminal. Además se realizó una prueba de componentes principales y un procedimiento de regresión hacia adelante como una aproximación para determinar las ban- das de proteína que pueden explicar en mayor medida el comportamiento de las variables de la calidad seminal.
RESULTADOS
Calidad seminal en semen fresco y crio pre- servado
En semen fresco solo se encontraron diferencias (p<0.05) en los valores de CE de las dos razas (Cuadro 1). En el semen crio preservado se evidenciaron diferencias (p<0.05) para los valores de viabilidad post- descongelación (VPC) y motilidad individual rápida progresiva post-descongelación (MIRPPC), con mayores valores para la raza ROMO (Cuadro 1).
Perfiles electroforéticos SDS-PAGE de pro- teínas del plasma seminal
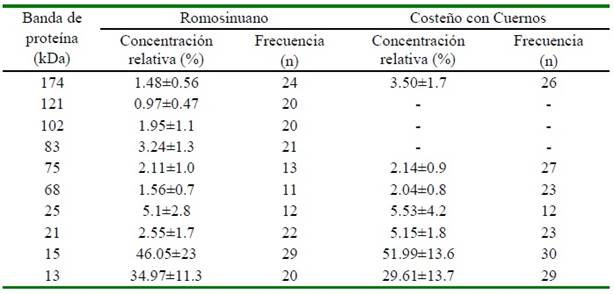
El análisis de los perfiles electroforéticos de las proteínas de plasma seminal evidenció la presencia de 10 y 7 bandas de proteínas en el plasma seminal de toros ROMO y CCC, respectivamente (Figura 1). En cuanto a la concentración relativa de las proteínas, las bandas de 13 kDa y 15 kDa fueron las de mayor valor en el plasma seminal de ambas razas (Cuadro 2).
El análisis de correlación entre las ban- das de proteínas y las variables de calidad seminal solo evidenció relaciones para los toros ROMO. Las bandas de proteína de 13 y 83 kDa correlacionaron con VF (p<0.01, r= 0.53; p<0.05, r=0.40 respectivamente), mientras que las bandas de 75 y 102 kDa correlacionaron con la CE (p<0.05, r=0.55; p<0.04, r=0.47 respectivamente) en semen fresco. Por su parte en semen congelado, las bandas de proteína de 68, 75, 83 y 174 kDa correlacionaron de forma negativa con MIRPPC (p<0.005, r= -0.76; p<0.04, r= -0.53; p<0.05, r= -0,42 y p<0.05, r= -0.39 respectivamente), y las bandas de 75 y 83 kDa tuvieron igualmente una relación negativa (p< 0.004, r= -0.73; p<0.007, r= -0.56 respectivamente) con VPC (tabla 3).
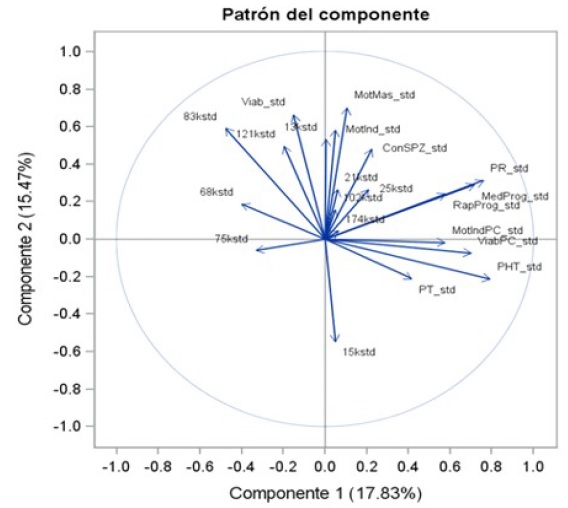
El análisis de componentes principales en toros ROMO evidenció la existencia de relaciones positivas de pequeño valor entre MMF, MIRPF y CE con las bandas de proteínas de 21, 25, 102 y 174 kDa en semen fresco. Además, se evidenció una relación inversa entre estas variables y la banda de proteína de 15 kDa. Por otra parte, se evidenciaron relaciones positivas entre la variable de VF y las bandas de 13, 83 y 121 kDa, y una relación negativa con la banda de 15 kDa. Las variables de calidad seminal postdescongelación de MIRPPC, progresividad, MPPC, RPPC, VPC y PHT fueron negativas con las bandas de 13, 68, 75, 83 y 121 kDa. Asimismo, se evidenciaron relaciones menores y positivas entre estas variables de calidad seminal y las bandas de 21, 25, 102 y 174 kDa (Figura 2).
En cuanto a los toros CCC, el análisis de componentes principales evidenció en semen fresco relaciones pequeñas y directas entre MM, MIRP y CE con las bandas de proteínas de 15 y 174 kDa, y relaciones inversas de estas variables con la proteína de 75 kDa (Figura 3). En semen congelado se evidenciaron relaciones directas entre las variables VPC, MIRPPC, progresividad, RPPC y MPPC con las bandas de proteínas de 15 y 174 kDa, y negativas entre las variables de calidad mencionadas y la banda de 75 kDa (Figura 3).
Los datos se sometieron a un procedimiento de regresión hacia adelante para detectar interacciones de las bandas de proteínas con las variables de calidad seminal seleccionando modelos significativos mayor al 95%. El modelo en el caso del semen fresco de toros ROMO y la viabilidad espermática semen fresco integró a las bandas de 15 y 75 kDa, mientras que para viabilidad post-congelación, se integraron las bandas de 75 y 83 kDa. Para la motilidad en semen fresco se relacionaron las bandas de 15, 21, 68 y 83 kDa y en semen post-congelación las bandas de 13, 15, 68 y 75 kDa (Cuadro 4). Por su parte, en toros CCC, las bandas de 21, 25 y 75 kDa explican la motilidad en semen fresco, mientras que en semen post-congelación solo se explica por la banda de 75 kDa (Cuadro 4). Vale indicar que solo se selecciona- ron modelos significativos mayor al 95%.
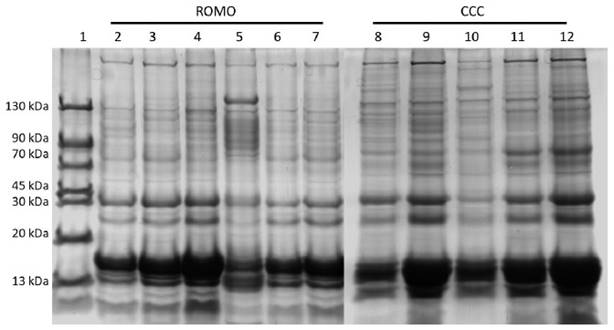
Figura 1 Perfil electroforético de las proteínas del plasma seminal de toros ROMO (líneas 2-7); y CCC (líneas 8-12). Marcador de peso molecular en la línea 1.
Cuadro 3 Correlaciones entre las bandas de proteínas y las variables viabilidad (VF) y concentración espermática (CE) en semen fresco, y motilidad individual rápida progresiva (MIRPPC) y viabilidad espermática en semen congelado-descongelado (VPC) de toros Romosinuano

DISCUSIÓN
La CE en semen fresco fue mayor en toros ROMO, sugiriendo una mayor capacidad fecundante a la de los toros CCC. En este sentido, se han reportado diferencias en la CE entre grupos raciales (Novianti et al., 2020), y ciertamente entre animales del mismo grupo racial (Assumpcao et al., 2013).
La CE en toros ROMO fue similar al reportado por Palmieri et al. (2004).
Se obtuvo un mayor porcentaje de espermatozoides viables y mótiles en semen congelado-descongelado en toros ROMO que en toros CCC. Esta respuesta podría estar asociada con la presencia de moléculas específicas del plasma seminal que protegerían la membrana espermática del estrés térmico y oxidativo ocasionado por la congelación. (Pini et al., 2018).
Es de resaltar que las bandas de proteínas de 13 y 15 kDa son las de mayor concentración relativa en el plasma seminal de ambas razas, y posiblemente en ellas se en- cuentren las proteínas pertenecientes a la familia de las BSP (Sarsaifi et al., 2015). Más específicamente, la banda de proteína de 15 kDa podría corresponder a la BSPA1/A2 (Abou y Tulsiani, 2009), mientras que la ban- da de 13 kDa podría ser la BSP A3 (Moura et al., 2007; Mungai et al., 2011).
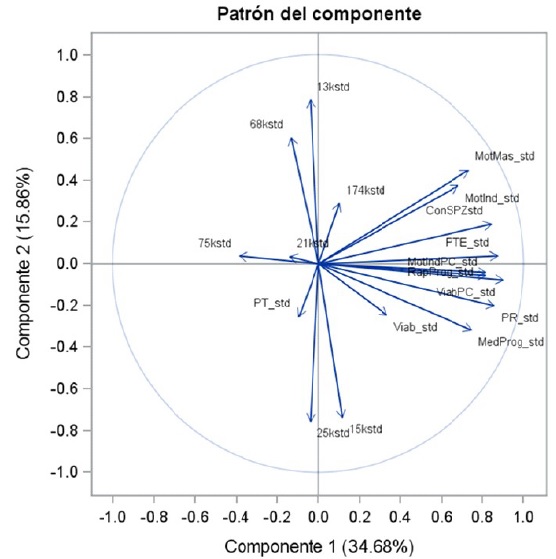
Figura 3 Análisis de componentes principales. Se evidencian las relaciones entre las variables de calidad seminal de semen fresco y pos-descongelado con las bandas de proteína en toros Costeño con Cuernos
Un hallazgo interesante es la presencia exclusiva de las bandas de proteína de 83 kDa, 102 kDa y 121 kDa en el PS de toros ROMO. La banda de 83 kDa podría corresponder a la gelsolina (Belleannée et al., 2011) que protege a las células de efectos tóxicos (Jobim et al., 2004) y regula la motilidad y viabilidad del espermatozoide (Ickowicz et al., 2012). En tanto, la banda de 102 kDa, podría ser el péptido beta-manosidasa (Kelly et al., 2006), la cual se le relaciona con la interacción de espermatozoide-oocito (Belleannée et al., 2011) y con la implantación y desarrollo inicial del embrión (Venditti et al., 2010). La presencia de esta banda de proteína en el PS de toros ROMO podría influenciar las mayo- res tasas de fecundación reportadas en estos toros raza con respecto a los CCC.
Cuadro 4 Ecuaciones de los modelos construidos a partir de la cantidad relativa de cada banda. Ecuaciones a través de regresión hacia adelante como aproximación para explicar las variables de calidad seminal de toros Romosinuano y Costeños con Cuernos.

Viabilidad espermática en semen fresco (VF), viabilidad espermática en semen descongelado (VPC), motilidad individual rápida progresiva en semen fresco (MIRPF), motilidad individual rápida progresiva en semen post descongelación (MIRPPC), motilidad individual rápida progresiva en semen y motilidad masal en semen fresco (MMF)
Los análisis mostraron mayor número de bandas de proteínas relacionadas con los parámetros de calidad espermática en toros ROMO. El análisis de correlación general solo evidenció correlaciones en semen fresco y descongelado de toros ROMO. En semen fresco se evidenció relación positiva entre la VF y las proteínas de 13 y 83 kDa. La banda de 13 kDa posiblemente corresponda a la BSP A3 que ha sido reportada con este peso molecular, y que se caracteriza por tener un potencial electrostático negativo (Mungai et al., 2011), lo cual le permite pre- servar su integridad. Kumar et al. (2012) y Muhammad et al. (2014) la han asociado con fertilidad de toros tipo carne.
La correlación positiva de la banda de 83 kDa (posible gelsolina) podría deberse a que en semen fresco esta proteína no provoca despolimerización de la actina, al encontrarse unida a fosfoinositidos, con lo cual la actina se mantendría polimerizada (Ickowicz et al., 2012), lo que podría contribuir con la integridad de la membrana espermática.
Se encontró correlación positiva entre la CE y las proteínas de 75 y 102 kDa en semen fresco de toros ROMO. Aunque no se ha reportado investigaciones que asocien estas proteínas con la CE, la proteína de 75 kDa podría ser la clusterina, que actúa como chaperona al solubilizar péptidos parcialmente desnaturalizados por efectos del estrés celular, por lo que reduciría los efectos tóxicos de proteínas desnaturalizadas sobre los espermatozoides (Mascarenhas et al., 2009), manteniendo la CE en niveles deseables. Por otro lado, no se tienen reportes que señalen relación alguna de la banda de 102 kDa (posible β-manosidasa) con la CE.
Cuando los datos se analizaron por componentes principales, la VF se vio influenciada de manera positiva por las bandas de 13, 83 y 121 kDa y negativa por la banda de 15 kDa. No se conoce el papel de la banda de 121 kDa en el funcionamiento del espermatozoide, pero esta relación sugiere que puede actuar como protectora de la membrana del espermatozoide. Por otro lado, la acción de la banda de 15 kDa sería de provocar la salida de colesterol de la membrana espermática, conduciendo a su desestabilización y a la capacitación espermática.
El análisis de componentes principales evidenció relaciones positivas con las proteínas de 21, 25 y 174 kDa, y negativa con la banda de 15 kDa. La banda de 21 kDa pue- de ser aquella identificada por Mungai et al. (2007) en toros Limousin con peso molecular de 20 kDa, que fue asociada con la recuperación de la permeabilidad de la membrana espermática del espermatozoide sometido a choque térmico. De la misma forma, Barrios et al. (2000) reportaron una proteína de 20 kDa en PS de ovinos, que sería responsable de la restauración de la membrana del espermatozoide sometido a procesos de estrés térmico por frío. Por otro lado, la banda de 25 kDa podría tratarse de TIMP-2 (Moura et al., 2007), parte de la familia de las proteínas inhibidoras de las metaloproteinasas, las cuales se relacionan con la membrana y la fusión de los gametos. En tanto, la banda de 174 kDa podría tratarse de la reportada en PS de toros Simmental (Baharun et al., 2021), con peso molecular entre 156 y 180 kDa, que se relacionó con la fertilidad del animal y que basado en su peso molecular se trataría de la proteína reguladora del complemento C3 (180 kDa). Estas proteínas son posiblemente importantes en la interacción del plasma seminal con la respuesta inmunológica del tracto femenino (Rodríguez-Martínez et al., 2011).
El análisis de componentes principales para las variables de motilidad (MMF y MIRPF) en semen fresco mostró que son influenciadas por las mismas bandas de pro- teínas y con igual comportamiento que las que influyen en la CE en semen fresco. Es interesante la relación negativa entre MIRPF y la proteína de 15 kDa, en caso se trate de la BSP A1/A2, ya que esta proteína se ha aso- ciado con la motilidad espermática (Abou et al., 2009; Srivastava et al., 2013). Como se sabe, las BSP, además de participar en la capacitación del espermatozoide, evidencian habilidad para prolongar la sobrevivencia y la motilidad del espermatozoide en el oviducto (Gwathmey et al., 2006).
El análisis de correlación evidenció en semen crio preservado que relaciones negativas entre las proteínas y VPC y MIRPPC. Las proteínas de 75 y 83 kDa correlacionaron con VPC, mientras que MIRPPC con las bandas de 68, 75, 83 y 174 kDa. La banda de 75 kDa puede ser la clusterina, la cual aglutina espermatozoides anormales (Ollero et al., 1998), y que en este caso podría estar ejerciendo su acción sobre los espermatozoides afectados por la crio preservación, disminuyendo los porcentajes de espermatozoides motiles y viables (Ibrahim, 1999). Con res- pecto a la banda de 83 kDa (posible gelsolina), Azamar et al. (2007) demostraron que pue- de inhibir drásticamente la motilidad individual de los espermatozoides de cobayos, aun- que la acción depende de su concentración (Belleannée et al., 2011). Los papeles ex- puestos para esta proteína explicarían la relación negativa encontrada con la VPC y la MIRPPC en esta investigación. Con respecto a la banda de 68 kDa (posible albúmina por su peso molecular) y 174 kDa no se han reportado relaciones con la motilidad, pero el resultado sugiere que esté actuando como un factor de anti-motilidad.
El análisis de componentes principales para semen pos-descongelado en ROMO involucró 9 de las 10 proteínas que de una u otra forma se han relacionado con los parámetros de calidad seminal. Las proteínas de 13, 68, 75, 83 y 121 kDa se relaciona- ron negativamente con VPC, PHT, MIRPPC, Progresividad, MPPC, RPPC, mientras que las de 21, 25, 102 y 174 lo hicieron positiva- mente. En cuanto a MIRPPC persisten las relaciones negativas con las proteínas de 68, 75 y 83 kDa encontradas en el análisis de correlación general, y se suman además las proteínas de 13 y 121 kDa.
Para VPC y PHT, el análisis corroboró la relación negativa con las proteínas de 75 y 83 kDa en el procedimiento de correlación general. De otra parte, la BSP A3 (posible- mente la banda de 13 kDa) posiblemente incrementa los sitios de unión en la membrana del espermatozoide para las BSP por pérdida de proteínas en la membrana espermática (Ollero et al., 1998), los cuales quedan disponibles para interactuar con el espermatozoide (Ardon y Suarez, 2013). Es- tos planteamientos pueden explicar la relación negativa de la banda de 13 kDa con la VCP y PHT en este estudio.
Un aspecto interesante lo constituye las relaciones positivas entre la VPC y PHT y las proteínas de 21, 25, 102 y 174 kDa. La proteína de 21 kDa puede corresponder con aquella ligada a la recuperación de la permeabilidad de la membrana espermática que ha sido sometida a choque térmico (Mungai y Machado, 2007). Por otra parte, la proteína de 25 kDa (posible TIMP2), influye sobre la viabilidad del espermatozoide mediante la inhibición de la actividad de las metalo-proteinasas (McCauley et al., 2001) y la de 102 kDa (posible beta-manosidasa) se ha relacionado con la modulación de la adhesión célula-célula (Belleannée et al., 2011), por lo cual su papel puede estar indirectamente relacionado con el mantenimiento de la viabilidad del espermatozoide.
El análisis por componentes principales en toros CCC evidenció el mismo patrón de relacionamiento de las proteínas tanto en semen fresco como pos-descongelado con los parámetros de calidad seminal involucrados. Las proteínas de 15 kDa y 174 kDa se relacionaron positivamente con MM, MIRP y CE en semen fresco, mientras que la de 75 kDa se relacionó negativamente. Igual relación se vio entre estas proteínas y los parámetros VPC, MIRPPC, PPC, RPPC y MPPC.
Como se ha dicho, uno de los papeles de la proteína de 15 kDa (posible BSPA1/A2) está relacionado con la motilidad espermática (Espitia et al., 2006). En cuanto a la CE no se conoce relación con las proteínas de 15 y 174 kDa, mientras que la banda de 75 (posible clusterina) ha sido relacionada negativa- mente con motilidad espermática (Ibrahim, 1999), lo cual explicaría lo encontrado en semen fresco. En semen congelado de toros CCC, el análisis de componentes principales infiere que las proteínas de 15 kDa y 174 kDa podrían ayudarles a mantener la motilidad de los espermatozoides en condiciones de crio preservación, mientras que la relación positiva con VPC sugiere un efecto protector de la membrana espermática por parte de esta proteína en condiciones de estrés por crio preservación.
Existen asociación entre proteínas cuya relación depende el funcionamiento del espermatozoide de las razas criollas involucradas en este estudio. Igualmente se aprecia que ante aspectos estresantes como la crio preservación, un mayor número de ellas intervienen e inciden en el proceso reproductivo. Así mismo proteínas como las de 20, 75, 83, 102 y 174 kDa, tienen efectos sobre varios parámetros de calidad espermática tanto en semen fresco como crio preservado, lo que sugiere que juegan un papel de gran importancia, y que forman parte importante dentro un conjunto de proteínas que aseguran el adecuado funcionamiento del espermatozoide.
Respecto al análisis de regresión en toros ROMO, los modelos indicaron la existencia de cuatro proteínas (bandas de 15, 68, 75 y 83 kDa) que se repiten en al menos tres de los modelos seleccionados (p<0.05). Por otra parte, en toros CCC se evidenció la existencia de tres proteínas (21, 25 y 75 kDa) que se repiten en los modelos seleccionados (p<0.05). Asimismo, llama la atención que en los tres análisis realizados en semen de toros ROMO, tanto en semen fresco como crio preservado, las bandas de 75 y 83 kDa participan o se relacionan con el comportamiento de varios parámetros de calidad espermática, mientras que la banda de 75 kDa en toros CCC es la que denota una mayor participación o relación con el comportamiento de los parámetros de calidad seminal.
CONCLUSIONES
El estudio describió por primera vez las diferencias en el perfil electroforético de las proteínas del plasma seminal de toros Romosinuano y Costeño con Cuernos.
Tres proteínas de alto peso molecular se evidenciaron exclusivamente en toros Romosinuano.
Un mayor número de proteínas se relacionaron con variables de calidad seminal en toros Romosinuano, tanto en semen fresco, como en semen pos-descongelado que en toros Costeño con Cuernos.
La banda de 75 kDa se presenta en ambas razas y tiene relación con las variables de calidad seminal en semen fresco y pos-descongelado.












 uBio
uBio