INTRODUCCIÓN
Los camélidos sudamericanos (CSA) están representados por dos especies domésticas: llama (Lama glama) y alpaca (Vicugna pacos), y por dos silvestres: guanaco (Lama guanicoe) y vicuña (Vicugna vicugna) (FAO, 2005). La vicuña (Vicugna vicugna) habita la zona altoandina, entre los 3000 y 4600 msnm. Su hábitat ecológico es un ecosistema frágil caracterizado por escasas lluvias, bajas temperaturas, alta radiación so- lar y pobre producción primaria. Se le encuentra mayormente en las altas mesetas del centro y sur del Perú, la zona occidental de Bolivia, el norte de Chile y el noroeste de Argentina (CONACS, 2005).
La información sobre enfermedades parasitarias en vicuñas en semicautiverio es escasa, siendo la mayor parte de los estudios realizados en alpacas y llamas. Las vicuñas constituyen actualmente uno de los recursos naturales de los denominados módulos de uso sustentable, que podrían beneficiar a las comunidades campesinas con el aprovecha- miento de la fibra obtenida durante los llama- dos «chaccus» (Tuppia, 2009; MINAGRI - DGFFS, 2012).
Diversos estudios en Perú han determinado prevalencias de helmintos gastrointestinales en alpacas, con valores de 80.3% (Chávez, 1995), 63% (Contreras, 2012), 54.2% (Farfán, 2014), 68.4% (Pérez et al., 2014) y 90% (Roncal, 2014). En el caso de las vicuñas, Quispe (2011) reportó una pre- valencia de 80.8% y Torres (2016) de 89.29% en estercoleros de vicuñas, en tanto que Castillo et al (2012) reportó una prevalencia de 53.8% en guanacos.
El parasitismo gastrointestinal en los CSA repercute directamente sobre la ganancia de peso y la producción de fibra afectan- do los ingresos de los productores. Los signos clínicos varían según la especie de helminto presente, así como del estado inmune, sexo, nutrición y edad (Leguía y Casas, 1999). Incluso el parasitismo podría afectar la supervivencia de las vicuñas, ya que estos animales silvestres en semicautiverio son capturados en eventos anuales (Chaccu), siendo la única oportunidad de poder realizar algún tipo de evaluación y/o control sanitario.
El presente estudio tuvo como objetivo estimar la prevalencia y cargas de helmintos gastrointestinales en vicuñas en una zona de Cajamarca, Perú, así como determinar su asociación con las variables edad y sexo e identificar los géneros parasitarios presentes.
MATERIALES Y MÉTODOS
El estudio se realizó en el Fundo Virgen de las Mercedes, distrito de Contumazá, provincia y departamento de Contumazá, Perú, durante el mes de agosto de 2015, correspondiente a la época seca. La temperatura mínima y máxima durante el estudio fue de 7.2 y 22.6 °C, respectivamente y precipitación pluvial entre 0.1 a 27.7 mm (INEI, 2017).
La toma de muestras se realizó luego del arreo y atrape de los animales en el denominado «Chaccu», llevado a cabo el 8 de agosto de 2015, durante la época seca. Para el cálculo del tamaño de muestra se utilizó la fórmula de proporciones para poblaciones fi- nitas (Daniel, 1996), con un nivel de confianza del 95%, proporción referencial de 90% (Roncal, 2014), tamaño de la población aproximada de 1200 vicuñas (información otorga- da por la Asociación de criadores de Vicuñas Pozo Kuan Contumazá (ACRIVIC), y error máximo admisible del 5%. El tamaño de muestra calculado fue de 125 vicuñas, pero se llegó a recolectar 208 muestras de heces.
Las muestras (15 g) se recolectaron directamente del recto, utilizando bolsas de plástico individuales. Se determinó el sexo, grupo etario (crías: <1 año; juveniles: 1-3 años; adultos: >3 años) con base a la dentición (Wheller, 1982). La toma de muestras fue supervisada por un representante del Consejo Nacional de Camélidos Sudamericanos experto en esta determinación. El material fecal fue almacenado en recipientes térmicos con refrigerante para su transporte y posterior análisis en el Laboratorio de Parasitología de la Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos, en Lima.
En la evaluación coproparasitológica se utilizaron las técnicas cualitativas de flotación con Solución de Sheather (solución saturada de azúcar) y sedimentación rápida para el diagnóstico de nematodos y cestodos, así como de trematodos, respectivamente (Lumbreras et al. 1962; Rojas, 2004), además de la técnica cuantitativa de McMaster modifi- cada para la estimación de la carga parasitaria (Rojas, 2004). Las muestras de heces positivas a huevos tipo Strongylus fueron agrupadas según los grupos etarios y cultivadas mediante el método de Corticelli y Lai (1963) para la obtención de las larvas L3 y recuperándolas por el método de Baerman (Hansen y Perry, 1994). Los géneros de las larvas infectivas fueron determinados mediante características morfológicas y biométricas, a través de la captura digital y procesamiento de imágenes utilizando el programa Leica Application Suite v. 4.0 (Rojas, 1990; Leguía y Casas, 1999), previa inmovilización con solución yodo-yodurada (Rojas, 2004).
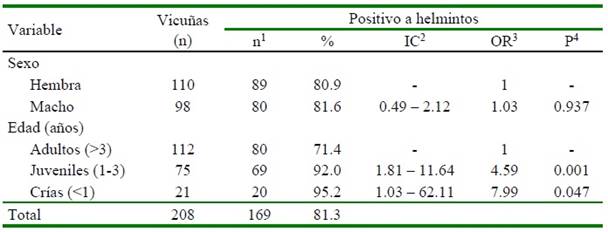
Cuadro 1. Prevalencia de helmintos en vicuñas en Contumazá (Cajamarca, Perú) mediante examen coproparasitológico (agosto, 2015)
1 Positivos; 2 Intervalo de confianza; 3 Odds ratio; 4 Valor de p
Se calculó la prevalencia de helmintos e intervalos de confianza a partir de la pro- porción de muestras positivas. Se evaluó los factores de riesgo, edad y sexo con la presencia de helmintos mediante la prueba de regresión logística (Daniel, 1996). Asimismo, para evaluar la asociación entre estas variables y los géneros de helmintos se utilizó la prueba de Chi cuadrado, empleando el software SPSS v. 25.0.
RESULTADOS
La prevalencia general de helmintos (nematodos y cestodos) fue de 81.3 ± 5.3%, con una menor prevalencia en adultos (p<0.05), y sin diferencia significativa entre sexos (Cuadro 1). La variable edad constituyó un factor de riesgo para la presentación de helmintiasis, siendo las crías y juveniles más susceptibles para la presentación de helmintos (p<0.05), respecto a los adultos (Cuadro 1).
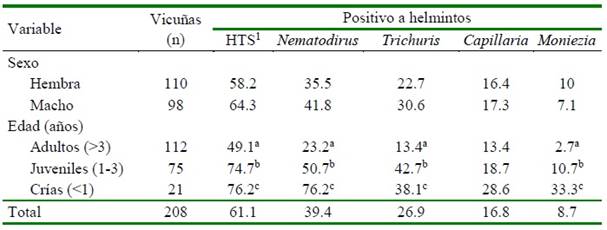
Se hallaron huevos de helmintos pertenecientes al grupo de los estrongílidos o Huevos tipo Strongylus (HTS), así como de los géneros Nematodirus, Trichuris, Capillaria y Moniezia, siendo los de mayor prevalencia los HTS (61.1%) (Cuadro 2). Se halló aso- ciación significativa (p<0.05) entre la prevalencia de los huevos de HTS, Nematodirus, Trichuris y Moniezia con los grupos etarios, mas no así con el género Capillaria (Cua- dro 2).
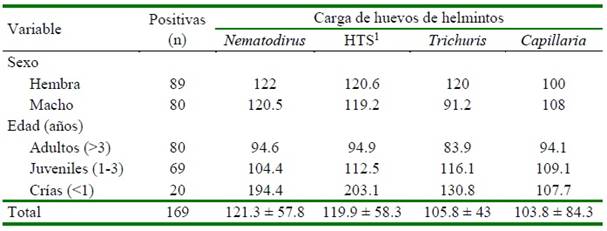
El promedio de huevos por gramo de heces (hpg) o carga parasitaria fue similar entre géneros, variando de 121.3 hpg para Nematodirus y de 103.8 hpg para Capillaria (Cuadro 3). En el cultivo de larvas se pudo identificar larvas infectivas (L3) pertenecien- tes a los huevos HTS, evidenciándose Cooperia spp (39.6%), Trichostrongylus spp (20.8%), Ostertagia spp (17.6%), Oesophagostomum spp (12.9%), Haemon- chus spp (5.4%) y Bunostomum spp (4.0%).
Cuadro 2. Presencia porcentual de huevos de helmintos en vicuñas en Contumazá (Cajamarca, Perú) (agosto, 2015)
1 Huevos tipo Strongylus
a,b,c Superíndices diferentes dentro de columnas y variables indican diferencia estadística (p<0.05)
DISCUSIÓN
El 81.3% de las vicuñas capturadas durante el chaccu en la zona de Contumazá en agosto de 2015 estuvo infectado por helmintos. Evaluaciones similares, realizados en vicuñas del anexo de Mamuta del CPM Maure-Kallaupuma del distrito y provincia de Tarata. Tacna, Perú por Quispe (2011) encontró en el mes de octubre una prevalencia de helmintos de 80.8%, en tanto que Roncal (2014), al evaluar 10 alpacas beneficiadas en el camal municipal de Cajamarca durante agosto y setiembre indicó que 9/10 estaban infectadas. A pesar de que el muestreo de dichos estudios se hizo a finales de la época seca, donde las condiciones medioambientales no son las más propicias para los nematodos (Leguía y Casas, 1999), y algunas especies podrían encontrarse arrestadas o en hipobiosis (Quiroz, 2005), se obtuvieron prevalencias mayores de 80%, lo que indica que los CSA se encuentran en contacto permanente con helmintos en menor o mayor grado dependiendo de la contaminación ambiental.
Una temperatura de 15 °C y una precipitación pluvial mínima de 50 mm mensual es ideal para la supervivencia de las formas larvarias y la infección por helmintos (Rojas, 2004); sin embargo, la temperatura promedio mínima y máxima fue de 7.2 y 22.6 °C, respectivamente con una precipitación pluvial que varió entre 0.1 a 27.7 mm durante la época seca, lo que probablemente habría afecta- do la sobrevivencia de las formas inmaduras de los estrongyloideos en las pasturas y haya incrementado las larvas hipobióticas en los animales (Leguía et al., 1995). Asimismo, el desarrollo de huevos de Nematodirus spp ocurriría en época de seca, cuando las temperaturas son bajas (alrededor de 10 °C) en la noche y altas en el día (McMahon et al., 2017).
No se hallaron huevos de F. hepatica, probablemente debido a las condiciones me- dio ambientales, las cuales no eran compatibles con las condiciones mínimas de temperatura ambiental (10-30 °C) y precipitación pluvial no menor de 50 mm necesarias para el desarrollo de huevos, hospedero intermediario y persistencia de las formas infectivas (metacercarias) de F. hepatica (Leguía, 1991). Sin embargo, Londoñe et al. (2009) demostraron tanto la presencia de caracoles Lymnaeidae (hospedero intermediario) como formas larvarias de F. hepatica en altitudes superiores a los 4000 m, por lo que probable- mente durante la época de lluvias se podría establecer este trematodo.
La disponibilidad de pasturas nativas en buen estado en el área de crianza permitiría a la vicuña poder resistir a diversas enferme- dades, entre ellas las endoparasitarias. Según MINAGRI - DGFFS (2014), el estado de los pastos en Cajamarca fue categorizado de 33.3 y 66.7% para pasturas en buen y regular estado, respectivamente. Un factor importante para considerar es la capacidad de carga animal, dada por el estado de las pasturas y la especie animal a pastorear. En el caso de las vicuñas, bajo condiciones de sus pasturas, que van desde regular y buen estado, aparentemente correspondería a una carga animal de 1.65 a 3.33 animales/ha/año (Flórez et al., 1992).
Estudios realizados en estercoleros de vicuñas en la reserva nacional «Pampas Galeras Barbara D´Achille» mostraron una frecuencia de helmintos gastrointestinales de 89.3% (Torres, 2016), mientras que en la Reserva de Fauna en Chimborazo, Ecuador, determinaron que las áreas con mayor carga de huevos de helmintos gastrointestinales pre- sentaban un mayor porcentaje de humedad, sin que la altitud fuera un factor determinan- te (Chacaguasay, 2016).
La variable sexo no representó un factor de riesgo en la presentación de helmintiasis gastrointestinal (Cuadro 1), debido probable- mente a que las hembras y el macho realizan las mismas actividades dentro de su grupo social. Similares resultados fueron hallados en siete comunidades que manejan vicuñas en los departamentos de La Paz y Oruro en Bolivia, durante los meses de octubre y diciembre (Ruiz, 2016), así como en alpacas (Contreras, 2012; Farfán, 2014; Pérez et al., 2014; Roncal, 2014) en diversas localidades del Perú.
La variable edad es considerada un factor de riesgo en la presentación de helmintos, evidenciando que las vicuñas menores del año (crías) y las comprendidas en juveniles entre 1 a 3 años, mostraron 7.9 y 4.6 mayor riego de infección que las adultas, debido probablemente a la deficiente respuesta inmune durante los primeros años de vida (Leguía y Casas, 1999). Resultados similares fueron observados para el caso de recuento de huevos de Marshallagia sp y HTS en vicuñas de comunidades de dos departamentos en Bolivia (Ruiz, 2016)
La mayor evidencia parasitaria correspondió a los HTS (61.1%) seguido por Nematodirus spp (39.4%), Trichuris spp (26.9%), Capillaria spp (16.8%) y Moniezia spp (8.7%) (Cuadro 2). En el estudio en vi- cuñas del Anexo de Mamuta en Tacna, reali- zado por Quispe (2011), se halló una alta pre- valencia de Trichuris spp (81.4%), seguido de Nematodirus spp (15.5%) y HTS (20.6%), mientras que Ruiz (2016) reportó para siete comunidades de dos departamentos de Bolivia Marshallagia spp (60%), HTS (76.9%), Trichuris spp (66.7%), Nematodirus spp (40%); diferencias que pueden deberse a las condiciones climáticas y de manejo propias de cada zona o región (Leguía y Casas, 1999; Rojas, 2004).
En lo que respecta al género Moniezia, las crías fueron las más afectadas (33.3%), encontrándose una prevalencia general de 8.7% (Cuadro 2). Este cestodo fue hallado por Ruiz (2016) en vicuñas jóvenes en Bolivia con una prevalencia de 11.5%, mientras que Torres (2016) reportó una frecuencia de 26.8% en estercoleros de vicuñas en la Re- serva Nacional de Pampa Galeras. Por otro lado, Quispe (2011), en vicuñas de Tacna no reportó su presencia.
La carga parasitaria fue mayor en las crías con respecto a los grupos de juveniles y adultos, mostrando cargas desde 107.7 hasta
203.1 hpg, según el tipo de helminto. Se conoce que la inmunidad no se desarrolla de forma adecuada hasta los 2 años de vida, por lo que las crías son más susceptibles a una infección parasitaria (Leguía y Casas, 1999).
En este sentido, Mamani (2012) encontró un efecto significativo de la transmisión de la carga parasitaria de las madres a sus crías en alpacas y llamas de 90.2 al 100%.
Los resultados indicarían una carga parasitaria baja si se considera lo afirmado por Latorre (1995). quien indicó que cargas menores de 500 hpg evidenciarían cargas subclínicas. Asimismo, Duncanson (2012) indica que CSA con crías al pie y cargas superiores a 2000 hpg evidenciarían signos clínicos e incluso cargas superiores a 500 hpg evidenciarían enfermedad, dependiendo del estado inmune, nutrición y la edad del animal.
Se conoce que el hábito de los CSA de excretar sus heces usando «estercoleros» (áreas específicas en los pastizales) determinaría una menor probabilidad de infectarse son sus propios helmintos gastrointestinales; sin embargo, los CSA podrían infectarse con parásitos de bovinos y ovinos cuando comparten las áreas de pastura con este tipo de animales (Leguía y Casas, 1999), así como cuando se rompe el equilibrio con la carga animal en pastoreo (Méndez et al., 1982).
El mayor porcentaje de larvas obtenidas en el coprocultivo correspondieron al género Cooperia (39.6%), siendo este resulta- do similar a los reportes de Contreras (2012) y Pérez et al. (2014) en alpacas. La alta prolificidad diaria (1000 a 3000 huevos) según Boom y Sheath (2008) y la capacidad de realizar arresto larvario o hipobiosis en temperaturas extremas favorecen la supervivencia de este nematodo (Fowler, 1998; Soulsby, 1993). Larvas de otros géneros que se obtuvieron en el cultivo correspondieron a Trichostrongylus, Ostertagia, Oesopha- gostomum, Haemonchus y Bunostomum con frecuencias entre 4 y 21%. Entre ellos resalta el género Ostertagia, que general- mente realiza hipobiosis durante la época de heladas y sequías (mayo-agosto).
CONCLUSIONES
Se encontró una prevalencia de 81.3% en helmintos en vicuñas en el distrito de Contumazá, Cajamarca.
La carga parasitaria promedio de nematodos fue menor a 200 hpg, siendo considerada como baja.
La prevalencia de helmintos estuvo asociado a la edad, donde las crías y juveniles mostraron 7.99 y 4.59 veces mayor riesgo de parasitismo gastrointestinal que las adultas.
Se identificaron helmintos de los géneros Nematodirus, Cooperia, Trichuris, Trichostrongylus, Capillaria, Osterta- gia, Oesophagostomum, Haemonchus, Bunostomum y Moniezia.












 uBio
uBio