INTRODUCCIÓN
En el Perú existen aproximadamente 5.1 millones de cabezas de ganado bovino (INEI, 2012), y el 78% se encuentra en la sierra. De estos, el 70% pertenece a comunidades campesinas y pequeños propietarios (Rosemberg, 2018). El departamento de Ayacucho tiene una población bovina de 414 000 cabezas y la provincia de Parinacochas de 49 275 (INEI, 2012). La ganadería bovina es la actividad económica más importante para las familias de esta provincia (Aronés et al., 2003; INEI, 2012); siendo principalmente su crianza de tipo extensiva (MINAG, 2015).
La ganadería bovina es afectada por una serie de enfermedades infecciosas, sien- do la Rinotraqueitis Infecciosa Bovina(IBR) una de las más importantes en el país (SENASA, 2015). Esta enfermedad de dis- tribución mundial afecta principalmente el tracto respiratorio y reproductivo de losbovinos (Ortiz et al., 2019) y es causado por el virus herpes bovino tipo 1 (HVB1) de la familia Herpesviridae, subfamilia Alphaher- pesvirinae, género Varicellovirus (ICTV, 2017). La transmisión se puede dar de manera directa mediante contacto con bovinos infectados que presenten secreciones respiratorias, oculares y del tracto reproductivo, o de manera indirecta a través de fómites como agua, alimento, inseminación artificial o máquinas de ordeño. El virus al ingresar se re- plica en las células epiteliales del tracto respiratorio o reproductivo, y se disemina vía sanguínea o nerviosa. El virus puede generar una infección latente, tanto en el ganglio como en la tonsila, pudiendo reactivarse bajo condiciones de estrés (Jones, 2019).
Estudios epidemiológicos en el país de- muestran que la IBR está presente en diversas provincias, reportándose una seroprevalencia de 67.6% en la provincia de Parinacochas (Zacarías et al., 2002). En Puno se han realizado tres estudios, con re- portes entre 7.7 y 22.5% en los distritos de Azángaro, Nuñoa, y Huancane (Vilca, 2014; Estofanero, 2015; Tevez, 2015), mientras que en Arequipa se registró una prevalencia de 20.2% (Del Carpio, 2013).
La virulencia de la cepa influye en la gravedad de la infección (Levings y Roth, 2013). Se presentan diversos signos clínicos, siendo de mayor importancia la ocurrencia de abortos, el cual se produce entre las 3 a 6 semanas pos-infección, principalmente entre el 5° y 8° mes de gestación. En algunos casos, hay placentitis, ya que se ha evidenciado que los posibles cambios ocurren como una infección secundaria por el HVB1 (Muylkens et al., 2007; Nandi, 2009). La manera más eficaz de controlar la infección por IBR se basa en el diagnóstico, vacunación, bioseguridad y manejo (Maidana et al., 2018). Para el diagnóstico existen alternativas como la prueba de aislamiento viral, detección de antígeno viral, detección de ácido nucleico y detección de anticuerpos (Fernández et al., 2018; Caldow et al., 2018). Ante esto, el objetivo del presente estudio fue determinar la frecuencia de presentación de bovinos seropositivos a anticuerpos contra el virus de la rinotraqueitis infecciosa bovina en la sierra sur del país.
MATERIALES Y MÉTODOS
Lugar del Estudio y Animales
El estudio se realizó en los distritos de Chumpi, Coracora y Pullo, de la provincia de Parinacochas, Ayacucho. La zona se encuentra a una altitud que abarca desde los 2800 hasta los 3500 msnm (Aronés et al., 2003). Se trabajó con bovinos de crianza extensiva a partir de los cuatro meses de edad. Se registró la categoría zootécnica, raza o grupo racial, sexo, procedencia y estado reproductivo (Rojas, 2010), información que fue proporcionada por los propietarios de las ganaderías en estudio. La selección de los animales fue en forma aleatoria.
El tamaño mínimo muestral fue determinado mediante la fórmula de tamaño de muestra para poblaciones finitas (Wayne, 2012). El total de la población bovina de estudio fue de 27 063 animales (Chumpi: 5339; Coracora: 13 988 y Pullo: 7736). Se tomó como referencia el estudio de Zacarías et al. (2002) quién reportó una seroprevalencia de 67.59%, tomándose un nivel de confianza de 95% y un error de 5%, lo cual resultó en un tamaño de muestra de 337 bovinos. Se realizó la estratificación de las muestras requeridas para cada distrito según su población referencial, donde se obtuvo tamaños de muestra de 66, 173 y 96 animales para Chumpi, Coracora y Pullo, respectivamente; no obstante, se pudo incrementar el muestreo debido a la disponibilidad de materiales y disponibilidad de animales, realizando el estudio con 460 muestras de suero bovino.
Muestras
Las muestras de sangre se recolecta- ron mediante punción en la vena yugular en tubos Vacutainer® de 10 ml. Las muestras fueron centrifugadas en el Laboratorio del Centro de Salud de la ciudad de Coracora a 1600 G por 5 minutos para obtener el suero sanguíneo y colectarlo en viales de 2 ml. El suero fue almacenado en congelación a -20 °C hasta su análisis en el Laboratorio de Micro- biología y Microscopía de la Universidad Cien- tífica del Sur, Lima, para confirmar la presencia de anticuerpos frente a rinotraqueitis infecciosa bovina mediante el método de ELISA indirecto, empleando el kit IDEXX IBR gB®.
Análisis de Datos
Se determinó la prevalencia corregida mediante la fórmula de Thrusfield (1990) tomando en cuenta los índices de sensibilidad (97.4%) y especificidad (92.4%) del kit comercial empleado, con sus respectivos intervalos de confianza al 95% (Wayne, 2012). Además, se determinó la asociación entre la presencia de anticuerpos contra IBR frente a la edad, sexo, raza, lugar de procedencia y estado de preñez utilizando la prueba de Chi cuadrado, mediante el paquete estadístico STATA 15.0.
RESULTADOS
Se obtuvo una seroprevalencia de 61.09 + 4.42% (281/460) y una prevalencia corregida de 59.56 ± 4.45% de bovinos positivos a IBR (Cuadro 1). Se detectaron anticuerpos en los tres distritos evaluados, siendo significativamente mayor en Pullo, con una prevalencia corregida de 71.58 + 4.09%. Con res pecto a la categoría zootécnica, tanto los terneros como las vacas presentaron una alta prevalencia (Terneros: prevalencia corregida de 77.19 + 3.80%, Vacas: 65.56 + 4.31%).
Las mayores seroprevalencias corregidas según el grupo racial se presentaron en el ganado Holstein (92.77 + 2.35%) y en Brown Swiss (68.44 + 4.21%). Por último, no se presentó asociación estadística significativa para la variable sexo ni para el estado reproductivo (vacía, preñada).
Cuadro 1. Determinación de la frecuencia de anticuerpos contra IBR en bovinos de crianza extensiva (n=460) en la provincia de Parinacochas, Ayacucho, Perú
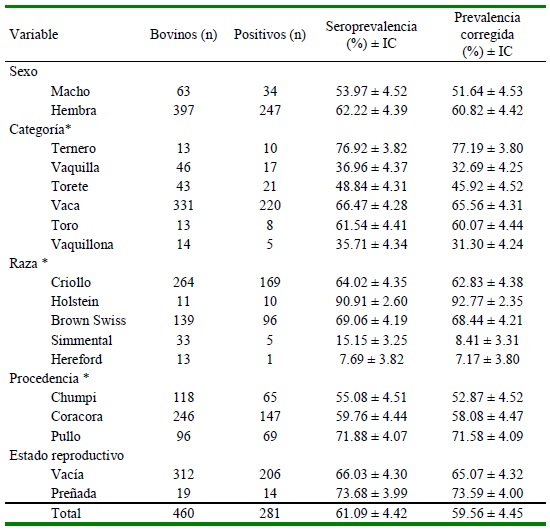
* Las variables procedencia, categoría y raza presentan asociación significativa (p<0.05) frente a la presencia de IBR
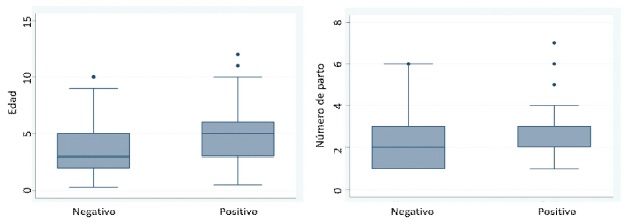
En los diagramas de caja y bigotes (Fi- gura 1) se muestra la dispersión asimétrica- para las edades y número de partos de los bovinos evaluados de acuerdo con el resultado de la prueba diagnóstica. Se puede apreciar la presencia de valores atípicos. En el caso de la edad, el rango de los bovinos negativos a la prueba varía entre 4 meses a 10 años, presentándose la mayoría de negativos en el rango de 2 a 5 años; mientras que los bovinos positivos varían entre las edades de 6 meses a 12 años, mayormente entre 3 a 7 años y con una mediana de 5 años.
DISCUSIÓN
Se encontró una seroprevalencia corregida de anticuerpos contra rinotraqueitis infecciosa bovina de 59.56 ± 4.32% (281/46), lo cual indica que estos bovinos en algún momento de su vida fueron expuestos a dicho virus. La seroprevalencia encontrada fue similar al 67.6 ± 4.2% reportado para esta provincia por Zacarías et al. (2002), posible- mente porque no se han implementado mayores estrategias de control y prevención contra la enfermedad. Por otro lado, la evaluación hecha por el SENASA a nivel nacional en 2010, donde se evaluaron una serie de enfermedades infecciosas en el ganado bovino, se reportó una prevalencia de 31.73 ± 4.86% para el departamento de Ayacucho y entre 8.2 y 31.7% para los departamentos colindantes (SENASA, 2010). Otros estudios en el país reportan prevalencias entre 7.7 y 22.5%, para varios distritos de Puno (Vilca, 2014; Estofanero, 2015; Teves, 2015) y de 20.2% en Arequipa (Del Carpio, 2013). Por otro lado, se encontró una baja seroprevalencia en Cajamarca (0.62%), valor muy por debajo de los reportados en otras localidades del país (Villacaqui et al., 2006).
La rinotraqueitis infecciosa bovina es considerada en Europa como una enfermedad infectocontagiosa de carácter importan- te, por lo que se cuenta con un adecuado pro- grama de control y erradicación donde utilizan vacunas con marcadores, las cuales son seguras y efectivas, además de utilizar protocolos que permiten llegar a un diagnóstico preciso (Raaperi et al., 2014); medidas tales que han posibilitado que el virus sea erradicado de Austria, Dinamarca, Finlandia, Suecia, Suiza y Noruega (Ackerman et al., 2006) entre otros países.
Con respecto a las variables evaluadas, la variable procedencia presentó asociación estadística significativa (p<0.05), siendo Pullo la zona más afectada con una prevalencia corregida de 71.58% + 4.09% (69/96) (Cuadro 1). Pullo, es el distrito que presenta más deficiencias tecnológicas para un adecuado control veterinario, además que los bovinos se encuentran en crianza extensiva, donde los distintos rebaños no presentan límites entre potreros o áreas de pastoreo alguno, facilitándose el contagio entre bovinos, lo que explicaría la mayor prevalencia (MINANG, 2015).
La categoría zootécnica presentó una asociación significativa (p<0.05) con la positividad de la prueba, encontrándose las mayores prevalencias corregidas en terne- ros (77.2 ± 3.8%) y vacas (65.56 ± 4.31%), pudiendo deberse al estrecho contacto entre ternero y madre. Las vacas son animales que han sido expuestos por más tiempo y han pasado por diversos factores estresantes (Boelaert et al., 2005; Villacaqui et al., 2006). También, estas hembras frecuentemente pasan por monta natural e inseminación artificial, por lo que se encuentran más expuestas, pues no existe control absoluto, tanto de las pajillas de inseminación, como en los machos que son utilizados de reproductores. Se conoce que el semen es un medio de diseminación, tanto en la fase aguda como en la fase de latencia de la enfermedad (Pawar et al., 2014). Además, se reconoce la participación del humano como medio de contaminación a los animales (Raaperi et al., 2014); siendo estos considerados como factores de riesgo para la infección (Givens, 2018).
Los animales Holstein y Brown Swiss presentaron una seroprevalencia corregida significativamente mayor (p<0.005) que el ganado criollo (92.77 ± 2.35 y 68.44 ± 4.21% vs 64.02 ± 4.35%, respectivamente). Las condiciones climáticas en las zonas muestreadas desafían la salud de estas razas (Bharti et al., 2017). Además, la crianza en altura, ante una baja presión de oxígeno, afecta a estas razas, ya que presentan mayores problemas de adaptación medioambientales (Begazo et al., 2017). Por otro lado, se debe considerar que esta enfermedad no es conocida entre los ganaderos, por lo que al observar en los animales algún signo clínico se cree que la causa es otra (Rivera, 2001; Ochoa et al., 2012).
La variable sexo no presenta asociación estadística significativa (p>0.05) con el resultado de la prueba diagnóstica. En este sentido, Abad et al. (2016) consideran que una de las principales formas de contagio es la de transmisión sexual (sementales sin control sanitario, inseminación artificial, transferencia de embriones); sin embargo, Van Schaik et al. (2001) consideran que los machos tienen más riesgo de infección por su comportamiento, en tanto que Raaperi et al. (2010) menciona que la infección en los machos pue- de ocurrir ante un mal manejo durante la colecta de semen. En el presente estudio, tanto machos como hembras presentan seroprevalencias altas (Cuadro 1), debido a la ausencia de un programa de control para IBR.
Por último, la variable estado reproductivo tampoco presentó asociación estadística significativa con el resultado de la prueba diagnóstica, pudiendo presentarse la infección tanto en vacas vacías como preña- das, tal y como ha sido reportado por Graham (2013).
CONCLUSIONES
Se determinó una prevalencia corregida de 59.56 ± 4.45% (281/460) de rinotraqueitis infecciosa bovina en los distritos de Coracora, Chumpi y Pullo de la provincia de Parinacochas, Ayacucho durante 2018.
Las variables procedencia, categoría zootécnica y raza presentan asociación estadística significativa (p<0.05) frente al virus de la IBR.












 uBio
uBio