INTRODUCCIÓN
Un problema de salud pública es la presentación de enfermedades transmitidas por alimentos (ETA), siendo estas causantes de morbilidad y mortalidad en humanos y animales, teniendo un impacto negativo en el mercado internacional de productos alimenticios (Rodríguez et al., 2015). La incidencia de las enfermedades de este tipo se ha ido incrementando, en parte, por el desarrollo del mercado de alimentos y cambios en los hábitos alimenticios (Palomino y González, 2014).
Las ETAs presentan diferente sintomatología y evolución. Su manifestación depende del tipo del contaminante y cantidad del alimento consumido, siendo los signos clínicos más comunes el vómito, diarrea, dolor abdominal, dolor de cabeza y fiebre (Reuben y Treminio, 2002). Los insumos alimenticios como el pollo, huevo y subproductos semicrudos son responsables de casi la mitad de las epidemias (Del Pozo et al., 2001) y, en menor medida, la carne de res y cerdo (Ruiz et al., 2018). Además, existen diferentes características que contribuyen a su presentación, como la procedencia desconocida, el incumplimiento de las buenas prácticas de manipulación y la contaminación cruzada, entre otros (FAO, 2016).
El alimento BARF (Biologically Appropriate Raw Food), especialmente pre- parado para perros y gatos, incluye ingredientes tales como carne de pollo, res, caballo y pavo, huesos, verduras y/o vísceras. Este tipo de alimento crudo, en general, debe mantener una cadena de frío adecuada que evite la proliferación de microorganismos patógenos, ya que sus ingredientes son perecibles (Fredriksson-Ahomaa et al., 2017).
Existen enfermedades de tipo zoonótica, donde las mascotas pueden transmitir enfermedades a sus propietarios principalmente a partir del contacto con las heces (Acha y Szifres, 2001; Cangui y Delgado, 2019), entre ellas, Salmonella spp es la segunda bacteria más reportada en el mundo, la cual posee más de 2600 serotipos y se divide en dos especies: S. enterica y S. bongori; siendo la primera la más común y causante de infecciones transmitidas por alimentos, ocasionan- do problemas entéricos e incluso la muerte (Barreto et al., 2016). Puede habitar en el intestino delgado del humano y animales, y sobrevivir por largos periodos en ambientes cálidos y húmedos (CFSPH, 2005).
Estudios en alimentos tipo BARF en Estados Unidos de Norteamérica, Suecia y Canadá reportan ocurrencias entre 2.6 y 20% para Salmonella spp (Nemser et al., 2014; FDA, 2018; Hellgren et al., 2019; Weese et al., 2005). En el Perú existen alimentos BARF oficialmente reconocidos por el Servicio Nacional de Sanidad Agraria (SENASA) para ser expedidos como tales, además de otros tipo BARF que se encuentran en pro- ceso de reconocimiento. Para los fines del presente estudio, se consideron los dos tipos de alimentos como BARF. El presente estudio buscó identificar la posible presencia de Salmonella enterica y sus características de resistencia antibiótica presente en alimentos tipo BARF en expendio en Lima, Perú.
MATERIALES Y MÉTODOS
Se recolectaron muestras de alimentos para perros BARF de 13 marcas comercializadas en Lima Metropolitana, Perú, entre ju- lio y diciembre de 2019. Estos alimentos eran presentados en envases al vacío de 1 kg, con registro de marca y tipo de ingredientes. Las muestras colectadas para el estudio se en- contraban dentro del periodo de vida útil de los productos. El tamaño de muestra se determinó mediante la fórmula para estimar pro- porción en poblaciones no finitas, teniendo como prevalencia referencial 5% (Arcos- Ávila et al., 2013), nivel de confianza 95% y error admisible del 5%, resultando un tamaño mínimo de muestra de 60 unidades (EpiTools Epidemiological Calculators, 2019); sin embargo, se consideró tomar de 9 a 10 muestras por marca comercial dando un to tal de 124 muestras evaluadas.
Las muestras fueron transportadas al Laboratorio de Microbiología en la Universidad Científica del Sur (Villa El Salvador, Lima) en un cooler a 4 °C y conservadas en congelación (-18 °C) hasta su procesamiento (OIE, 2004), siguiendo las recomendaciones de conservación de cada producto. Para el procesamiento, las muestras fueron homogenizadas, tomándose 10 g por muestra para ser diluidas en 90 ml de agua peptonada tamponada (Merck) a temperatura ambiente. Las mues- tras fueron incubadas a 37 °C durante 24 h; luego se inoculó 1 ml de esta solución en 9 ml del medio modificado Rappaport-Vassiliadis y se incubó a 41 °C durante 48 h. Finalmente, se realizó la resiembra en agar xilosa-lisina- desoxicolato (XLD) y se incubó a 37 °C durante 24 h (OIE, 2004).
Las cepas bacterianas sospechosas fueron evaluadas mediante pruebas bioquímicas convencionales: citrato de Simmons, lisina, tres azucares, formación de sulfuro de hidrógeno, formación de indol, motilidad y urea, a fin de lograr su identificación. Las cepas compatibles fueron inoculadas en crioviales con caldo tripticasa de soya con 15% de glicerol y almacenadas a -20 °C (CLSI, 2012) hasta la realización del antibiograma.
Las cepas mantenidas en crioviales fueron descongeladas a temperatura ambiente para la preparación del inóculo. Una azada de cada tipo de bacteria fue inoculada y cultivada en 4 ml de caldo tripticasa de soya e incubada a 37 °C hasta por 6 h, permitiendo alcanzar la turbidez estándar de 0.5 de la es- cala de Mc Farland (INS, 2002). Los antibióticos fueron elegidos en base a reportes que recomiendan su uso para la determinación de resistencia a Salmonella enterica (Briceño et al., 2007; Ríos et al., 2019).
Las cepas fueron sembradas en agar Muller Hinton para determinar la resistencia antibiótica mediante el método de difusión de Kirby-Bauer, utilizando 16 antibióticos: cefalexina (30 μg), cloranfenicol (30 μg), tetraciclina (30 μg), gentamicina (10 μg), tobramicina (10 μg), sulfatrimetoprim (25 μg), ampicilina (10 μg), kanamicina (30 μg), cefazolina (30 μg), ciprofloxacino (5 μg), cefotaxima (30 μg), neomicina (30 μg), enrofloxacino (30 μg), ceftriaxona (30 μg), ácido nalidixico (30 μg), ceftazidima (30 μg). Las placas fueron incubadas a 37 °C durante 18-24 h y la interpretación se realizó por el tamaño del halo de inhibición mediante el método de disco difusión en agar (CLSI, 2015).
Cuadro 1 Frecuencia de muestras analizadas y positivas a Salmonella enterica por marca comercial de alimentos tipo BARF en Lima, Perú (2019)
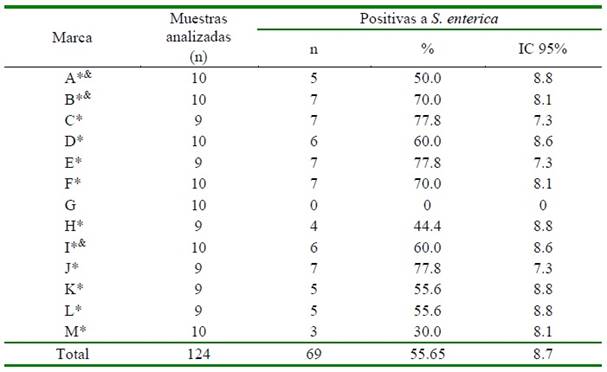
IC: Intervalo de confianza al 95%
& Marcas que cuentan con registro sanitario del SENASA
* Asociación mediante la prueba exacta de Fisher (p<0.05)
Los resultados se presentan en tablas de frecuencia de contaminación por Salmo- nella enterica de los alimentos tipo BARF. El análisis mediante la prueba exacta de Fisher se utilizó para determinar la asociación (p<0.05) entre la variable presencia de Salmonella (variable cualitativa) frente a tipo de marca e insumos (variables cualitativas), utilizando el programa Stata v. 12.0.
RESULTADOS
La frecuencia encontrada para Salmonella enterica en el alimento tipo BARF fue de 55.6 + 8.7% (69/124); además, se encontró asociación estadística significativa (p<0.05) con la marca del alimento BARF (Cuadro 1). Las marcas con mayor porcentaje de positividad a S. enterica fue- ron las marcas C, E y J (77.8%; 7/9), B (70.0%; 7/10) e I y D (60%; 6/10) (Cuadro
Cuadro 2. Frecuencia de muestras analizadas y positivas a Salmonella enterica según el tipo de carme en alimentos tipo BARF en Lima, Perú (2019)
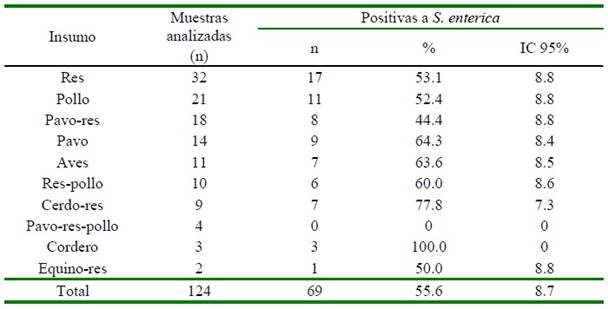
IC: Intervalo de confianza al 95%
1). Los insumos (tipo de carne) que presentaron mayor porcentaje de positividad a Salmonella enterica fueron los alimentos elaborados a base de carne de cordero (100%; 3/3), cerdo y res (77.8; 7/9) y pavo (64.4%; 9/14) (Cuadro 2); no obstante no se encontró asociación significativa (p>0.05) entre los principales ingredientes del alimento y el diagnóstico de S. enterica
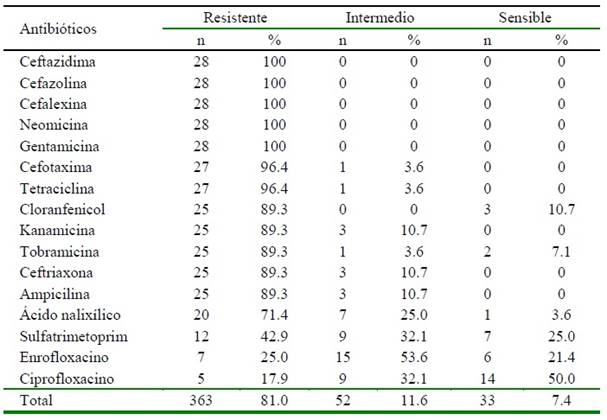
Se analizaron 28 cepas con 16 antibióticos, resultando 100% resistentes a ceftazi- dima, cefazolina, cefalexina, neomicina y gentamicina, 96.4% a cefotaxima y tetraciclina, 89.3% a cloranfenicol, kanamicina, tobramicina, ceftriaxona y ampicilina, 71.4% a ácido nalidixico y 42.9% a sulfatrimetoprim; así como 53.6% de resistencia intermedia para enrofloxacino y 50% de sensibilidad para ciprofloxacino (Cuadro 3).
DISCUSIÓN
El 55.6% (69/124) de las muestras resultó positiva a Salmonella enterica (Cuadro 1); frecuencia mayor a la reportada en estudios en alimentos crudos para perros en otros países, con ocurrencias de 2.6% (15/576), 6.6% (4/60) y 20% (5/25) (Weese et al., 2005; Nemser et al., 2014; Hellgren et al., 2019). Las menores frecuencias reportadas pueden ser circunstanciales, o diferir por el año de realización, el número de muestras utilizadas, y la calidad de los insumos, entre otros; sin embargo, también indica el grado de cumplimiento de las buenas prácticas de manufactura necesarias en la producción, procesamiento, y expendio de alimentos (Hellgren et al., 2019).
Cuadro 3 Determinación de resistencia antibiótica de cepas de Salmonella enterica aisladas de alimento tipo BARF comercializado en Lima, Perú (2019)
La frecuencia de contaminación con S. enterica entre las 13 marcas varió entre 0 a 77.8%. Los alimentos de tres marcas pre- sentaron una positividad de 77.8% (Cuadro 1). Este alto nivel de contaminación fue superior al caso del estudio reportado por Van Bree et al. (2018), quienes trabajaron con ocho marcas, encontrando que una de ellas llegó a tener 2 de 8 muestras positivas. Por otro lado, las marcas «A», «B», e «I» del presente estudio cuentan con registro sanitario vigente emitido por SENASA al momento de la ejecución del estudio, el cual establece la normativa respecto a la inspección de instalaciones, equipos, y vehículos utilizados en la elaboración de estos alimentos; sin embargo, no se realiza el análisis microbiológico que permita descartar patógenos que podrían afectar la salud animal y pública (SENASA, 1998).
La marca G, con insumos de res-pavo- pollo y solo res, fue la única que no presentó contaminación por S. enterica (Cuadro 1), a pesar de las características del muestreo en diferentes lotes, resultado similar al de Aquino (2020) en Ecuador, quién no encontró contaminación por este patógeno en alimento tipo BARF de cuatro marcas. Según Bustos (2006), la cadena de frío durante el procesa- miento, la calidad de sus insumos y las buenas prácticas de manufactura en la preparación del alimento tipo BARF asegura la inocuidad de los alimentos.
Respecto a los ingredientes del alimento BARF, todas las muestras de carne de cordero (3/3) estuvieron contaminadas por S. enterica. Esta proporción es mayor a lo re- portado por Van Bree et al. (2018), donde el 25% de los productos con carne de cordero resultó contaminado.
Los alimentos BARF se comercializan en congelación aproximadamente a -18°C, lo cual aseguraría la muerte de Salmonella enterica, pues para la eliminación de esta bacteria es posible a temperaturas entre 0 y -10 °C, sin que esto resulte en una condición de esterilización absoluta (Robledo, 2015), posiblemente debido a la relación con la materia orgánica que representan estos tipos de carne; tal como se evidencia con los resultados reportados en este estudio, donde los productos tipo BARF de 12 de las 13 mar- cas estudiadas estuvieron contaminadas por Salmonella enterica, y mantuvieron dicha condición a pesar de la congelación y des- congelación recomendada por los fabrican- tes. En las indicaciones del alimento BARF se menciona calentar el alimento por 3 min; sin embargo, esto no sería eficaz para la destrucción de esta bacteria, pues se reconoce que S. enterica puede sobrevivir a temperaturas entre 7 a 49 °C (MINSALUD, 2011). En este sentido, Castro et al. (1997) demostró que el efecto del tiempo (15´) y temperatura (93 °C) de la cocción en horno de microondas con una potencia de 1800 watts no fue suficiente para destruir a Salmonella spp.
Los alimentos BARF tienen como principales ingredientes carne de res, aves de corral, huevo y pescado, entre otros, y estos son reservorios comunes de Salmonella spp (Heredia et al., 2014). En el presente estudio no se encontró asociación significativa (p>0.05) entre los principales ingredientes evaluados del alimento y el diagnóstico de S. enterica, de allí que el tipo de insumo no ten- dría relación con la presencia de la bacteria. Además, el muestreo corresponde a diferentes momentos en el tiempo, sin que esto re- presente un tipo de muestreo secuencial y consecutivo, lo cual muestra que la contaminación con Salmonella spp puede estar relacionada con inadecuada condición de calidad sanitaria de los insumos, manipulación de los insumos, equipos y materiales contaminados, y/o puntos críticos en la manufactura (Ar- cos-Ávila et al., 2013); quedando por lo tanto, evaluar las buenas prácticas de manufactura, entre otros.
Se encontraron altos niveles de resistencia antimicrobiana para la mayoría de los antibióticos evaluados (Cuadro 3), en comparación con muestras humanas en pacientes hospitalizados donde se reportó resistencia de 20 y 12.5% a cefotaxima y ceftriaxona, respectivamente (Ibarra et al., 2005). Esta resistencia se debería a que los antibióticos empleados en el estudio son de uso frecuente y de forma inadecuada para el tratamiento de diversos procesos infecciosos en anima- les de granja (Hernández et al., 2017).
El cloranfenicol mostro una resistencia del 89.3% (Cuadro 3), en comparación con el 90% de resistencia reportado por Ríos et al. (2019) en muestras de cerdos faenados en un matadero de Lima. Este antibiótico está prohibido desde año 1994 en la Unión Europea como terapéutica en animales por la resistencia que genera frente a microbios que- dando residuos de este fármaco en la carne para el consumo humano (Talero-Pérez et al., 2014); sin embargo, la falta de regulación en el país facilita su empleo y desarrollo de resistencia con los riesgos que representan para la salud animal y humana.
La resistencia a la ciprofloxacina (17.9%) y una resistencia intermedia de 53.6% a enrofloxacino (Cuadro 3), superior a la resistencia observada por Briceño et al. (2007) es un indicativo que las cepas de Salmonella están siendo resistentes al grupo de las fluoroquinolonas.












 uBio
uBio 

