INTRODUCCIÓN
Las enfermedades zoonóticas son infecciones transmitidas desde los animales al ser humano y viceversa (OMS, 2018), a partir las cuales se han realizado algunos estudios encaminados en la identificación de los patógenos asociados con su presentación, comprensión de su patogenia, reconocimiento y asociación con factores de riesgo, mecanismos de transmisión, diagnóstico, tratamiento y estrategias de prevención y control, constituyéndose en aportes importantes para el mantenimiento de la salud, tanto de las poblaciones humanas como en los establecimientos de producción animal (Marvin et al. 2010). Teniendo en cuenta lo anterior, la Organización Mundial de la Salud (OMS), la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y la Organización Mundial de la Salud Animal (OIE) desarrollaron el concepto de «One Health» o «Una Salud», para hacer alusión al abordaje integral de las problemáticas que no solamente afecta la salud de los humanos sino también la de los animales y del ambiente (OIE, 2020). Este concepto se enfoca en diseñar e implementar programas, políticas e investigación en el que múltiples sectores se comunican y trabajan juntos para lograr mejores resultados en salud pública, con particular relevancia en las áreas de seguridad alimentaria, control de las zoonosis y el con- trol de la resistencia a antibióticos (Acha y Szyfres, 2001; Acero-Aguilar 2016).
Las necesidades nutricionales de la humanidad incluyen el consumo de proteína animal obtenida a partir de cadenas productivas que en ocasiones favorecen la transmisión de patógenos. Es así que las zoonosis asociadas con la producción porcícola pue- den ser causadas por agentes de tipo viral, bacteriano y parasitario. Dentro de los patógenos virales se encuentran influenza, rotavirus y hepatitis E (Acha y Szyfres, 2001; Chaussade et al., 2013; de Schryver et al., 2015; Ukuli y Mugimba 2017; Pulido- Villamarín et al., 2020a); entre los de tipo protozoario se menciona a Balantidium coli, Cryptosporidium spp y Toxoplasma gondii, y entre los helmintos a Taenia solium/ Cysticercus cellulosae, Ascaris spp, Trichuris spp y Trichinella spp (Pulido- Villamarín et al., 2014, 2019; Mendoza- Gomez et al., 2015), y entre las bacterias se ha reportado a Brucella spp, Leptospira interrogans, Mycobacterium spp, Salmonella spp y Yersinia spp (Acha y Szyfres, 2001; Djurkoviæ-Djakoviæ et al., 2013; Uddin et al., 2013; Rivera-Benitez et al., 2014; Burniston et al., 2015; Giraldo-Car dona et al., 2019, Pulido-Villamarín et al., 2019, 2021).
El diagnóstico de las patologías causa- das por estos patógenos requiere especial atención, pues aunque en algunos países se cuenta con herramientas diagnósticas de laboratorio, el diagnóstico clínico diferencial puede ser difícil debido a la presencia de manifestaciones clínicas inespecíficas (Kitch y Meredith 2020), por lo que es importante reconocer sus particularidades y los factores de riesgo relacionados con cada patógeno, para lograr un diagnóstico definitivo preciso.
En Colombia, el sector porcícola ha pre- sentado incrementos importantes en su producción durante los últimos años, situación que se refleja en la producción anual de la carne de cerdo, donde al cierre de 2019 (406 085 t) fue 10.4% superior con respecto a 2018 (367 895 t) (PorkColombia, 2019). Los establecimientos porcícolas productivos se encuentran ubicados principalmente en los departamentos de Antioquia (29.7%), Valle del Cauca (14.4%), Cundinamarca (8.9%), Meta (6.0%), Córdoba (6.0%), Magdalena (4.2%), Sucre (3.3%) y Boyacá (3.1%), con una población nacional de 6 473 525 anima- les (ICA, 2010; González y González 2019).
El crecimiento del sector porcícola tecnificado y semitecnificado representa un importante beneficio económico para el país (PorkColombia, 2019, 2020); sin embargo, una mayor tasa de producción porcícola aunada a ciertas condiciones socioeconómicas, hábitos y en algunos casos, medidas deficientes de higiene, tanto por parte de la población humana como desde la misma producción porcícola, podrían tener un impacto negativo en la salud de las comunidades, desencadenando la aparición y/o rotación de patógenos causantes de enfermedades zoonóticas. Ante esto, el presente trabajo tuvo como objetivo identificar los factores de riesgo ocupacionales asociados a la transmisión de enfermedades zoonóticas relacionadas con la porcicultura mediante una revisión de la literatura tipo panorámica para tener un acerca- miento inicial a la problemática de la transmisión de estas patologías en el contexto particular de trabajadores de granjas porcícolas no tecnificadas o informales en «traspatio» y que pueda ayudar a la comprensión de esta situación en la comunidad porcicultora de Colombia y de otros países en vías de desarrollo.
MATERIALES Y MÉTODOS
Se realizó una «Scoping review» (Munn et al., 2018; Sucharew y Macaluso, 2019), mediante una búsqueda de artículos científicos publicados en revistas indexadas disponibles en las bases de datos MEDLINE, Web of Science y SciELO a partir de términos DeCs y términos libres teniendo en cuenta las temáticas de Zoonosis o enfermedades transmitidas por cerdos, Factores de riesgo y Cerdos/Porcinos o granjas porcícolas traspatio
Los términos utilizados en las bases de datos MEDLINE y Web of Science fueron: «Risk Factor*», ‘’Zoonoses», ‘’Disease transmitted by swine», «Swine», «Backyard breeding pigs», «Farmyard pigs» y se excluyeron de la búsqueda términos que se aso- ciaran a animales silvestres como: «Feral»,
«Wild» o «Boar». Adicionalmente se realizaron búsquedas mediante las fórmulas: «risk factor*» AND (zoonoses OR «diseases transmitted by swine*») AND (swine OR «backyard breeding pigs» OR «farmyard pigs») NOT (feral OR wild OR boar). Los términos usados en la base de datos SciELO fueron: «Factores de riesgo», «Enfermedades zoonóticas» y «Cerdos»; con las fórmulas «Factores de riesgo enfermedades zoonóticas» y «Factores de riesgo cerdos».
Posteriormente se revisó el título y resumen/abstract de cada artículo y se procedió a seleccionar aquellos que cumplían con los criterios de inclusión/exclusión
Criterios de inclusión:
Artículos en español, inglés o portugués.
Artículos publicados entre 2000 y 2019.
Artículos relacionados con factores de riesgo para transmisión de enfermedades zoonóticas en trabajadores de granjas porcícolas.
Artículos relacionados con condiciones de higiene y medidas de bioseguridad en gran- jas porcícolas.
Artículos relacionados con enfermedades zoonóticas transmitidas por cerdos.
Artículos que establecieran un nexo de contagio para una enfermedad zoonótica entre cerdo y humano.
Criterios de exclusión:
Artículos que se limitaran a enfermedades en cerdos sin establecer un nexo epidemiológico con el ser humano.
Artículos enfocados a las técnicas utilizadas para el diagnóstico de enfermedades en cerdos.
Artículos que se enfocaran exclusivamente en la fisiopatología de una enfermedad zoonótica
RESULTADOS
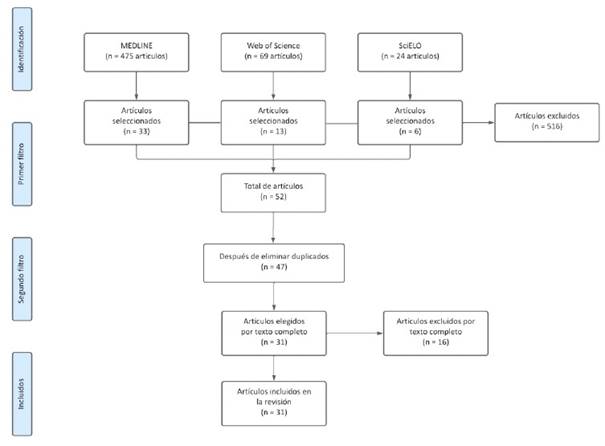
Inicialmente, se obtuvo un total de 544 artículos en MEDLINE y en Web of Science y 24 artículos a partir de SciELO. Luego de la revisión y de tener en cuenta los criterios de inclusión y exclusión establecidos, así como de revisar el resumen y el texto completo, 16 artículos no cumplían con lo definido y fueron eliminados. Finalmente se seleccionaron y se analizó en detalle el texto completo de 31 documentos (Figura 1).
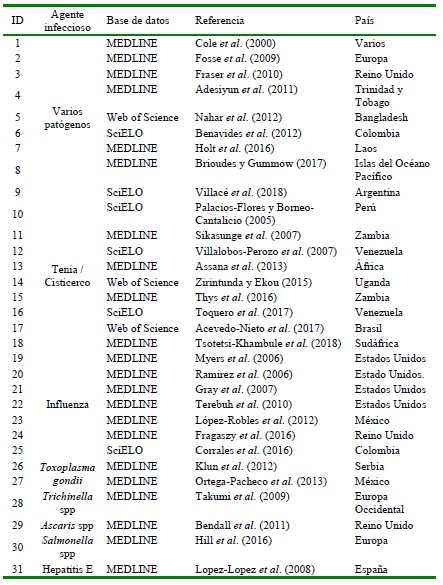
La mayor cantidad de reportes (29%) correspondió a artículos que asociaban diferentes patógenos zoonóticos como riesgo para la salud pública (n=9), así como en patologías relacionadas con Cisticercosis/Teniasis (n=9), seguido de Influenza (n=7) y en menor pro- porción aquellos relacionados individualmente con patógenos como Toxoplasma gondii (n=2), Trichinella spp, Ascaris spp, Salmonella spp y Hepatitis E, cada uno con un solo documento (Cuadro 1).
Influenza
Es causada por un virus ARN de la familia Orthomyxoviridae. Posee un genoma segmentado. Se reconocen los serotipos A, B, C y D y, adicionalmente, se clasifican en subtipos de acuerdo con el tipo de Neuraminidasa (NA) y Hemaglutinina (HA) presentes en su superficie. Pueden afectar más de una especie animal; sin embargo, los cerdos se consideran como reservorios importantes del patógeno (López-Robles et al., 2012; Fragaszy et al., 2016).
Los trabajadores de granjas porcícolas presentan mayor riesgo de seropositividad frente al virus de la influenza con respecto a la población control. Myers et al. (2006) encontraron que personas que trabajaban en granjas porcícolas tuvieron una mayor probabilidad de ser seropositivos frente al virus H1N1 (17.4 vs. 0%) y al H1N2 de origen porcino (20.7 vs. 1.3%) que la población con- trol; resultado similar a lo reportado por Gray et al. (2007). Adicionalmente, se determinó una asociación entre el contacto específico con cerdos de cría y la presencia de altos títulos de anticuerpos contra los virus de influenza H1N1 de origen porcino (Ramírez et al., 2006; Terebuh et al., 2010; López-Robles et al., 2012; Corrales et al., 2016; Fragaszy et al., 2016). Por otro lado, Corrales et al. (2016) en Colombia, determinaron una mayor predisposición a la seropositividad de anticuerpos contra el virus de influenza tipo A en cerdos de precebo con respecto a otros grupos etarios, incluyendo los lechones en lactancia.
A pesar de la relación reportada entre exposición a porcinos y mayor seroprevalencia frente a diferentes serotipos del vi- rus de la influenza, dicho fenómeno no se acompañó en forma consistente con síntomas clínicos significativos (no se reportaron o no fueron evaluados), algo que podría explicarse por el desarrollo de anticuerpos contra este virus, fenómeno que podría haber condicionado el curso asintomático de la infección con cepas similares del virus (Terebuh et al., 2010).
Solamente el trabajo de Ramirez et al. (2006) en Estados Unidos se enfocó en algunos factores de riesgo asociados a la trans- misión de influenza en trabajadores de la industria porcícola, quienes encontraron que aquellos trabajadores que nunca u ocasional- mente usaban guantes cuando tenían contacto con cerdos, presentaban una mayor probabilidad (OR 30.3) de tener títulos altos de anticuerpos contra influenza con respecto a la población general, así como frente a los trabajadores que casi siempre usaban guan- tes. Por otro lado, aquellos trabajadores que fumaban también presentaban un riesgo mayor (OR: 18.7) para presentar títulos de anticuerpos elevados frente al virus de la influenza H1N1 respecto a sus colegas no fu- madores.
Cuadro 1 Documentos incluidos en la revisión de literatura sobre factores de riesgo ocupacionales en la porcicultura asociados a la transmisión de enfermedades zoonóticas
Por último, se resalta el aporte de Gray et al. (2007), quienes determinaron que aquellas personas sin exposición directa a los cerdos, pero con contacto con trabajadores porcícolas (en su mayoría cónyuges de los trabajadores) presentaban un riesgo elevado (OR: 28.2) para la presentación de altos títulos de anticuerpos frente a los subtipos H1N1 y H1N2 de los virus de influenza de origen porcino con respecto a los controles.
Teniasis-Cisticercosis
Es causada por el cestodo Taenia solium - Cysticercus cellulosae. Enferme- dad zoonótica de gran importancia debido a su alta prevalencia en zonas endémicas de los países latinoamericanos y a la gravedad del cuadro clínico en el caso de la neurocisticercosis (NC) (Toquero et al., 2017). El hospedero definitivo es el ser humano y el intermediario es el cerdo, y en ocasiones el humano. Su principal mecanismo de transmisión es por vía oral-fecal y esta se encuentra relacionada con las medidas de higiene y los sistemas de crianza de los cerdos (Agudelo-Flórez et al., 2009; Holt et al. 2016).
La seroprevalencia en cerdos cobra relevancia debido a que representa un factor de riesgo para la población humana, ya sea que su transmisión ocurre a través del con- sumo de la carne mal cocinada o mediante el contacto humano/cerdo durante la crianza (Agudelo-Flórez et al., 2009; Holt et al. 2016). Las prevalencias y seroprevalencias en la población porcina y humana difieren de forma importante entre estudios. Por ejemplo, en estudios realizados en el estado de Zulia, Venezuela, se encontró 15.2% de seroprevalencia en la población humana, sien- do de 28.9% en áreas rurales (Villalobos- Perozo et al., 2007; Toquero et al., 2017), mientras que Acevedo-Nieto et al. (2017) en Minas Gerais, Brasil, evidenciaron una pre- valencia de cisticercosis porcina del 5.3%. En estudios en África, Sikasunge et al. (2007) reportaron prevalencias de 30 a 52% en cerdos infectados con T. solium/C. cellulosae mediante pruebas como Ag-ELISA en Zambia, donde las unidades de producción tenían mínimo un cerdo positivo para cisticercosis porcina. Por su parte, en Soroti, Uganda, la prevalencia post mortem de cisticercosis en cerdos criados a campo abierto fue de 18.0% (Zirintunda y Ekou, 2015).
Los aspectos socioculturales se encuentran asociados al manejo de los porcinos. En Guanteng, Sudáfrica, se determinó que me- nos del 20% de los productores conocían el complejo de teniasis-cisticercosis (Tsotetsi- Khambule et al., 2018), en tanto que Sikasunge et al. (2007) encontraron que entre 85.5 y 98.0% de los participantes encuestados en Zambia no conocían la relación entre la teniasis humana y la cisticercosis porcina. En este estudio, más del 70% de los criadores sacrificaban sus animales para el autoconsumo, pero solo 14% inspeccionaba la carne en busca de cisticercos. Por otro lado, Thys et al. (2016) identificaron que, frente a las condiciones de escasez de alimento, los cerdos eran soltados al campo, lo que favorecía su exposición al consumo de heces humanas. Asimismo, se reconoció que la principal limitación para mejorar las medidas de higiene era de carácter económico.
En varios estudios, el sistema de crianza de los cerdos fue identificado como un factor de riesgo para el desarrollo de esta enfermedad, principalmente en aquellos sistemas que permitían que los cerdos vagaran libremente. Sikasunge et al. (2007) encontraron que 83.2% de 788 productores mantenía los cerdos en campo abierto, conducta que determina un riesgo, principalmente debido al hábito de coprofagia por parte de los cerdos que favorece la ingestión de heces humanas contaminadas con los huevos del cestodo. En este sentido, Acevedo-Nieto et al. (2017) determinaron que los cerdos criados en libertad tenían 17 veces más probabilidades de convertirse en seropositivos para cisticercosis que aquellos que siempre se mantenían confinados; asimismo, granjas don- de las heces humanas era regadas en campos o en áreas abiertas tenían una probabilidad 7.6 veces mayor de presentar cisticercosis porcina que aquellas en las que las he- ces se descartaban en pozo séptico.
Se han implementado estrategias educativas para mejorar el conocimiento de los factores de riesgo relacionados con la cisticercosis en la población y así prevenir la presentación de la enfermedad. En Perú, se realizó una intervención educativa durante seis meses en una comunidad rural evidenciándose que la población aumentó su conocimiento sobre los factores de riesgo para contraer teniasis/cisticercosis (Palacios-Flores y Bor- neo-Cantalicio, 2005).
Toxoplasmosis
El agente etiológico es Toxoplasma gondii, protozoo que pertenece al filo Apicomplexa, cuyo hospedero definitivo es el gato doméstico y posee múltiples hospede- ros intermediarios.
En Serbia se reportó una seroprevalencia en cerdos de 29%, determinándose la edad como factor de riesgo para el desarrollo de la infección (<8 meses; 15%; >8 meses: 41%) con un OR de 3.87, probable- mente debido a la exposición constante al microorganismo en los cerdos de mayor edad. Así mismo, las granjas de engorde o ceba representan un mayor riesgo (OR=3.96) con respecto a las granjas de ciclo completo (Klun et al., 2012).
En México, Ortega-Pacheco et al. (2013) encontraron seroprevalencias de 94.2% y prevalencias de 50.8% para T. gondii mediante ELISA y PCR, respectiva- mente, indicando que casi la mitad de los animales se encontraban en una fase reactiva crónica, atribuyéndolo a una exposición constante al microorganismo y al contacto constante con ooquistes. Asimismo, encontraron que granjas con menos de 400 cerdos tenían un riesgo de 27.9 veces mayor de transmisión del parásito que granjas con un número de cerdos superior; posiblemente debido a un mejor manejo, higiene e infraestructura. Por otro lado, la alimentación manual fue un factor de protección en comparación con alimentadores automáticos, donde el alimento puede quedar almacenado por periodos más largos, favoreciendo su contaminación.
Los trabajadores agropecuarios, tanto los relacionados con prácticas de campo como aquellos que laboran en plantas de beneficio, son considerados como un grupo laboral de alto riesgo para toxoplasmosis, habiéndose determinado presencia de anticuerpos para T. gondii de hasta de 38.1% en ganaderos/ trabajadores agrícolas y de 44.4% en trabajadores de plantas de beneficio (Adesiyun et al., 2011).
Brucelosis
Enfermedad causada por bacterias del género Brucella, perteneciente a la familia Brucellaceae. Benavides et al. (2012) encontraron una seropositividad de 8% mediante la prueba Rosa de Bengala en 37 operarios de una planta de beneficio en Pasto, Colombia, identificando como factores de riesgo el no usar guantes (OR=3.11) o delantal (OR=2.94) durante el proceso de beneficio de bovinos y porcinos, denotando la importancia del establecimiento de medidas de bioseguridad y el aumento en el riesgo de transmisión ante la falta de esta. Sin embargo, Adesiyun et al. (2011) en Trinidad no hallaron positividad fren- te a Brucella spp en los grupos de trabajado res evaluados.
Trichinellosis
Esta patología es causada por nematodos del género Trichinella, siendo Trichinella spiralis la de mayor frecuencia en cerdos. Su hospedero definitivo suele ser el humano y el hospedero intermediario es el cerdo y otras especies incluyendo al humano.
La presencia de ratas (hospedero intermediario) en granjas tipo traspatio en Europa Occidental representa un factor diseminador de triquinelosis. Un consumo mínimo de lar- vas por la rata diseminadora puede, si la rata es consumida por el cerdo y la carne de este es consumida cruda por el humano, asociar- se con una tasa de triquinellosis del 5% en la población humana expuesta (Takumi et al., 2009). Por otra parte, Holt et al. (2016), en un estudio en Laos, reportaron seroprevalencias para Trichinella spp entre 40 a 59% en la población humana y entre 9.3 a 14.4% en porcinos, encontrándose los valores más altos frente al parásito en aquellas personas con mejores prácticas de higiene y mejores condiciones sociales; sin embargo, atribuye- ron esta alta positividad a que dicha población tiene mayor y frecuente acceso al con- sumo de carne, posiblemente contaminada con el parásito.
Hepatitis E (VHE)
Esta patología es ocasionada por un virus RNA que pertenece a la familia Caliciviridae, y se encuentra presente en todo el mundo.
En el sur de España, Lopez-Lopez et al. (2018) encontraron una prevalencia general en las granjas de 76.9%, pero al realizar la evaluación individual en cada granja, esta estuvo entre 0 a 95%. Entre los factores de riesgo identificados fueron la crianza de cerdos en espacios abiertos (OR= 2.239), ausencia de medidas de bioseguridad, especialmente la ausencia del «sanitary ford» o vacío sanitario (OR=3.597), ausencia de un periodo de cuarentena (OR=2.723) y el con- tacto con otros animales domésticos (OR=3.893). También es importante destacar que la transmisión del virus de la hepatitis E puede estar vinculada al consumo de agua contaminada y su alta correlación con la exposición ocupacional (Holt et al., 2016).
Leptospirosis
Enfermedad causada por diferentes serovares de la Leptospira interrogans, per- teneciente a la familia Leptospiraceae.
En la investigación desarrollada por Adesiyun et al. (2011) en Trinidad se detectaron inmunoglobulinas (IgM) contra Leptospira spp en 1.3% de los ganaderos/ trabajadores agrícolas y 1% en trabajadores de una planta de beneficio, no pudiendo de- terminar factores de riesgo debido al escaso número de casos positivos. En el mismo sentido, Benavides et al. (2012) en Pasto, Colombia, no reportaron positividad frente a Leptospira spp en trabajadores de una planta de beneficio.
Salmonellosis
Conjunto de enfermedades causadas por Salmonella spp, bacteria perteneciente a la familia Enterobacteriaceae. Fosse et al. (2009), en su trabajo de revisión calcularon una prevalencia individual de 6.2% en heces y de 21.8% en granja. Estos autores determinaron que la presencia de la bacteria en la granja y su excreción fue favorecida por la administración de alimento seco contamina- do, medidas de bioseguridad deficientes y tratamiento antibiótico profiláctico durante el periodo de engorde.
Ascariasis
Causada por nematodos del complejo Ascaris lumbricoides / A. suum, cuyos hospederos definitivos son el humano y el cerdo, respectivamente. Bendall et al. (2011) indican que, aunque su implicación zoonótica ha sido poco cuantificada, la presencia de esta parasitosis en la región de Cornwall (Reino Unido) estuvo asociada con el hecho de vivir cerca de granjas de cerdos (22%, OR=4.65). En este estudio, tanto los nematodos de huma- nos como de los cerdos estuvieron emparentados desde el punto de vista filogenético, considerándose inicialmente una fuente porcina.
DISCUSIÓN
Con respecto al conocimiento de las zoonosis en general, el reporte de Villacé et al. (2018) evidencia, que, en la ciudad de Córdoba, Argentina, mediante una encuesta sobre el concepto «enfermedades zoonóticas», 94% de las personas reconocía que el ser humano puede contraer algún tipo de enfermedad a través del contacto con anima- les; sin embargo, solo 14% conocía el concepto y su definición. Asimismo, los encuestados indicaron que las medidas para evitar la transmisión de estas enfermedades fueron-lavado de manos luego de tocar al animal (82%), mantenimiento de la limpieza en los espacios donde habita el animal (71.3%) y consulta al veterinario (57.3%). Además, mencionaron conocer enfermedades zoonóticas del ámbito urbano como sarna, toxoplasmosis, psitacosis y salmonelosis; sin embargo, con excepción de la rabia, no fue clara su explicación con respecto a la forma como ocurre el contagio. El estudio demostró, por otro lado, un mayor conocimiento sobre el concepto de zoonosis y zoonosis más frecuentes entre mayor fuese el grupo etario y mayor el nivel socioeconómico o educativo.
La exposición ocupacional relacionada con la producción porcícola ha sido asociada con un diverso grupo de enfermedades cuyas implicaciones epidemiológicas se relacionan con la salud, tanto de los trabajadores expuestos como de las comunidades cercanas a las granjas. El conocimiento y las estrategias para divulgarlo han sido variadas. En Colombia se diseñó una estrategia pedagógica (Peña-Herrera et al., 2019) y se cuenta con una cartilla divulgativa que promueve la prevención de enfermedades zoonóticas relacionadas con la producción porcícola (Pulido-Villamarín et al., 2020b). En Canadá, el personal relacionado con la industria porcícola encuestado expresó que los microorganismos zoonóticos principalmente relacionados con esta industria eran Salmonella spp y el Virus de la Influenza (Marvin et al., 2010); situación que se puede extrapolar con los hallazgos de la literatura en el presente trabajo, donde 9 de 31 documentos son relacionados con el virus de la influenza. No obstante, para importantes patógenos zoonóticos como Salmonella spp, Leptospira interrogans y Brucella spp solo se halló un documento para cada uno, por lo que esta información permite inferir sobre la necesidad de realizar más y nuevos estudios. Por otro lado, este escaso hallazgo se puede atribuir al planteamiento metodológico y a la estrategia de búsqueda establecidas en el presente estudio.
Para facilitar la presentación y comprensión de los hallazgos, los factores de riesgo se dividieron en cuatro categorías:
Adopción y cumplimiento de medidas de bioseguridad en la granja porcícola
Las medidas de bioseguridad favorecen a la disminución de varios factores de riesgo compartidos por diversas enfermedades zoonóticas. Entre los factores de riesgo aso- ciados a la mayoría de estas infecciones se encuentran: La disposición inadecuada de heces humanas y animales, el acceso a agua contaminada y el ineficiente control de plagas, potenciales transmisores de patógenos. La disposición inadecuada de heces fue abordada principalmente en artículos de cisticercosis, aspecto evidente considerando que el cerdo se infecta al ingerir heces humanas contaminadas con huevos de Taenia solium. Si bien el estudio de Sikasunge et al. (2007) no encontró diferencias significativas en cuanto a teniasis humana entre los hogares que tenían letrinas y aquellos que no, esto podría estar influenciado por las prácticas de higiene de la comunidad y la contaminación de fuentes hídricas comunes. Por el contrario, en concordancia con la teoría etiopatogénica de la enfermedad, Acevedo-Nieto et al. (2017) hallaron una mayor frecuencia de cisticercosis porcina en granjas donde los propietarios desechaban sus propias heces a campo abierto, en lugar de hacerlo en un pozo séptico.
En cuanto al control de plagas y vectores, se identificó a los roedores, especialmente a la rata, como el factor de riesgo común para la transmisión de triquinelosis, toxoplasmosis y leptospirosis, entre otras (WHO y International Leptospirosis Society, 2003; Takumi et al., 2009; Klun et al., 2012; Pulido-Villamarín et al., 2021b), concluyendo con esto que la presencia de roedores ex- pone a la población humana y animal a la presencia de un sin número de patógenos zoonóticos, por lo que su control contribuye a disminuir la prevalencia de enfermedades zoonóticas en granjas porcícolas.
Sistema productivo y condiciones de manejo
El manejo de los animales incluye instalaciones, prácticas y características particulares en cada granja relacionadas específicamente con el sistema de cría de los anima- les, como el tipo de granja (engorde o de ciclo completo), el establecimiento del periodo de cuarentena al ingreso, la separación de grupos etarios y la presencia de animales en libre pastoreo.
Las granjas de ciclo completo manejan todas las etapas de crecimiento y desarrollo del cerdo, desde el nacimiento hasta que alcanzan el peso requerido para salir a beneficio (285 libras o 130 kg), mientras que en las granjas de engorde los cerdos ingresan con 40-50 libras y son llevados al peso en pie del mercado. Klun et al. (2012) demostraron que las granjas de engorde representan un mayor riesgo de infección por T. gondii que las de ciclo completo, probablemente debido a que estas últimas posee mejores condiciones de manejo y bioseguridad (acceso restringido, almacenamiento del alimento en sitios de difícil ac- ceso para otros animales, infraestructura del corral, comederos especializados y medidas activas para el control de plagas). Adicionalmente, el mismo estudio identificó un mayor riesgo de toxoplasmosis en cerdos mayores de ocho meses que en aquellos de menor edad, por lo que se postula que la separación por grupos etarios reduciría la probabilidad de tener una granja infectada en su totalidad.
El estudio de Holt et al. (2016) abordó la cuarentena de animales recientemente adquiridos como medida de control para enfermedades zoonóticas, específicamente para hepatitis E; sin embargo, el estudio no menciona la duración específica del aislamiento. Adicionalmente, aunque el reporte de Giraldo- Cardona et al. (2019) no fue uno de los estudios incluidos en los hallazgos bajo la estrategia metodológica establecida, los autores indican que la infraestructura y las condiciones de manejo en el corral pueden estar relacionadas con la presencia de Salmonella spp en granjas, especialmente cuando el agua suministrada a los cerdos proviene de fuentes superficiales y el suelo de los corrales es rugoso.
En cuanto a la presencia de animales en libre pastoreo, Acevedo-Nieto et al. (2017) encontraron que este sistema de crianza se correlaciona con una mayor tasa de seropositividad para Taenia solium/ Cysticercus cellulosae, similar a lo reportado por Sikasunge et al. (2007) dada la posibilidad de que los cerdos pueden ingerir heces humanas.
Medidas de bioseguridad del trabajador
La presente revisión no reveló estudio alguno que estableciera una relación directa entre el lavado de manos y el riesgo de trans- misión de infecciones zoonóticas; sin embargo, en varios artículos esta se considera una de las medidas que hace parte de las adecuadas conductas de higiene y sigue siendo un pilar fundamental en la prevención de enfermedades infecciosas en general. No obstante, como indican Tsotetsi-Khambule et al. (2018), si bien el lavado de manos es una práctica común, no necesariamente se realiza de manera adecuada, lo que favorecería el direccionamiento de medidas pedagógicas enfocadas en enseñar un adecuado lavado de manos (Pulido-Villamarín et al., 2020b).
El uso de guantes fue identificado como un factor protector frente la transmisión de enfermedades como influenza, brucelosis y hepatitis E (Ramirez et al., 2006; Benavides et al., 2012; Chaussade et al., 2013). Por otro lado, el correcto uso y adecuado mantenimiento de los elementos de protección personal, como las botas de los trabajadores podrían disminuir la carga de patógenos en las granjas, tal como se identificó en el estudio de Giraldo-Cardona et al. (2019) con la presencia de Salmonella spp en granjas porcícolas.
Conductas de riesgo
En esta categoría se agruparon aquellos factores de riesgo particulares relacionados con el comportamiento de los trabajado- res de las granjas. En la literatura revisada, se halló que tanto el hábito de fumar como el consumo de carne semicruda pueden estar asociados a un mayor riesgo de contraer infecciones zoonóticas. Concretamente, el cigarrillo se asoció a un mayor riesgo de infección por el virus de la influenza, fenómeno que podría estar relacionado con la exposición de mucosas al virus posterior al efecto lesivo de las micropartículas inhaladas (Rivera-Benitez et al., 2014). El consumo de carne semicruda, como ya ha sido mencionado, supone un factor de riesgo para el desarrollo de cisticercosis, toxoplasmosis y trichinellosis, dado que se consumirían los estadios infecciosos de los microorganismos. Este último factor cobra especial relevancia en el contexto de las granjas porcícolas informales en las que en ocasiones el animal es sacrificado y consumido por el mismo criador o los vecinos del sector, sin la vigilancia y la preparación adecuadas (Sikasunge et al., 2007). Al respecto, el estudio colombiano re- portado por Agudelo-Flórez et al. (2009) reveló que algunas poblaciones describen que la carne poco cocida y que posea cisticercos o «pepita»/»granalla» (nombre coloquial), la hace más jugosa, le da mejor sabor y que «al agregarle limón logra evitar cualquier infección», dejando en evidencia el riesgo al que muchas poblaciones se encuentran expuestas. De igual forma, en el estudio de Chaussade et al. (2013) se estableció que el consumo de hígado o salchichas de hígado mal cocidas se constituyeron como un factor de riesgo para la presentación de títulos altos de anticuerpos frente al virus de la hepatitis E.
En resumen, la revisión realizada per- mite proponer una estrategia de intervención integral efectiva para el control de factores de riesgo en poblaciones relacionadas con el sector porcícola. Dicha estrategia podría incluir, independientemente del tipo de sistema productivo, las siguientes medidas:
Control de plagas mediante un plan definido y que sea amigable con el ambiente.
Control del acceso y monitoreo de la calidad de las fuentes hídricas.
Adecuada disposición y manejo de heces humanas y animales mediante la implementación y uso de letrinas/pozos sépticos o estercoleros/composteras para el manejo de los desechos porcinos.
Lavado correcto y frecuente de manos.
Uso de guantes cuando se tenga contacto con los animales.
Educación sobre las conductas individua- les identificadas como riesgosas: inadecua- da higiene personal, hábito de fumar y con- sumo de carne mal cocida, entre otras.
Separación de los cerdos por grupos etarios.
Limitación a animales en libre pastoreo.
Finalmente, durante el proceso de revisión se halló un gran número de artículos relacionados con otras enfermedades zoonóticas emergentes asociadas con la producción porcícola, cuya aparición es relativamente reciente y que deberían ser incluidas en futuros análisis, entre ellas las infecciones por Staphylococcus aureus meticilino-resistente, Streptococcus suis, Mycobacterium bovis, Nipah virus y Norovirus (Smith et al., 2011; Pulido-Villamarín et al., 2021).












 uBio
uBio